壳聚糖/海藻酸钠水凝胶顺序释放BMP/WNT信号通路激活剂促成骨细胞分化的体外实验研究
2021-03-07郝新青王小萌闫广兴叶佳朋齐春光孙宏晨
王 晓, 郝新青, 王小萌, 闫广兴, 叶佳朋,齐春光, 孙宏晨, 史 册, 黄 洋
(1.青岛大学附属青岛市口腔医院儿童口腔科,山东 青岛 266000;2.吉林大学口腔医院儿童口腔科,3.吉林省牙发育及颌骨重塑与再生重点实验室,4.吉林大学口腔医院病理科,5.吉林大学口腔医院口腔颌面外科,吉林 长春 130000;6.中国医科大学口腔医院病理科,辽宁 沈阳 110000)
意外创伤、慢性炎症和骨肿瘤等多种原因可以导致口腔颌面部骨缺损,对患者的生理和心理健康造成严重不良影响。曾作为修复骨缺损“金标准”的自体骨移植和异体骨移植存在来源有限和并发症多等问题,应运而生的骨组织工程技术在促进骨再生修复方面表现出巨大的潜力,成为当今国内外学者研究的热点。
骨形态发生蛋白(BMP)信号通路是骨再生与骨重塑的分子生物学基础。近些年来,BMP在临床骨缺损病例中得到大量应用,但并没有证据表明单独应用BMP的临床疗效优于骨移植[1]。该结果提示,BMP在骨再生领域的应用有待进一步优化。WNT信号通路也参与骨再生与骨重塑。有研究表明,在C3H10T1/2细胞中加入WNT3a能诱导骨形态发生蛋白-9(BMP-9)的表达,从而促进 BMP信号[2]。 又有研究表明,当剪断斑马鱼尾鳍后,首先发生WNT信号依赖性上皮-间充质转化(epithelial-mesenchymal transition,EMT),进而使 EMT来源的 Runx2+的前成骨细胞数量增加。在距离断端较远处,WNT信号维持较高水平,有利于干细胞的自我更新,而距离断端较近处的BMP2B表达上调,激活了BMP信号,促进成骨细胞的分化,直至再生过程结束[3]。这一研究提示,在骨形成的动态过程中,BMP和WNT在不同阶段发挥不同作用,能够协同促进骨形成。因此,利用骨组织工程学原理构建一种双层复合材料载药系统,顺序激活BMP和WNT信号通路,有望发挥两者在骨再生修复过程中的协同作用。
壳聚糖作为一种支架材料,在体外促进成骨细胞的黏附、增殖及矿化骨基质的形成等方面具有显著效果[4]。海藻酸钠复合材料在孔隙率、机械强度、生物相容性、细胞黏附、细胞增殖、碱性磷酸酶(ALP)表达、矿化和成骨分化等方面均表现出良好的生物学和理化性能,并作为药物载体得到广泛应用[5]。利用支架材料作为载体与BMP等细胞因子结合能够显著提高成骨活性。但是细胞因子价格昂贵,无法广泛应用。具有相同或相似作用的生物小分子化合物成为良好的替代品。FK506作为BMP信号通路激活剂,能够在体外促进成骨细胞的分化,在体内局部给药可诱导矿化[6]。BIO为WNT信号通路激活剂,适宜浓度的BIO可以促进骨髓间充质干细胞的增殖和成骨向分化[7]。因此,我们设想通过构建一种壳聚糖/海藻酸钠双层复合材料,使其分别负载BIO和FK506,达到顺序释放小分子化合物并顺序激活相应信号通路的目的,有望在骨缺损区域模拟骨发育和骨再生过程,以获得更好的促进骨再生效果。
1 材料和方法
1.1 主要仪器和试剂
SZX体式显微镜,壳聚糖(Sigma公司,美国);海藻酸钠(光复精细化工有限公司,中国);无水氯化钙(西陇化工股份有限公司,中国);FK506(Sigma公司,美国);BIO(Sigma 公司,美国);H-DMEM 培养液粉剂,胎牛血清,青链霉素双抗(Gibco公司,美国);胰蛋白酶(Gibco公司,美国);磷酸盐缓冲液(phosphate buffered saline,PBS,无锡傲锐东源生物科技有限公司,中国);CCK-8试剂盒(Bimake公司,美国);ALP染色试剂盒(Sigma公司,美国);茜素红(Sigma公司,美国);RNA提取试剂盒(北京博迈德基因技术有限公司,中国)。
1.2 FK506和BIO浓度的确定
1.2.1FK506和BIO对前成骨细胞系MC3T3-E1细胞活性的影响 将小鼠前成骨细胞系MC3T3-E1细胞以5 000个/孔的密度接种于96孔板中,24 h后分别加入质量浓度为 0.1、0.5、1.0、2.0、4.0 μg/mL的 FK506 和浓度为 0.1、0.5、1.0、2.0 μmol/L 的 BIO,并以不加药组为空白对照组。每3 d换液,分别于1、3、5、7 d 时进行 CCK-8 检测。
1.2.2FK506和BIO对前成骨细胞系MC3T3-E1细胞成骨向分化的影响 根据1.2.1的实验结果对药物浓度进行初筛,确定无细胞毒性的药物浓度范围。将MC3T3-E1细胞以5 000个/孔的密度接种于24孔板中,24 h后分别加入质量浓度为0.5、1.0、2.0 μg/mL 的 FK506 和浓度为 0.1、0.5 μmol/L 的BIO,并以不加药组为空白对照组,分别于7、14 d时进行ALP染色,21 d时进行茜素红染色并定量。
1.3 壳聚糖/海藻酸钠双层复合材料的制备及表征
1.3.1壳聚糖/海藻酸钠复合材料的制备 称取1 g壳聚糖加入盛有50 mL蒸馏水的烧瓶中,磁力搅拌3 h后呈半透明状,用醋酸调pH至中性,加入京尼平0.1 g,搅拌30 min后,移入6孔板中,置37°C孵箱过夜,次日取出,晾至常温后置-80°C过夜,次日冻干。冻干后的壳聚糖为均匀一致的片状,用铳子将其制备成直径为5 mm的圆片状,备用。称取22.2 g无水氯化钙加入盛有50 mL蒸馏水的烧瓶中,磁力搅拌至澄清透明的氯化钙溶液,调pH至中性。称取1.25 g海藻酸钠加入盛有50 mL蒸馏水的烧瓶中,磁力搅拌均匀,调pH至中性,超声振荡至无气泡。将制备的壳聚糖圆片在氯化钙溶液中充分浸泡,在海藻酸钠溶液中翻滚1 min后取出,制备出大小均匀的双层复合结构,将其置于氯化钙溶液中浸泡8 h以上,使外层海藻酸钠与氯化钙反应充分。
1.3.2壳聚糖/海藻酸钠复合材料微观形态的观察 将制备好的壳聚糖/海藻酸钠复合材料进行冷冻干燥,扫描电镜观察其纵剖面。
1.3.3壳聚糖/海藻酸钠复合材料的降解 取6个壳聚糖/海藻酸钠复合材料置于盛有2 mL PBS的离心管中,放置于37°C孵箱中,分别于0、2、6、12 h和 1、2、3、5、7、14、21、28、35 d 时称量。
1.3.4载药壳聚糖/海藻酸钠复合材料的制备及药物释放曲线的检测 为了测定药物的释放曲线,我们合成了单独在外层海藻酸钠载FK506的复合材料及单独在内层壳聚糖载BIO的复合材料。采用紫外分光光度计绘制FK506和BIO的标准曲线,并分别检测FK506和BIO的释放规律。将单纯外载FK506的复合材料置于盛有2 mL PBS的离心管中,并放置于 37 °C 孵箱中,分别于 2、6、12 h 和 1、2、3、5、7、14 d 时收集溶液, 测定 FK506 的浓度;将单纯内载BIO的复合材料置于盛有2 mL PBS的离心管中,并放置于 37 °C 孵箱中,分别于 1、2、3、5 d时收集溶液,测定BIO的浓度,检测到释放后,分别间隔6、12 h和1、2、3 d收集溶液,测定BIO的浓度。
1.4 壳聚糖/海藻酸钠载药复合材料对前成骨细胞系MC3T3-E1成骨向分化的影响
制备不载药的单纯材料、内载FK506+外载FK506、内载 BIO+外载 FK506、内载 BIO+外载 BIO和内载FK506+外载BIO 5种不同材料。每组加入10 mL H-DMEM培养液,充分浸泡,24 h后收集材料浸提液,之后每间隔3 d收集材料浸提液。将MC3T3-E1细胞以5 000个/孔的密度接种于6孔板中,24 h后换为成骨诱导液培养,加入不同材料浸提液,并设置不加材料浸提液的空白对照组,每3 d换液,分别于7、14 d进行ALP染色,21 d进行茜素红染色。14 d收集细胞,提取mRNA,采用RT-qPCR方法检测成骨相关基因 Runx2、Sp7和OCN的表达。引物序列见表1。
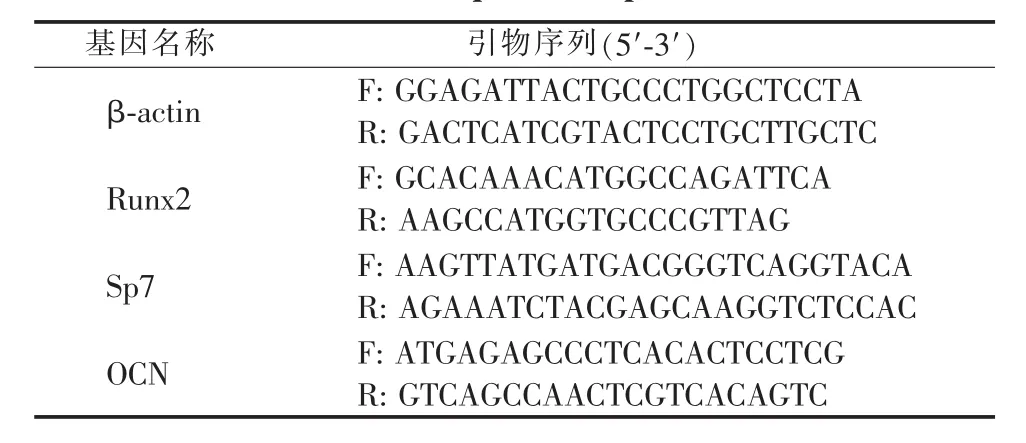
表1 引物序列Table 1 Sequences of primers
1.5 统计学分析
使用GraphPad Prism 7.0软件处理数据,通过非配对t检验对数据进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度FK506和BIO对细胞存活和成骨分化的影响
应用CCK-8法检测不同质量浓度的FK506和BIO对MC3T3-E1细胞增殖活性的影响(图1)。与空白对照组(0 μg/mL)相比,FK506 组 1、3、5、7 d 均没有表现出明显的细胞毒性,FK506在质量浓度为2.0 μg/mL时的不同时间点均表现出较强的促进细胞存活的能力,而质量浓度为0.1 μg/mL和4.0 μg/mL的FK506在5 d和7 d时,细胞的存活能力与对照组相比,差异没有统计学意义(图1A);BIO浓度为 1.0 μmol/L 和 2.0 μmol/L 时, 其 1、3、5、7 d 时表现出一定的细胞毒性,0.1 μmol/L的BIO在3、5 d时,细胞的存活能力高于对照组(图1B)。因此,我们选择 0.5、1.0、2.0 μg/mL 的 FK506 和 0.1、0.5 μmol/L的BIO进行成骨细胞分化方面的实验。
7 d和14 d的ALP染色结果显示,FK506在2.0 μg/mL时,ALP 的活性高于其他组 (图 2A、2B);而21 d茜素红染色及定量结果显示,在BIO为0.1 μmol/L 时,钙结节明显多于其他组(图 2C、2D)。这一结果说明在MC3T3-E1细胞的成骨向分化过程中,FK506在早期发挥促进ALP活性的作用,BIO发挥长期作用有利于钙结节的形成。因此,我们初步确定了后续实验中用到的FK506的质量浓度为2.0 μg/mL,BIO 浓度为 0.1 μmol/L。
2.2 壳聚糖/海藻酸钠复合材料微观形态结构
扫描电镜结果显示,外层海藻酸钠均匀一致,紧密光滑;内层壳聚糖具有较大的孔洞,多孔结构比较疏松(图3)。

图1 不同浓度药物对细胞存活的影响Figure 1 Effects of different concentrations of drugs on cell viability
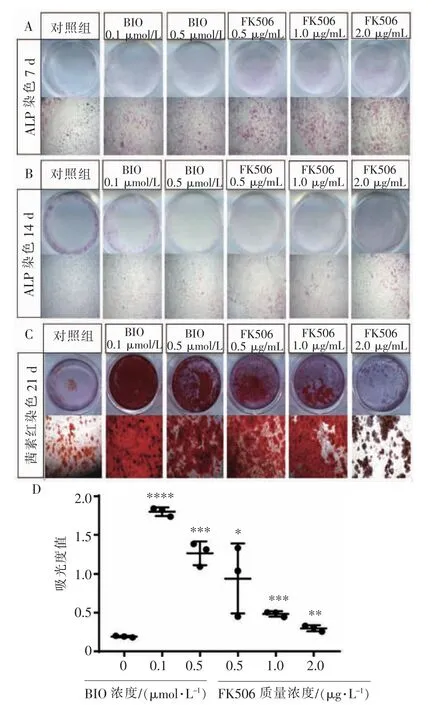
图2 不同浓度药物对MC3T3-E1细胞成骨向分化的影响Figure 2 Effectsofdifferentconcentrationsofdrugson osteogenic differentiation of MC3T3-E1 cells

图3 壳聚糖/海藻酸钠扫描电镜图Figure 3 Scanning electron microscope image of chitosan/sodium alginate composite
2.3 壳聚糖/海藻酸钠复合材料的降解
实验结果显示,2 h时,材料降解率达14.10%,24 h内缓慢稳定降解,2 d时,降解率达27.24%,3 d时,达45.50%,5 d时,达74.05%,7 d时达 86.62%,14 d时,达88.22%,之后缓慢稳定降解,至35 d时,降解率达94.28%(图4)。
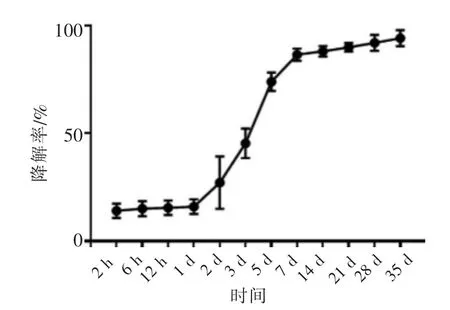
图4 壳聚糖/海藻酸钠复合材料降解曲线Figure 4 Degradation curve of chitosan/sodium alginate composite
2.4 壳聚糖/海藻酸钠载药复合材料药物释放规律
结果显示,外层FK506缓慢持续释放。如图5A所示,6 h时,释放率为11.22%,12 h时,为27.92%,1 d时,释放率为46.72%,2 d时,为63.29%,3 d时,为72.38%,5 d时,达81.82%,7 d时进入平台期后,释放率为89.86%,14 d时仍有少量药物释放,释放率达90.37%。内层BIO的释放规律如图5B所示,在5 d时检测到药物释放,释放率达17.63%,之后的 6、12、24、48 h 时 的 释 放 率 分 别 为 29.03% 、50.90%、72.82%和90.96%,48 h后检测不到药物浓度。结果提示,内层BIO在开始释放后的48 h内基本释放完毕,之后可能有极小浓度的BIO释放。
2.5 载药壳聚糖/海藻酸钠复合材料对前成骨细胞成骨向分化的影响
用载药材料的浸提液处理前成骨细胞系MC3T3-E1。ALP染色结果显示,在7 d和14 d时,内载BIO外载FK506的实验组ALP染色强度及面积均较其他组强(图6A、6B)。21 d茜素红染色结果显示,内载BIO外载FK506的实验组钙结节明显多于其他组 (图6C、6D)。这一结果表明,先释放FK506再释放BIO能明显促进MC3T3-E1细胞在体外的成骨向分化。14 d时RT-qPCR结果(图6E)显示,与对照组相比,内载BIO外载FK506组、内载BIO外载BIO组、内载FK506外载BIO组Runx2表达量明显高于对照组,其中,内载BIO外载FK506组升高最明显(P<0.001);与对照组相比,其他组OCN的表达量均明显升高,其中内载BIO外载FK506组升高最明显(P<0.001);除内载FK506外载FK506组外,其余组Sp7表达量均有不同程度的降低。
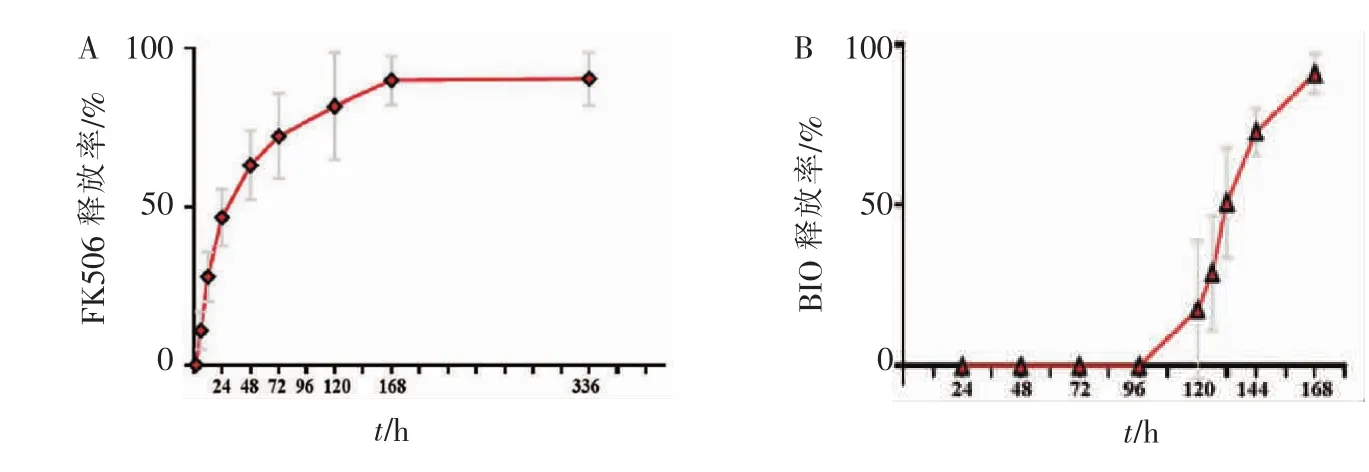
图5 载药壳聚糖/海藻酸钠复合材料药物释放规律Figure 5 Drug release of chitosan/sodium alginate composite loaded with drugs
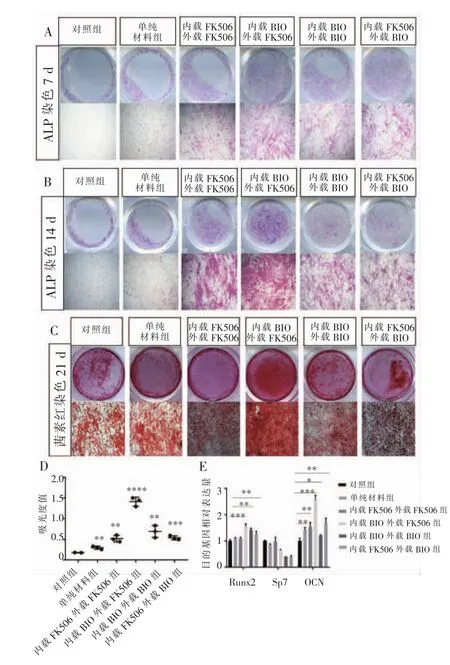
图6 载药壳聚糖/海藻酸钠复合材料对MC3T3-E1细胞成骨向分化的影响Figure 6 Effects of drug-loaded chitosan/sodium alginate composites on osteogenic differentiation of MC3T3-E1 cells
3 讨论
BMP和WNT信号通路是骨形成和骨再生过程中2条重要的信号通路,这2种信号通路通过多种途径发生复杂的相互作用,而这种相互作用既可以是相互协同的,也可以是相互拮抗的。因此,寻找一种有效的方法,发挥两者的协同作用,抵消其拮抗作用有望获得更有效的促进骨再生效果。在本实验中,我们构建了内外分别负载BIO和FK506的壳聚糖/海藻酸钠双层复合材料,使其顺序激活BMP和WNT信号通路,并通过ALP染色、茜素红染色和对成骨相关基因表达的检测,对细胞在体外的成骨分化能力进行评估。结果显示,壳聚糖/海藻酸钠水凝胶顺序释放FK506和BIO,顺序激活BMP和WNT信号通路,促进了前成骨细胞MC3T3-E1细胞在体外的成骨向分化。
本实验中,我们根据斑马鱼尾鳍完全再生的实验最先提出的假设为,WNT信号通路在早期发挥作用促进细胞的增殖,BMP信号通路在晚期发挥作用促进细胞的成骨向分化。而我们的ALP染色和茜素红染色结果显示,质量浓度为2.0 μg/mL的FK506,其早期促进前成骨细胞MC3T3-E1成骨向分化的能力优于BIO,而浓度为0.1 μmol/L的BIO促进钙结节形成的能力优于FK506。这与我们最初的假设相反,可能与BMP和WNT信号通路的交叉对话有关。有研究表明,在小鼠体内成骨细胞中,特异性敲除Ⅰ型BMP受体Acvr1或Bmpr1a,小鼠骨量和骨密度均显著增加,这是由于BMP受体缺失后,WNT信号抑制因子SOST和DKK1下调,WNT信号增高导致的[8]。结果表明,在成骨细胞分化和骨重塑过程中,BMP信号会抑制WNT信号,而WNT信号的升高有利于矿化基质的形成。因此,在本实验中,细胞成骨诱导培养21 d后,BIO组钙结节形成能力更强(图2C),也进一步证实WNT信号在成骨细胞分化末期发挥促进矿化的作用。进一步的实验结果显示,内载BIO外载FK506的实验组钙结节形成量明显多于其他组(图6D),表明BMP和WNT信号的顺序激活,能够部分抵消BMP信号对WNT信号的抑制作用,且能使WNT信号进一步发挥促进矿化的作用,从而更有效地促进成骨向分化。
结果显示,在载药复合材料浸提液作用下的前成骨细胞MC3T3-E1,在成骨诱导培养14 d后,Runx2和OCN的表达明显升高,尤其是内载BIO外载FK506组;而同样作为成骨细胞分化标志物的Sp7的相对表达量则出现了降低现象(图6E),这可能与成骨细胞所处的分化时期有关。有研究表明,Sp7主要在小鼠成骨细胞分化的早期发挥作用,而抑制了成骨细胞的晚期分化[9]。随着成骨细胞的分化成熟及矿化结节的形成,Sp7的表达逐渐减少。在本实验中,OCN的表达显著升高,说明成骨细胞处于晚期分化阶段,此时Sp7表达被抑制。因此,与对照组相比,除内载FK506外载FK506组外,其余组Sp7表达降低。又有研究表明,在体外成骨细胞培养过程中,Sp7的表达是随着BMP信号的增强而增加的[10]。在本实验中,14 d时,外层材料大部分降解完成(图4),BMP信号通路激活剂FK506已基本释放完毕(图5A),BMP信号较早期减弱,这可能是内载FK506外载FK506组Sp7表达无变化,而其他组Sp7相对表达量降低的原因之一。
壳聚糖作为药物载体的缺点是药物的突释现象,即药物在短期内快速大量释放。有文献报道,用海藻酸盐等聚合物包覆壳聚糖微球,可提高药物包封率,增加稳定性,减少所含治疗剂的瞬时大量释放[11]。在本实验中,内层壳聚糖所载BIO在第5天时开始释放,48 h内逐步释放完成,有一定的缓释作用,有效减少了药物的突释,使得材料的性能得以优化,有望在临床中得到应用。
综上所述,BMP和WNT信号通路的顺序激活,能够充分发挥2种信号通路的协同作用,减弱其拮抗作用。本实验构建的壳聚糖/海藻酸钠水凝胶能够顺序释放BMP和WNT信号通路激活剂,进而有效促进前成骨细胞系MC3T3-E1在体外的成骨向分化。这为临床治疗骨缺损、促进骨再生提供了新的思路。
