新疆地区妇女宫颈感染人乳头瘤病毒16型E1、E2的遗传变异分析
2021-03-07王露月王芳付少伟张春贺刘依萌者湘漪李洪涛李冬妹潘泽民
王露月,王芳,付少伟,张春贺,刘依萌,者湘漪,,李洪涛,李冬妹,潘泽民*
(1 石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002;2 天津医科大学基础医学院临床医学系,天津 300070;3 石河子大学医学院人体解剖学与组织胚胎学教研室,新疆 石河子 832002)
宫颈癌是全世界最常见的癌症之一,在女性中的发病率和病死率仅次于乳腺癌[1]。中国宫颈癌的发病率和病死率稳步下降。然而,在新疆维吾尔自治区等一些边远贫困地区,宫颈癌的发病率和病死率仍然很高[2]。新疆地区HPV阳性率为14.02%,且多为HPV16、HPV18、HPV52和HPV53[3]。
持续性高危型HPV感染可能导致癌前病变,如果不及时发现和治疗,其中一部分会发展成浸润性癌[4]。按照HPV病毒进化学分类,该病毒的天然遗传变异通常分为A、B、C、D 4个主要变异谱系,A谱系:欧洲原型EUR(A1-A3)、亚洲型As(A4),B谱系:非洲Ⅰ型(AF-1),C谱系:非洲Ⅱ型(AF-2),D谱系:亚-美型(AA)和北美型(NA)[5]。新疆妇女HPV16的感染率较高,且多为欧洲株[6-7]。HPV16 E1、E2蛋白在HPV感染宿主细胞过程中承担着重要的角色。HPV16 E1和E2可调节病毒基因组复制[8]。HPV E1是最保守的蛋白质之一,在启动HPV DNA复制中起着核心作用。HPV E2蛋白是病毒生命周期中的关键蛋白,在转录调控、DNA复制启动和病毒基因组分割等方面具有重要的功能[9]。其结构类似于典型的转录因子,具有一个反式激活域和一个羧基末端DNA结合域,由可变铰链区隔开[10]。在DNA复制的起点,E2与HPV E1复制解旋酶相互作用,促进细胞DNA复制[11]。HPV E1的变异可导致病毒增强原代细胞的永生化能力[12]。HPV16病毒E2结构的缺失在HPV16阳性肿瘤的患者中具有更差的临床结果[13]。
HPV16 E1和E2核苷酸位点的变异与宫颈癌的发生相关[14-15]。因此,分析新疆地区的女性宫颈癌的基因多态性有助我们更好地理解HPV基因变异与宫颈癌的关系。
1 材料与方法
1.1 样本的收集
收集新疆伊犁洲友谊医院、喀什人民医院和新疆维吾尔自治区人民医院宫颈病变妇女宫颈粘液脱落细胞,共获得80例HPV16感染阳性样本并得到所有患者的知情同意。所有患者均无长期居住在外地的病史。样品于-80 ℃低温冰箱中储存。
1.2 样本的DNA提取及PCR扩增
使用上海生工基因组DNA提取试剂盒,按照说明书提取基因组DNA,提取后的DNA储存于-20 ℃保存。用1%琼脂糖电泳对1 μL DNA样本进行质量检查并估计浓度,然后将样本稀释到工作浓度10~20 ng·μL-1。反应混合物(20 μL)包括1×GC缓冲液I(TAKARA),Mg2 +2.5 mmol·L-1,dNTP 0.2 mmol·L-1,每种引物各0.2 μmol·L-1,1 U HotStarTaq聚合酶(TAKARA)和1 μL模板DNA。反应温度为95 ℃ 2 min;11个周期×(94 ℃ 20 s,62 ℃-0.5 ℃/周期40 s,72 ℃ 1 min);24个周期×(94 ℃ 20 s,57 ℃ 30 s,72 ℃ 1 min);72 ℃ 2 min,4 ℃保温。PCR产物可存放于4 ℃冰箱中。PCR引物信息详见表1。

表1 引物信息
1.3 测序
测序由上海天昊科技有限公司进行,PCR产物经SAP(Promega)和EXO I(Epicentre)纯化,将0.5U SAP和4U Exo I添加到8 μL PCR产物中,混合物孵育37 ℃ 60 min,75 ℃ 15 min。最后用ABI 公司的Big- Dye Terminator v3.1 Cycle Sequencing Kit,并经酒精纯化后再在DNA分析仪(ABI3130XL)上样测序。测序引物为表1中的 E-1R:5′-ACTGCAACCACCCCCACT-3′,E-2R:5′-ATCCATTCTGGCGTGTCTCC-3′,E-3F:5′-TCATGGGGAATGGTTGTGTT-3′,E-4F:5′-GGTGATTGGAAGCAAATTGTTATG-3′,E-5R:5′-CCCGCATGAACTTCCCATAC-3′,E-6F:5′-GAAGCATCAGTAACTGTGGTAGAGG-3′。
1.4 HPV16变异株的进化学分析
测序结果使用Polyphred软件分析单核苷酸多态性(single nucleotide polymorphism,SNP),与HPV16欧洲标准株(GenBank:NC_001526.2)进行比对,同时与其他典型HPV变异株HQ644283.1(A1),HQ644268.1(A1),HQ644280.1(A1),HQ644282.1(A1),AF536179.1(A2),HQ644236.1(A3),HQ644248.1(A4),HQ644251.1(A4),AF534061.1(A4),HQ644235.1(A4),HQ644240.1(B1),HQ644290.1(B1),HQ644238.1(B1),HQ644298.1(B3),HQ644237.1(C),HQ644239.1(C),HQ644249.1(C),HQ644250.1(C),AF472509.1(C),HQ644257.1(D1),HQ644279.1(D2),HQ644281.1(D2),HQ644263.1(D2),HQ644277.1(D2),HQ644247.1(D3),HQ644253.1(D3),HQ644255.1(D3),AF402678.1(D3)进行比对。进化树通过MEGA7软件构建。
1.5 统计学分析
HPV16 E1、E2基因的每个变异频率通过直接计数确定。进行卡方检验,以确定HPV16E1、E2变异和宫颈癌之间的关联。
统计分析使用SPSS 17.0进行。P<0.05 被认为具有统计学意义。
2 结果
2.1 HPV16 E1、E2基因的突变分析
HPV16 E1、E2基因突变分析共对80例HPV16 感染阳性的DNA样本进行测序,用HPV16原型(欧洲株,GenBank登录号:NC_001526.2)作为标准株进行比对,多态性位点如表2、表3所示。
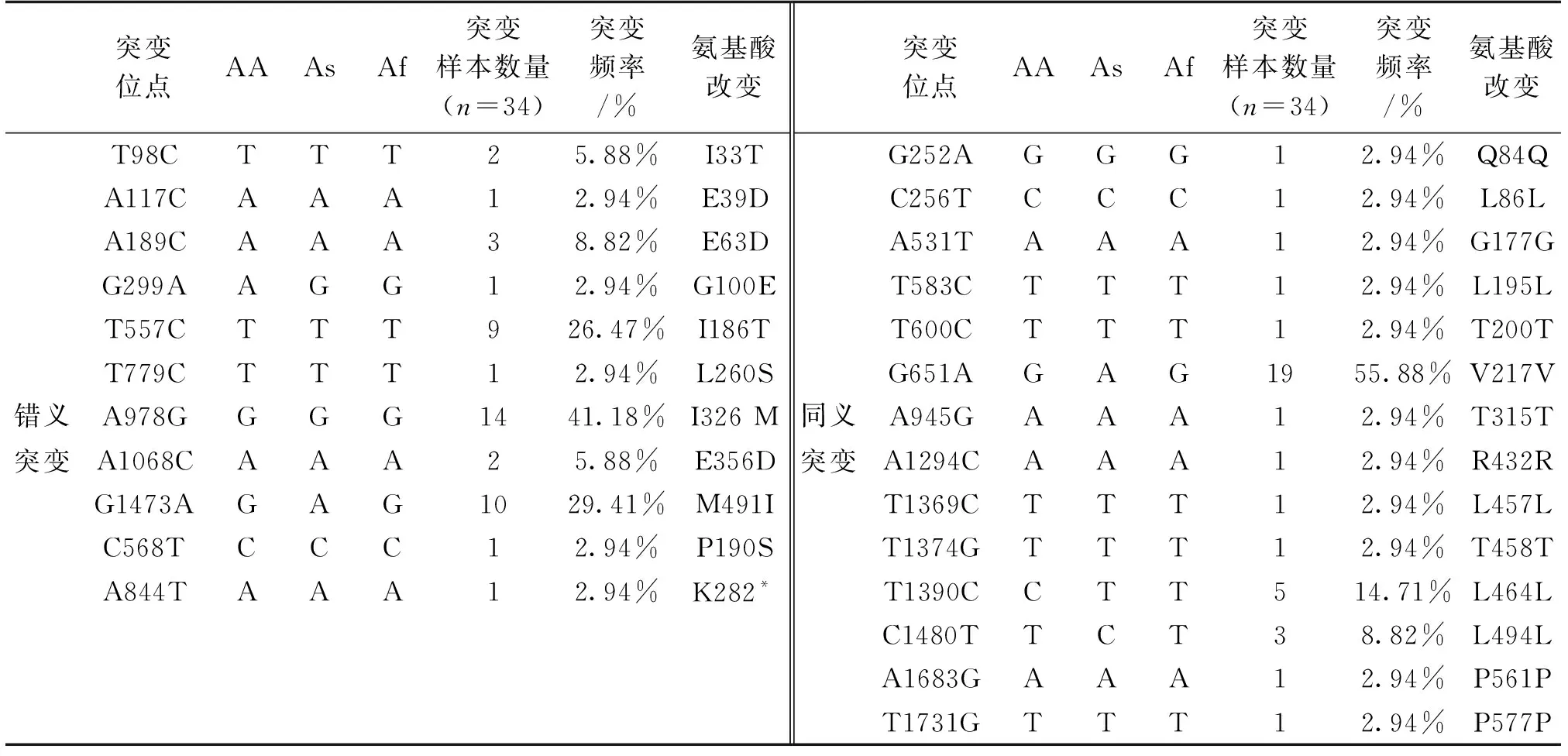
表2 HPV16 E1基因突变和氨基酸的改变
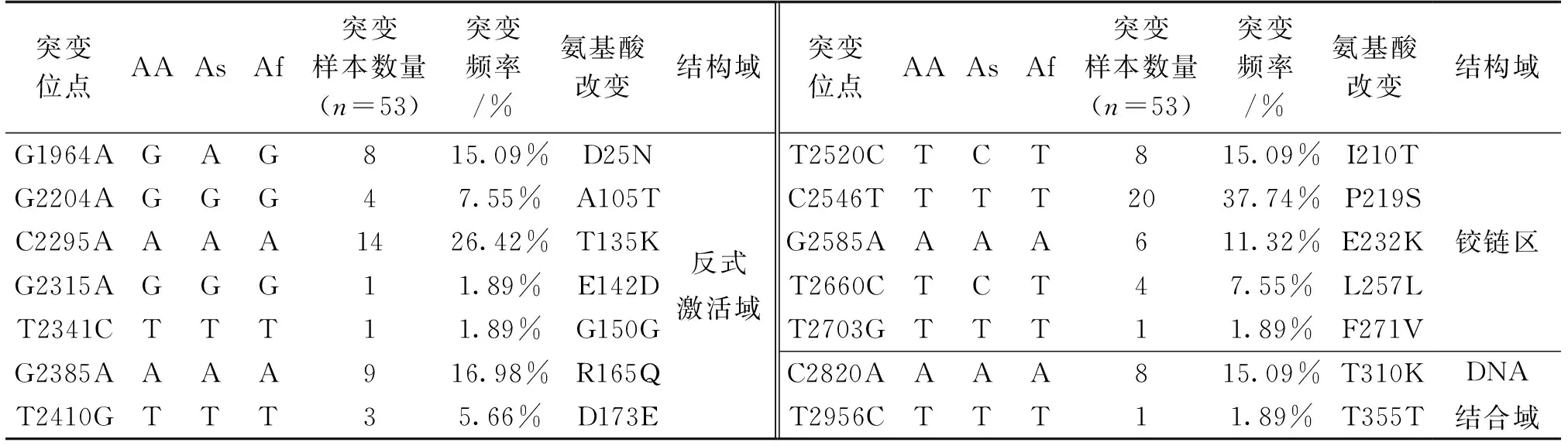
表3 HPV16 E2基因突变和氨基酸的改变
对于80例HPV16阳性样本中,在HPV16 E1发生突变的样本有34个,发生核苷酸突变的位点有25个(11个错义突变,14个同义突变)。以上表格2中显示HPV16 E1基因突变和氨基酸的改变,错义突变分别为T98C(2/34)、A117C(1/34)、A189C(3/34)、G299A(1/34)、T557C(9/34)、T779C(1/34)、A978G(14/34)、A1068C(2/34)、G1473A(10/34)、C568T(1/34)、A844T(1/34),氨基酸由异亮氨酸转变为苏氨酸(I33T)、谷氨酸转变为天冬氨酸(E39D)、谷氨酸转变为天冬氨酸(E63D)、甘氨酸转变为谷氨酸(G100E)、异亮氨酸转变为苏氨酸(I186T)、亮氨酸转变为丝氨酸(L260S)、异亮氨酸转变为甲硫氨酸(I326 M)、谷氨酸转变为天冬氨酸(E356D)、甲硫氨酸转变为异亮氨酸(M491I)、脯氨酸转变为丝氨酸(P190S)、赖氨酸转变为终止密码子(K282*)。同义突变为nt2529(G~A)(1/34)、nt256(C~T)(1/34)、nt531(A~T)(1/34)、nt583(T~C)(1/34)、nt600(T~C)(1/34)、nt651(G~A)(19/34)、nt945(A~G)(1/34)、nt1294(A~C)(1/34)、nt1369(T~C)(1/34)、nt1374(T~G)(1/34)、nt1390(T~C)(5/34)、1480(C~T)(3/34)、nt1683(A~G)(1/34)、nt1731(T~G)(1/34)。另外,在nt510-511之间有一段63个碱基的插入序列,有5个样本在此处发生了碱基的插入(5/34)。HPV16 E1的同义突变较多,可表明E1蛋白的保守性较好。在HPV16 E1上常见的核苷酸突变位点为A978G、G1473A所对应的氨基酸改变为I326M、M491I。
在80例HPV16阳性样本中,HPV16 E2发生突变的样本有53个,发生核苷酸突变的位点有14个,(11个错义突变,3个同义突变)。以上表格3中显示HPV16 E2基因突变和氨基酸的改变,核苷酸突变位点分别为G1964A(8/53)、G2204A(4/53)、C2295A(14/53)、G2315A(1/53)、G2385A(9/53)、T2410G(3/53)位于HPV16 E2的反式激活域,氨基酸分别由天冬氨酸转变为天冬酰胺(D25N)、丙氨酸转变为苏氨酸(A105T)、苏氨酸转变为赖氨酸(T135 K)、谷氨酸转变为天冬氨酸(E142D)、精氨酸转变为谷氨酰胺(R165Q)、天冬氨酸转变为谷氨酸(D173E),还有一处同义突变为nt2341(T~C)(1/53)。铰链区的核苷酸突变为T2520C(8/53)、C2546T(20/53)、G2585A(6/53)、T2703G(1/53),氨基酸分别由异亮氨酸转变为苏氨酸(I210T)、脯氨酸转变为丝氨酸/苏氨酸(P219S)、谷氨酸转变为赖氨酸(E232K)、苯丙氨酸转变为缬氨酸(F271V),还有一处同义突变为nt2660(T~C)(4/53)。DNA结合域的核苷酸突变为C2820A(8/53),氨基酸由苏氨酸转变为赖氨酸(T310K),还有一处同义突变为nt2956(T~C)(1/53)。在HPV16 E2上常见的核苷酸突变位点为C2295A、C2546T,所对应的氨基酸改变为T135K、P219S。
2.2 HPV16 E1和E2核苷酸序列系统发育树分析
HPV16 E1和E2核苷酸序列系统发育树分析,见图1。
系统发育树的构建采用N-J 法,并选择Bootstrap method(1000 replications)和Kimura 2-parameter model构建系统发育树,Bootstrap值>50%表示具有可信度,Bootstrap值>70%表示可信度较高,图1进化树图已隐藏Bootstrap值<50%的节点。由系统发育树结果可看出有77个样本属于欧洲株,3个样本属于亚洲株。没有发现非洲株和北美/亚裔株。通过对HPV16变异体的核苷酸序列构建系统发育树分析可知,样本15、18、36的变异都与T2410G的突变有关且均为亚洲株。
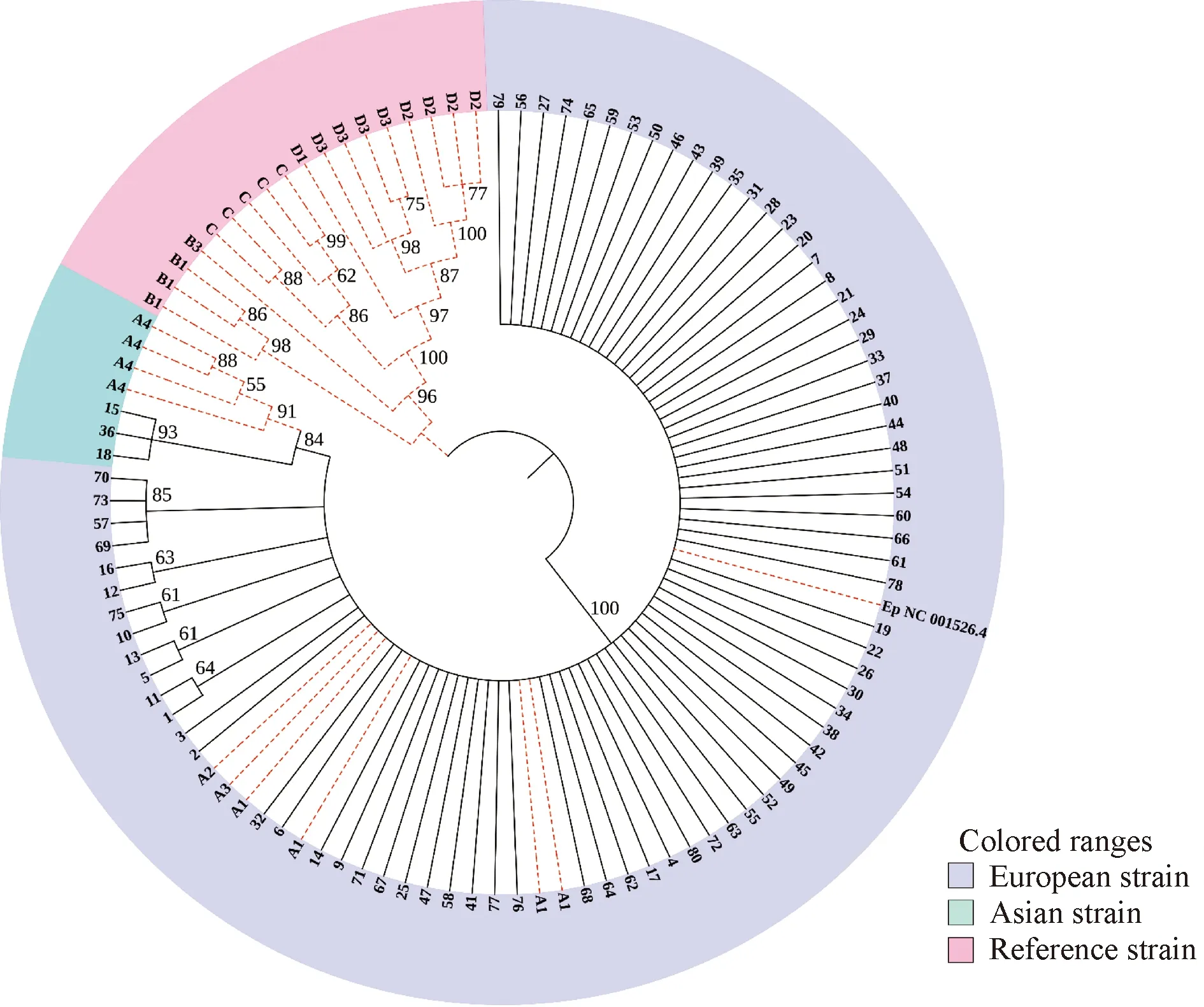
图1 HPV16 E1、E2基因的系统发育树分析
2.3 病例组和对照组中基因组HPV16 E1、E2的基因变异
表4显示了对照组和病例组中的HPV16 E1基因变异。在HPV16 E1基因序列的分子变异分析中,共观察到对照组17个突变,8个属于错义突变,9个同义突变。在病例组中存在16个突变,8个属于错义突变,8个同义突变。在病例组和对照组中,有两个位点的变异表明病例组与对照组之间具有显著性差异(P<0.05)。分别为T98C和G651A(G651A为同义突变,T98C为错义突变)。表5显示了HPV16 E2基因变异在对照组和病例组中的情况。在HPV16 E2基因序列的分子变异分析中,共观察到对照组13个突变,均属于错义突变。在病例组中存在10个变异,9个属于错义突变,1个同义突变。未发现在对照组和病例组间具有差异的位点。
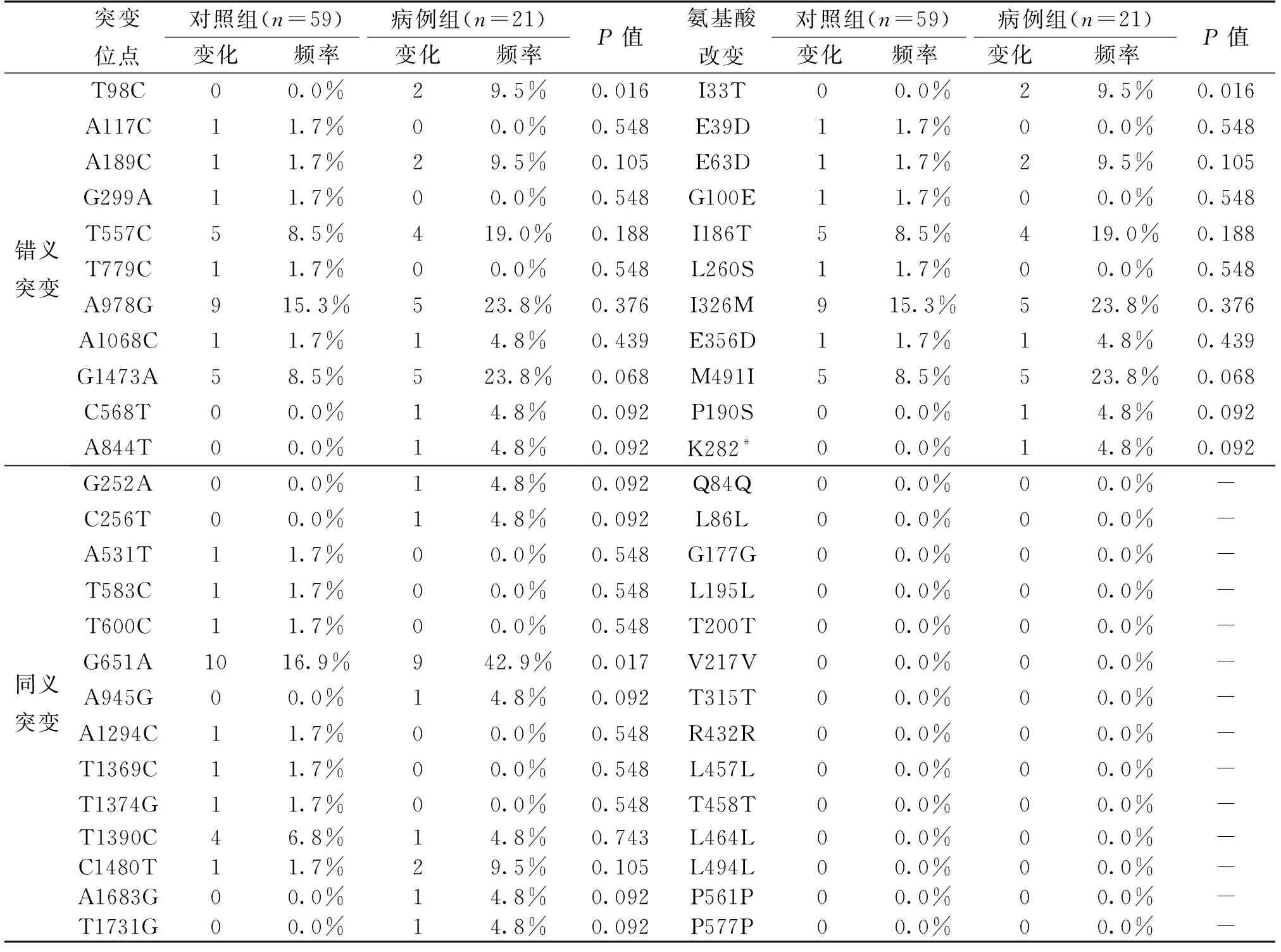
表4 病例组和对照组中基因组HPV16 E1的基因变异
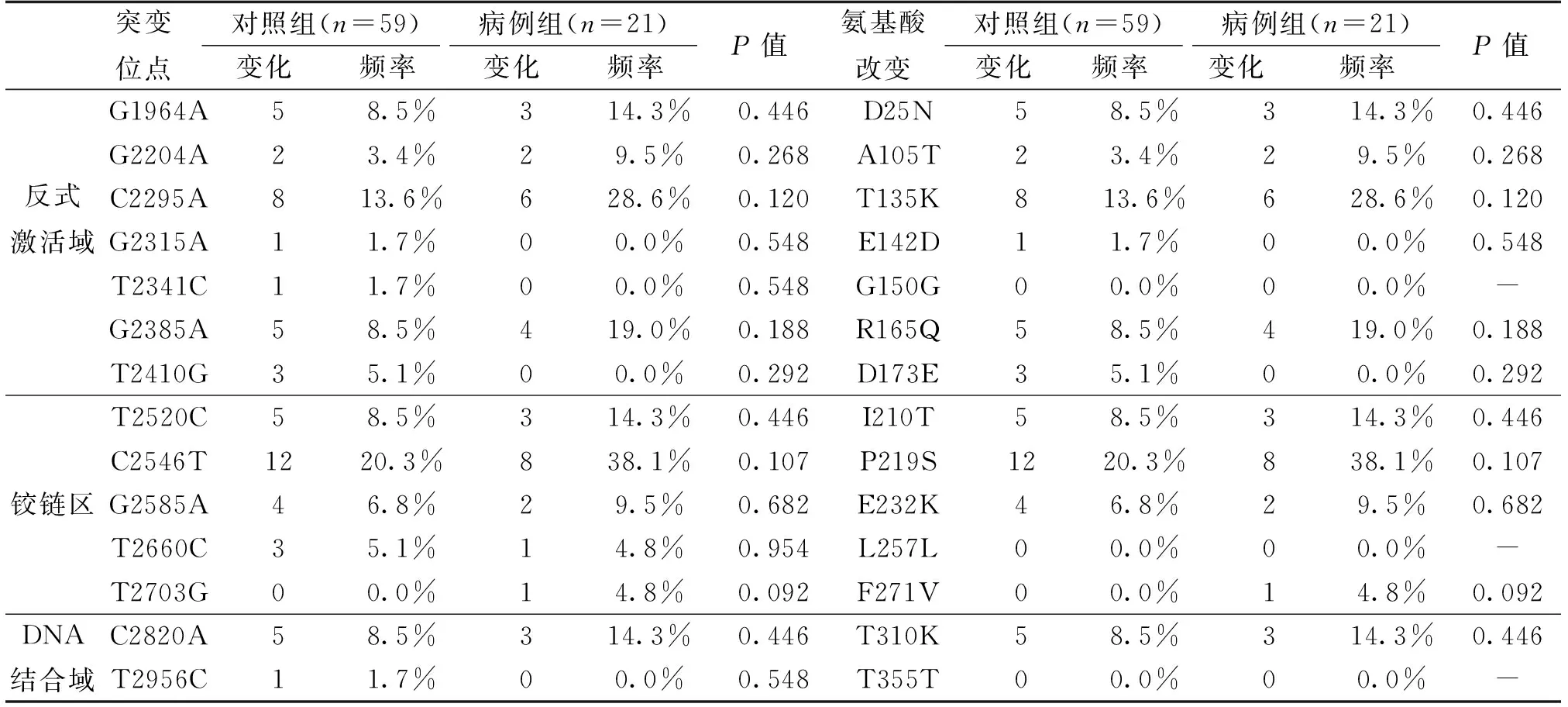
表5 病例组和对照组中基因组HPV16 E2的基因变异
3 讨论
HPV16中部分核苷酸的变异会影响氨基酸的改变,可能也会影响蛋白质的表达,从而对宫颈癌的发展产生影响。大多数人对于HPV核苷酸多态性的研究都集中于E6和E7[6]。而HPVE1和E2基因的变异或缺失会抑制病毒的转录活性,并导致E6和E7基因的过度表达并且激活端粒酶的活性使得细胞永生化[16]。在HPV16 E1的nt510-511之间有63个碱基组成的插入序列,该突变体与病毒致癌活性及病毒整合相关[17]。HPV16 E2 DNA结合域中的T310 K的变异可能改变细胞转录因子,E2蛋白与LCR相互作用,从而导致E6和E7蛋白的表达增强[18]。E232 K是HPV16As E2铰链区的连锁变异,能增强LCR活性的剂量依赖性抑制,会影响病毒致癌的可能性[19]。位于HPV16 E2反式激活域中的E39A的变异则会中断其与E1的相互作用活性和复制功能,但不影响E2的转录激活[20]。
由系统发育树结果可看出80例HPV阳性样本中,有77个样本属于欧洲株,3个样本属于亚洲株。没有发现非洲株和北美/亚裔株。在HPV16 E1上常见的核苷酸突变位点为A978G和G1473A,所对应的氨基酸改变为I326 M和M491I。在HPV16 E2上常见的核苷酸突变位点为C2295A、C2546T,所对应的氨基酸改变为T135 K、P219S。同时,E1上存在较多的同义突变,可说明E1蛋白的保守性较好。
在本研究发现的HPV16 E1的核苷酸突变位点T98C(2/34,5.88%)、G252A(1/34,2.94%)、C568T(1/34,2.94%)、T600C(1/34,2.94%)、A844T(1/34,2.94%)、A945G(1/34,2.94%)均未见报导。HPV16 E2位于反式激活域的核苷酸突变位点G2204A(4/53,7.55%)和位于DNA结合域的核苷酸突变位点T2956C(1/53,1.89%)也未见报导。在病例组和对照组的HPV16 E1基因序列的分子变异分析中,有两个位点的变异表明病例组与对照组之间具有显著性差异(P<0.05)。分别为T98C和G651A,由于E1蛋白是参与HPV复制的蛋白,在减轻宿主防御和破坏正常细胞循环过程方面发挥作用,最终导致癌症的发展,在病例组与对照组中存在差异,则可进一步说明这两个位点的突变可能促进影响HPV16复制的E1蛋白质表达,从而降低宿主细胞的防御能力,最终可能导致宫颈癌的发生和发展。而在HPV16 E2基因序列的分子变异分析中,未发现在对照组和病例组间具有差异的位点。未来可扩大标本量,结合临床信息分析核苷酸位点突变对癌症的影响。由于HPV E1蛋白与E2反式激活域结合,定位于转录起点,共同调控病毒的转录作用,E1上T98C和G651A的突变也可能会影响其与E2蛋白的结合作用。同时由于部分碱基的突变会导致氨基酸的变异,氨基酸改变可能对蛋白质的表达产生影响,未来也可以在结合细胞学功能的实验上来研究HPV16 E1、E2变异体在宫颈癌发生发展中的作用。
