多晶硅冷氢化过程模拟研究
2021-03-03王绪根李梦丽徐壮郭俊恒高素芳
王绪根,李梦丽,徐壮,郭俊恒,高素芳
(1 石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003;2 天津大学化工学院,天津 300072; 3石河子大学理学院,新疆 石河子 832003)
多晶硅作为电子信息、太阳能等新兴产业的基础原料[1],近年来受到了广泛关注,多晶硅的生产也得到了蓬勃发展,高纯度的多晶硅更是被一些国家列入为战略性材料[2]。地球上蕴含着丰富的石英岩矿体(SiO2),SiO2在高温电弧中可被碳还原为熔融状态的工业级硅(MG-Si),其硅含量为99%(2 N),纯度较低,不能满足电子行业及太阳能产业的所需硅的纯度。为了生产出满足要求的硅含量为99.999 9%(6 N)的太阳能级硅(SOG-Si),以及硅含量为99.999 999 9(9 N)的电子级硅(EG-Si)[3],需要对MG-Si进行分离、提纯等工序,使其纯度达到要求,此过程就是多晶硅的生产过程。
生产多晶硅的方法很多,按生产设备可分为改良西门子法、流化床法,按制备原料又可分为硅烷热分解法、冶金法[1],其中技术最成熟、应用最广泛的就是改良西门子法[4],又称TCS还原工艺。目前,国内西门子法工艺流程主要如下:在250~350 ℃的温度下,HCl和MG-Si合成TCS,接着对TCS进行分离、精馏、提纯等工序,接着进行气相沉积产生纯度较高的多晶硅[5]。由于西门子法生产1 kg多晶硅会副产24 kg 的STC,造成大量原料的浪费和环境污染,所以研究者提出了改良西门子工艺,相比于传统的西门子工艺,多了还原尾气回收[6-7]与STC氢还原[8-9]两个工序,具有节能降耗及副产物再利用的作用[10]。
改良西门子法生产多晶硅属于闭环工艺[11],生产过程中将硅沉积产生大量副产物STC转换为TCS过程称为氢化。STC氢化方法主要有等离子体氢化法、热氢化法、冷氢化法[12],其中,等离子体氢化法射频电源特点的限制而未工业化;热氢化法反应温度在1 200~1 250 ℃,单程转化率20~25%,且为防止反应的进行出口在0.05 s内冷却到300 ℃以下,因此热氢化反应条件苛刻且能耗大[13];冷氢化法反应温度在400~600 ℃,单程转化率15~35%[14],是目前国内外应用最广泛的工艺,与热氢化法相比可节约大量能量。STC冷氢化是原料在铜基或镍基催化剂的作用下生成TCS,其反应方程式为3SiCl4+ 2H2+ Si → 4SiHCl3[15]。实际上STC冷氢化是由两个反应组成,首先STC和H2反应生成TCS和中间产物HCl,HCl生成后立即与MG-Si反应生成TCS。STC和H2的反应称为STC均相加氢,是吸热、慢反应,是整个反应的速控步;HCl与MG-Si发生氯氢化反应,是强放热、快反应。目前对STC冷氢化的过程研究还不够透彻,本文利用Aspen软件分别从热力学控制和动力学反应器两个方面进行计算分析,这对STC冷氢化工业过程有一定借鉴作用。
1 冷氢化过程热力学分析
为了在理论上对STC冷氢化反应的极限有一个确切的认识,本文选用Aspen软件对其不同反应的反应热、反应温度、反应原料配比等条件进行计算与分析,寻找STC冷氢化反应最优条件。张静等[16]比较气液平衡模拟值和实测值得出RK-soave和Wilson方程都可以很好描述冷氢化反应体系,比较计算和模拟得到的热容值后发现RK-Soave方程的偏差较小,因此,本文热力学方法选用RK-Soave方程。
1.1 冷氢化过程反应系统分析
STC冷氢化反应过程存在的多个反应机理过程详见表1,其平衡常数随温度的变化如图1所示。根据自由度分析,该过程存在3种元素Si、H、Cl及7种物质Si、SiH3Cl、SiH2Cl2、SiHCl3、SiCl4、H2、HCl,所以独立反应为4个,其中(1)到(4)为STC加氢的反应,从图1可知平衡常数K随温度的增加而增加,说明4个反应均为吸热反应,温度升高有利于平衡产物生成;在同一温度下对比发现,K由大到小依次为反应(1)、(3)、(2)、(4),并且这4个反应的K值都很小,如500 ℃时K(1)=6.4E-04、K(2)=9.65E-12、K(3)=3.02E-08、K(4)=3.54E-13,虽然STC加氢体系中TCS产物的K值最大,但其绝对值仍很小,因此通过STC直接加氢制备TCS在热力学上并不现实,结合反应机理过程,STC加氢为起始步骤,因此将(1)定为STC冷氢化反应的一个独立反应。
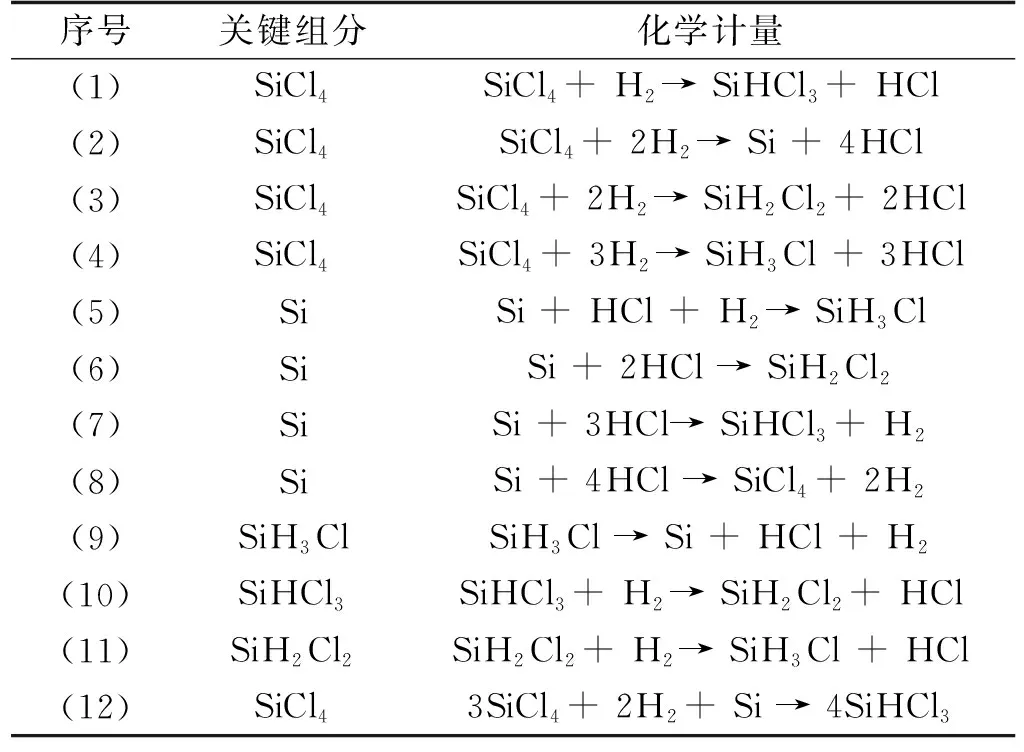
表1 冷氢化反应中存在的化学反应
表1中(5)到(8)为Si接触HCl所涉及的反应,还可以看作STC逐步和HCl的反应。由图1可知K随温度的增加而降低,说明这四个反应均为放热反应,高温不利于平衡产物;通过对比发现在同一温度下,K由大到小依次为(8)、(7)、(6)、(5),且K值很大,如500 ℃时K(5)=3.67E-02、K(6)=3.13E+03、K(7)=6.61E+07、K(8)=1.04E+11,因此将(5)、(6)、(7)定为STC冷氢化反应体系中的另外3个独立反应。(9)、(12)、(11)三个反应可以看作(5)、(6)、(7)的逆反应过程,并且K值很小,所以独立反应不考虑这三个反应。综上所述,确立STC冷氢化工艺的4个独立反应为(1)、(5)、(6)和(7),(12)为总反应方程式,主要副产物为SiH2Cl2(DCS)。
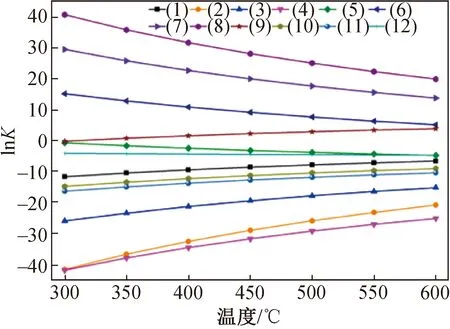
图1 STC冷氢化反应中各平衡常数随温度的变化关系
1.2 冷氢化过程反应热分析
计算STC冷氢化过程的4个独立反应和总反应的反应热,结果(图2)显示:STC加氢起始步骤为强吸热过程,Si对应的反应过程为放热过程,所有反应的反应热随温度变化很小,并且总反应(12)的反应热很小,是微弱的放热过程,反应过程中的移热不是很重要,这与动力学计算结果一致[17]。
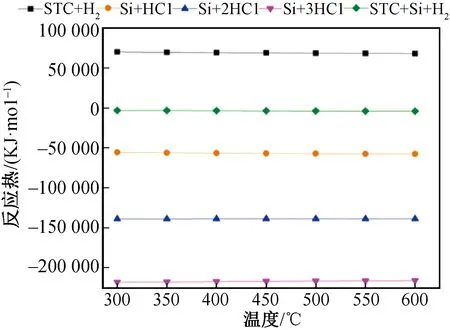
图2 各反应热随温度的变化
1.3 温度对反应平衡的影响
为了考察反应温度对产物组成的影响,在STC冷氢化反应条件为H2流量500 kmol/h、反应压力20 bar、Si流量30 kmol/h、STC流量100 kmol/h时,计算不同温度下STC、TCS、DCS、MCS、H2和Si平衡时的物质含量,结果(图3)显示:STC、TCS、DCS、MCS、H2和Si分别稳定在46、66、7、0.15、460和10左右,变化不明显,主要产物为TCS,副产物MCS含量很少,可以忽略,所以副产物主要考虑DCS。TCS随温度的升高而降低,DCS恰好相反。为提高TCS的产率且抑制副产物产生,温度不能过高也不能过低,最终确定450~550 ℃为反应最佳操作平衡温度。
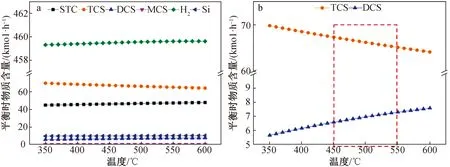
图3 各组分(a)只有TCS和DCS(b)平衡时物质含量随温度的变化
1.4 氢气比例对平衡浓度影响
在STC冷氢化反应条件为温度450 ℃、压力20 bar、Si流量30 kmol/h、STC流量100 kmol/h时模拟不同H2流量下,各物质平衡时的含量,结果(图4)显示:
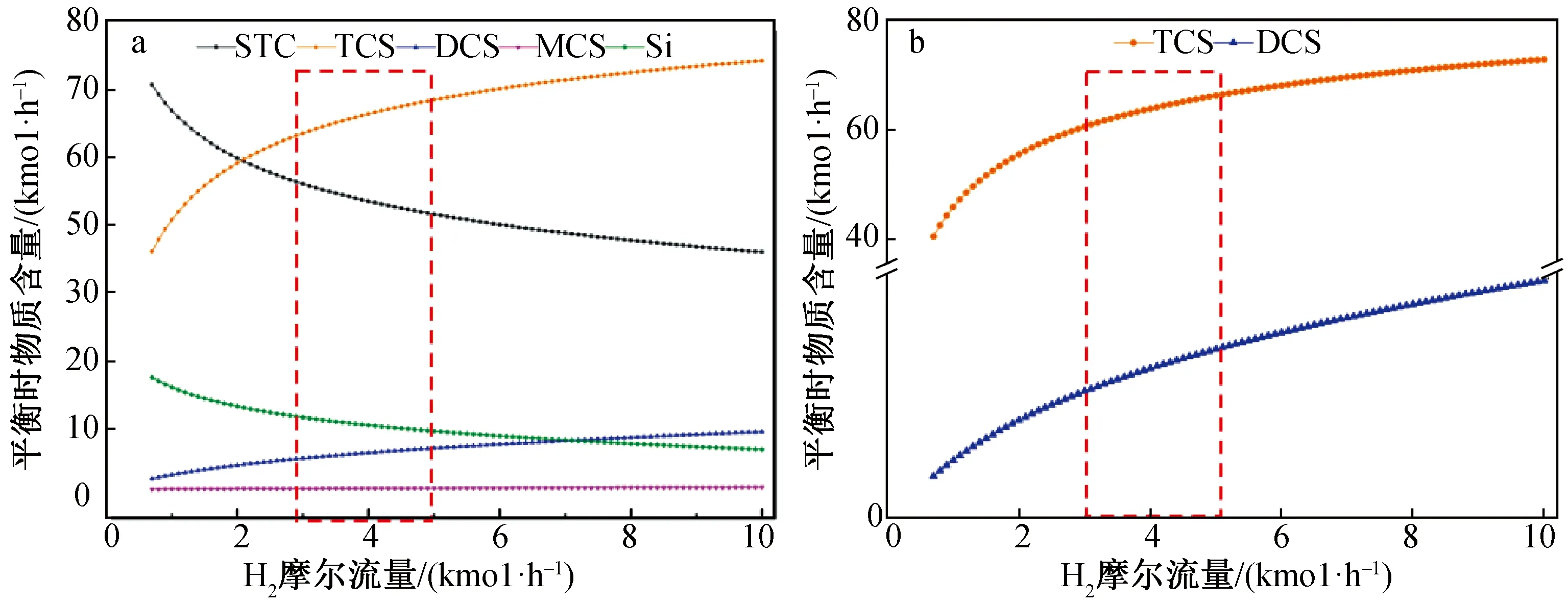
图4 各组分只有TCS(a)和DCS(b)条件下平衡时物质含量随H2流量的变化
主要产物还是TCS。随着H2流量不断增加,平衡时TCS和DCS的含量也增加,MCS生成量较少,随H2量的变化稍有增加,但不明显。虽然随着H2流量的增加会使平衡时TCS的产量提高,但副产物的增加使TCS的选择性降低,因此,为了提高产品的产出率,H2流量不能过高,确定最佳反应器进口原料H2、STC摩尔比为3~5。
1.5 压力对反应平衡的影响
在STC冷氢化反应条件为H2流量500 kmol/h、反应温度450 ℃、Si流量30 kmol/h、STC流量100 kmol/h时,模拟反应总压力对产物的影响,结果(图5)显示:TCS、DCS、MCS的生成都是减分子反应,随压力的增加都会增加。其中,TCS随压力的增加平衡时物质含量先快速增长,当压力大于20 bar时增加的速率变缓,副产物DCS和MCS也随压力的增加而增加,副产物的增加也使TCS的选择性降低。对产率和选择性随压力变化的斜率进行分析,最后确定最佳的操作压力为20~40 bar。
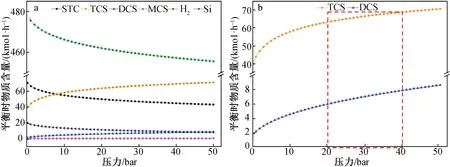
图5 各组分(a)只有TCS和DCS(b)平衡时物质含量随压力的变化
综上可知:在提高TCS产量的前提下,应尽量降低成本的投入,最终确定的最佳操作条件为450~550 ℃、20~40 bar、H2、STC的摩尔比为3~5。
2 冷氢化动力学及反应器设计
反应器是反应实现的场所,反应器的设计是实现工业化最重要的一步[18],STC冷氢化反应需要在氯化亚铜催化剂下进行,反应过程是气-固-固型反应,MUI J P等[19]提出拟均相反应模型-rSTC=R1pSTC-R-1PTCS,丁伟杰等[17]认为MUI J P等提出的模型忽视了STC的吸附项以及H2的分压对反应动力学的影响,通过修正使模拟结果与实验数据偏差较小,因此,本文将丁伟杰等[17]研究结果作为STC冷氢化反应的动力学模型,动力学方程如下:
(1)
其中K=1 131×exp(-77 010/RT),K1=0.032× exp(12 850/RT),K3=0.039×exp(36 730/RT)。
以上述动力学方程为基础,本文再针对以氯化亚铜为催化剂的STC冷氢化拟均相反应过程,采用无限长活塞流反应器进行反应过程的研究,并对不同换热类型的反应器内物料、温度、压力分布进行模拟研究。
2.1 恒温反应过程分析
反应器模型取平推流模型,换热方式为恒温,在反应条件为压力30 bar、STC流量100 kmol/h、H2流量500 kmol/h、Si流量30 kmol/h时,计算反应分布,得到在不同温度下,各物质量随反应管长的变化,结果(图6)显示:在400、450、500、550、600 ℃时,随温度升高后反应加快,反应趋于平衡时所需的管长变短,并且副产物MCS的量很少(小于0.3%),故忽略MCS,副产物重点考虑DCS;TCS和DCS的量随着温度的升高都增加,但是TCS的量随温度升高增加的越来越少,而DCS随温度的升高增加的越来越多;以两个温度摩尔流量差值/前一温度摩尔流量作为增长率表示增长,如(TCS450-TCS400)/ TCS400作为400~450 ℃时TCS的增长率(TCS450、TCS400分别表示450 ℃、400 ℃下TCS摩尔流量),DSC和TCS在400~450、450~500、500~550、550~600 ℃增长率之比为3.93、4.16、4.50、4.96,表明随着温度升高副反应相对增加量越来越多,600 ℃的TCS较400 ℃的增加59.80%,而600 ℃的DSC比400 ℃的增加437.56%。从所需管长看,在400、450、500、550、600 ℃反应趋于稳定时,TCS所需管长为35、15、8、5、3 m,DCS所需管长为42、19、10、5、4 m。对TCS和DCS所需管长和增长趋势的分析可知500 ℃左右作为操作点比较合适(选择性可以控制在93%以上)。
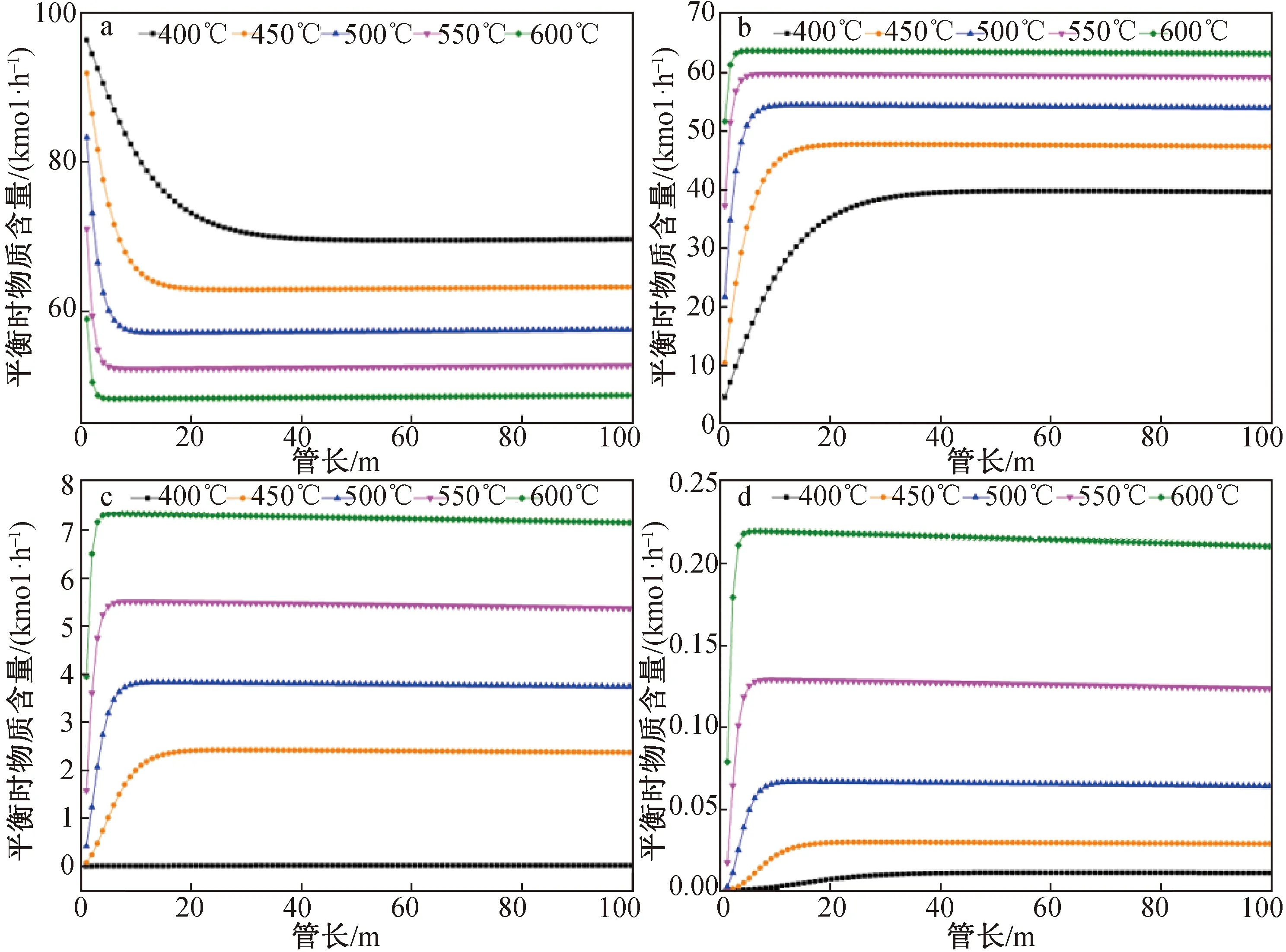
图6 恒温反应过程各反应温度下STC(a)、TCS(b)、DCS(c)、MCS(d)的摩尔含量随管长的变化
2.2 换热反应过程分布
将反应器模型更换为换热式反应器,催化剂和Si原料装在反应管内部,取Φ38×3 mm不锈钢管为反应管,由于STC冷氢化反应是放热过程,为使反应温度平稳,故采用并流式反应器。在反应条件为压力30 bar、STC流量100 kmol/h、H2流量100 kmol/h、Si流量30 kmol/h、反应器直径0.1 m、换热介质烟道气进口温度比物料温度低15 ℃、总传热系数0.3 kW/(m2·℃)时,计算反应分布,得到在不同反应温度下各物质平衡时摩尔含量随反应管长的变化,结果(图7)显示:DSC和TCS在400~450、450~500、500~550、550~600 ℃增长率之比为3.90、4.12、4.43、4.86;在400、450、500、550、600 ℃时,TCS反应达到稳定所需的管长为35、13、6、4、3 m,DCS反应达到稳定所需的管长为38、16、8、5、3 m,表明由于走热量略大于反应热,故换热反应器转化率有微量提高副产物少量减少,但基本趋势和恒温一致。
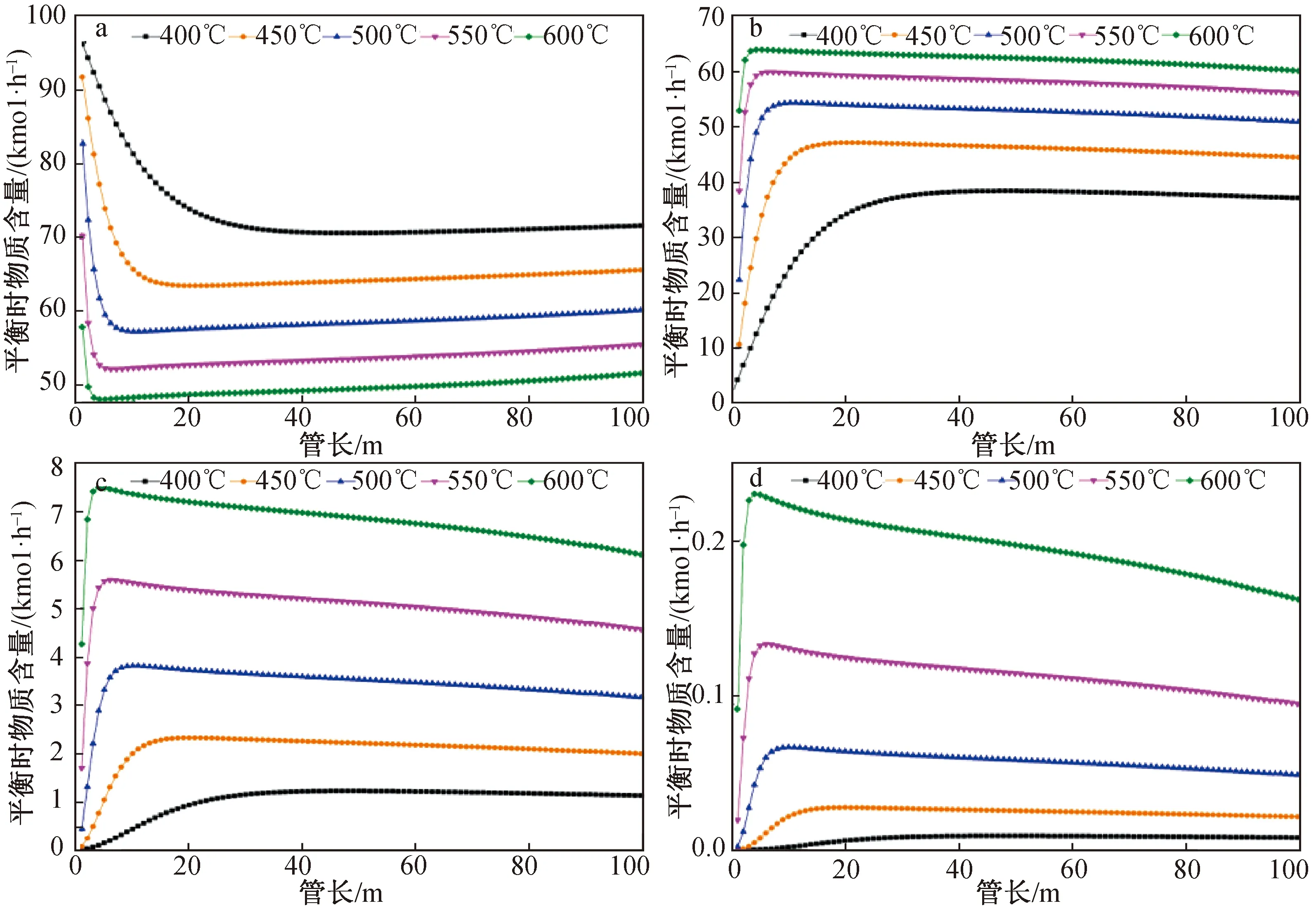
图7 换热反应过程各反应温度下STC(a)、TCS(b)、DCS(c)、MCS(d)的摩尔含量随管长的变化
2.3 绝热反应过程分布
对于绝热反应器来说,N=L/d应大于150,可采用活塞流模型,本反应器符合该条件。在反应条件为压力30 bar、STC流量100 kmol/h、H2流量100 kmol/h、Si流量30 kmol/h、反应器直径0.1 m时,计算反应分布,得到在不同反应温度下各物质平衡时摩尔含量随反应管长的变化,结果(图8)显示:绝热反应不靠外界提供热量,全部的热量均来自反应所产生的热量。STC与H2的反应属于吸热反应,吸收反应器中的热量,Si与HCl的反应为放热反应,为反应器提供热量,一吸一放充分利用了自身的热量。DSC和TCS在400~450、450~500、500~550、550~600 ℃增长率之比为3.97、4.21、4.57、5.07;在400、450、500、550、600 ℃时,TCS反应达到稳定所需的管长为37、14、7、5、3 m,DCS反应达到稳定所需的管长为42、18、9、5、3 m。表明绝热反应器、换热反应器和恒温反应器分布大同小异。
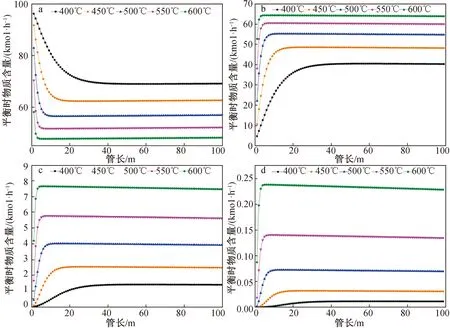
图8 绝热反应过程各反应温度下STC(a)、TCS(b)、DCS(c)、MCS(d)的摩尔含量随管长的变化
图9a和9b分别给出了反应温度500 ℃、反应压力30 bar、STC流量100 kmol/h、H2流量100 kmol/h、Si流量30 kmol/h时不同反应器物料的分布和温度分布,可以看出:换热相比于恒温和绝热的情况,TCS达到平衡时所需的管长最短且DCS的量最少,绝热条件下TCS 的量有少量增加,但DCS的量也增加;从温度分布上看,换热反应器的温度先升高到502.8 ℃再降低到497.4 ℃,绝热反应器存在最高反应温度506.2 ℃;从效果上看,换热反应器有微量的优势,但是从反应器结构复杂性、成本和控制性上综合考虑,绝热反应器更具备竞争力。
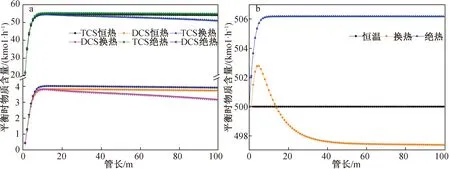
图9 500 ℃下,恒温、换热和绝热情况下(a) TCS、DCS的摩尔含量(b)温度随管长的变化关系
3 结论
(1)通过对STC冷氢化反应过程系统分析,确定了4个独立反应和总反应方程,反应过程为微放热过程,并且反应热基本不随温度改变;
(2)STC冷氢化热力学反应过程副产物主要为DCS,MCS量很少、基本可以忽略;适宜平衡条件为原料摩尔比H2/STC=3~5、温度450~550 ℃、压力20~40 bar。
(3)反应过程热量变化很小,换热方式对组成和压力影响并不大,综合设备加工和控制STC冷氢化反应宜采用绝热反应器。
