胃神经鞘瘤31 例临床病理学分析
2021-03-07王昭晖吴海波
王昭晖,吴海波
[中国科学技术大学附属第一医院(安徽省立医院)临床病理中心中国科学技术大学智慧病理研究所,安徽 合肥 230036]
神经鞘瘤是起源于施万细胞(Schwann cell)的良性肿瘤,多发生于头颈部及四肢的浅表软组织,也可发生于腹膜后、后纵隔及实质脏器(如胃肠道等)[1]。胃肠道神经鞘瘤非常罕见,主要发生于胃。胃神经鞘瘤(gastric schwannoma,GS) 约占胃肿瘤的0.2%[2-3]。GS 的临床症状多为上腹部不适,影像学表现无特异性,术前很难与其他胃黏膜下肿瘤区分,极易被误诊为胃肠道间质瘤(gastrointestinal stromal tumor,GIST)等肿瘤。由于GS 发病率低,既往相关研究较少,本研究收集31 例GS 患者,回顾性分析其组织学特征、免疫表型及预后,并结合相关文献,探讨GS 的鉴别诊断、治疗及预后,以提高对该疾病的认识。
资料与方法
一、研究对象
2014 年1 月至2020 年3 月间,中国科学技术大学附属第一医院(安徽省立医院)临床病理中心诊断为各种类型胃肿瘤的手术标本共17 223 例,收集其中诊断为GS 的手术标本共31 例。查阅这31 例标本对应患者的临床资料,包括年龄、性别、肿瘤部位、大小、治疗等信息(见表1)。
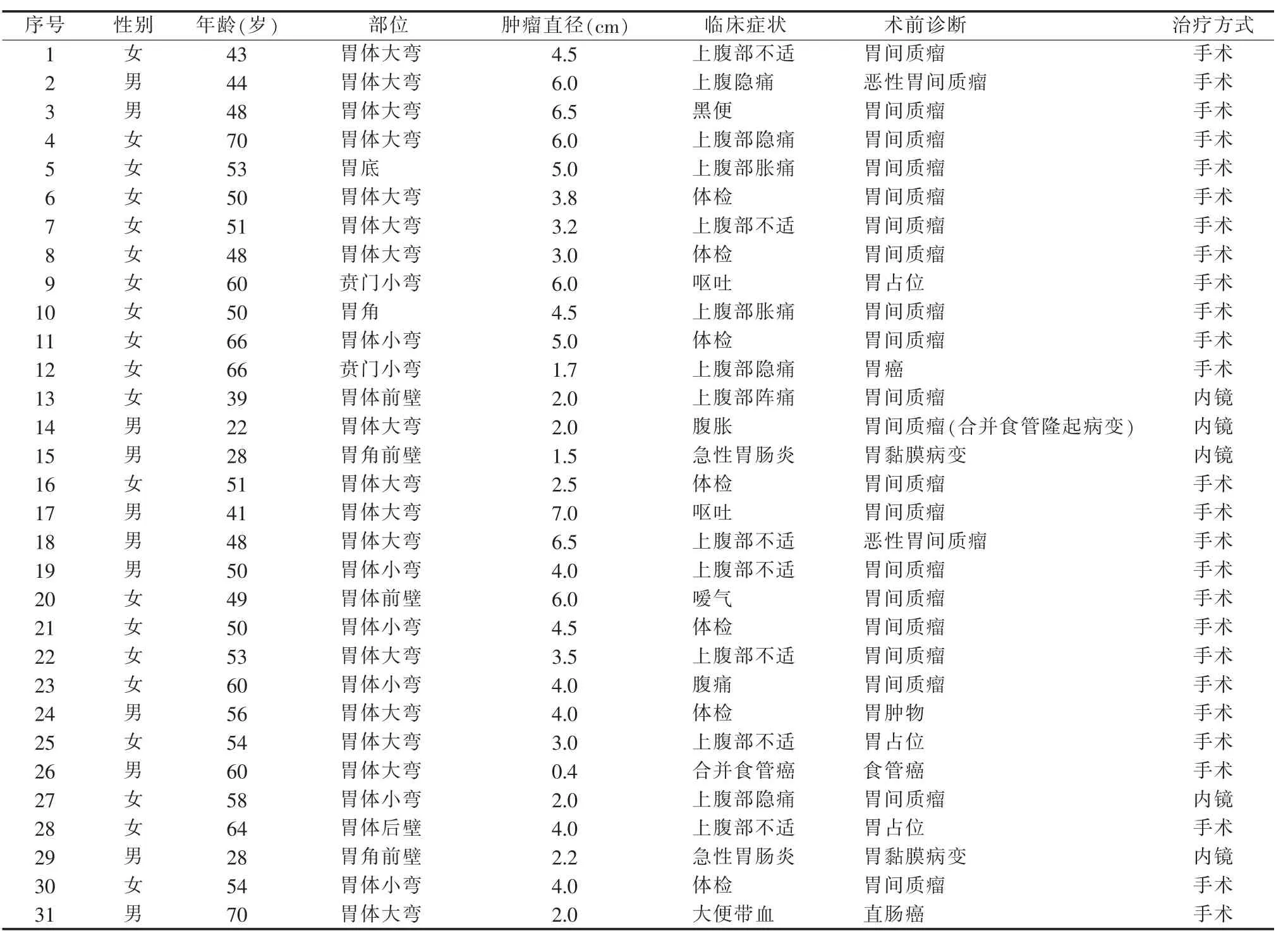
表1 31 例胃神经鞘瘤的临床病理学特点
二、方法
1.病理检查及免疫组织化学(免疫组化)检测:所有标本均经4%中性甲醛固定,常规脱水,石蜡包埋,切片,苏木精-伊红(hematoxylin and eosin,HE)染色,显微镜下观察,并连续切片进行免疫组化染色。免疫组化检测采用EnVision 二步法,染色在Benchmark XT 全自动免疫组化染色仪(瑞士Roche公司)上进行,所用抗体包括S-100、SMA、Desmin、CD117、Dog-1、CD34、SOX-10、Vimentin 和Ki-67(福州迈新生物技术有限公司)。所有免疫组化染色均设阳性和阴性对照。所有病理切片均经2 名高年资病理医师复诊。
2.结果判定:染色呈黄色或棕黄色颗粒为阳性。S-100阳性定位于细胞质及细胞核;Vimentin、SMA、Desmin阳性定位于细胞质;CD117、Dog-1、CD34 阳性定位于细胞质和细胞膜;SOX-10 和Ki-67 阳性定位于细胞核。
3.随访:对31 例患者进行电话随访,了解其肿瘤是否有复发或转移,截至2020 年12 月30 日,随访时长为9~72 个月,中位随访时间为34 个月。
结果
一、临床特征
31 例GS 占同时期所有类型胃肿瘤的百分比约为0.18%,患者中男性为12 例,女性为19 例;发病年龄为22~70 岁,中位年龄为51 岁。16 例患者的病灶位于胃体大弯侧,6 例位于胃体小弯侧,2 例位于胃体前壁,1 例位于胃体后壁,2 例位于贲门小弯侧,1 例位于胃底,3 例位于胃角。患者的临床症状多为上腹部隐痛不适,且与进食无关。术前发现1 例患者合并胃癌,1 例合并食管癌,1 例合并直肠癌,1 例合并胰腺炎,3 例未明确诊断,余24 例术前临床均诊断为GIST。除3 例合并其他胃肠道肿瘤的患者外,余28 例患者术前的胃镜检查结果均提示为黏膜下隆起型肿块。31 例患者中26 例行胃大部切除术,5 例行内镜治疗。截至随访结束,1 例患者失访,余30 例患者均无肿瘤复发和转移。
二、巨检
肿瘤的最大径为1.5~7.0 cm,平均最大径为3.8 cm。29 例患者的肿瘤病灶位于胃黏膜层至浆膜层之间,2 例患者的病灶突破浆膜层。肉眼观察可见,肿块边界清晰,均无包膜,多呈圆形、卵圆形,切面呈灰白、灰黄色,质地中等或较软。31 例中有5 例肿瘤表面有溃疡形成,3 例伴有出血,2 例伴有钙化,1 例伴有坏死。
三、镜检
在低倍显微镜下观察,可见肿瘤组织多位于黏膜层、黏膜肌层及黏膜下层,边界清晰,无包膜。29 例肿瘤组织周围可见淋巴组织增生,形成淋巴细胞套,并可见生发中心(见图1A)。肿瘤细胞为梭形、卵圆形,呈束状(见图1B)、小簇状排列或杂乱排列;其中7 例局灶呈典型软组织神经鞘瘤所具有的栅栏状结构(见图1C),5 例局灶见交替分布的束状区(Antoni A 区)和网状区(Antoni B 区)。肿瘤细胞细胞质均匀、红染,部分细胞核的一端见空泡;有7 例肿瘤细胞细胞质呈多空泡状,类似脂母细胞(见图1D)。肿瘤细胞细胞核染色质细腻,核仁不明显或小核仁,核分裂象罕见;其中2 例见少量异型核瘤细胞。肿瘤间质局灶有黏液变性(见图1E);7 例见多少不等的胶原纤维束,3 例见泡沫样组织细胞灶性聚集,3 例局部有出血,2 例伴有钙化,1 例见梗死;6 例见大小不一的厚壁血管,管腔不规则,管壁呈不同程度玻璃样变性(见图1F)。

图1 GS 病理图片(HE)
四、免疫组化检测
所有GS 细胞均弥漫阳性表达S-100 (见图2A)、SOX-10 (见图2B) 和Vimentin,其他标志物CD117、DOG-1、CD34、SMA、desmin 均为阴性,Ki-67增殖指数为1%~10%不等。
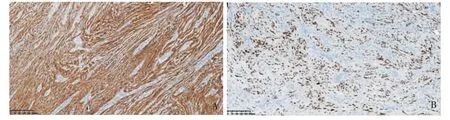
图2 GS 的免疫组化图片(EnVision 法,×100)
讨 论
神经鞘瘤是一种良性神经源性肿瘤,理论上其可以沿任何神经末梢生长,然而神经鞘瘤最常发生的部位是头颈部及四肢的浅表软组织,很少发生在胃肠道[4]。胃肠道神经鞘瘤多见于胃,其次为结肠,而小肠、食管等其他部位罕见[5]。本院2014 年1 月至2020 年3 月诊断为各种类型胃肿瘤的手术标本共17 223 例,其中GS 有31 例,约占0.18%,与文献报道[2-3]相似。GS 患者的临床症状不典型,且影像学无特异性表现,极易被误诊,大部分病例在术前被诊断为GIST,少数被误诊为胃癌。本研究的31 例GS患者中女性多于男性,中位年龄为51 岁,临床多表现为上腹部不适、呕吐、嗳气等症状,并且与进食无关,部分为体检发现。超声胃镜检查提示,GS 病灶多位于黏膜层或黏膜下层,病变呈隆起型,表面有溃疡形成,后者多是由于肿瘤影响黏膜血供导致局部缺血,或因对胃酸的耐受降低所致[6]。本研究的31 例GS 患者中有5 例(16%)的肿瘤表面黏膜出现溃疡。CT 图像上,GS 表现为胃壁内生长的肿块,呈外生型或混合型,信号强度中等,可见周围淋巴结肿大;而MRI 检查中,GS 在T1W1 图像上呈等信号影,在T2W1 图像上则呈稍高信号影,其内见低信号,DWI 图像上则为弥漫受限的不均质高信号,增强动脉期和延迟期示早期不规则环形强化,时间延迟后强化显著。因此,GS 在影像学检查中常被误诊为恶性肿瘤。本研究31 例GS 病例中有1 例的肿块周围伴有淋巴结肿大,导致术前诊断为恶性肿瘤伴淋巴结转移。GS 患者合并肿瘤的报道较少,本研究中有5 例GS 患者合并有其他消化道疾病,分别为食管平滑肌瘤、胰腺炎、胃癌、食管癌和直肠癌。
一、GS 的病理诊断
GS 在形态上常与经典的软组织神经鞘瘤有所不同。组织学上,GS 病灶的边界多较清晰,但常无完整的包膜,肿瘤细胞也可在肌层内延伸生长。对诊断有提示作用的是病理特征,GS 病灶的周边常见淋巴细胞套[7],但需要注意,淋巴细胞套也可出现于其他软组织肿瘤中,如血管瘤型纤维组织细胞瘤、钙化性纤维性肿瘤等,因此并不具有诊断特异性。而本研究发现,GS 周边淋巴细胞套内的生发中心星空现象不明显,提示淋巴细胞并不处于活跃的增殖状态。另外,本研究发现多数GS 患者肿瘤所对应的胃黏膜内亦有多量小淋巴细胞浸润,活检时如果没见到肿瘤的梭形细胞成分,易被误诊为低级别的淋巴瘤。GS 中不易见到经典软组织神经鞘瘤交错分布的Antoni A 区和Antoni B 区,常为梭形瘤细胞呈束状或不规则排列,少见情况下局灶可见经典的栅栏状结构以及小簇状和网格状结构,当间质胶原组织明显增生时则类似于瘢痕疙瘩或纤维瘤病。本研究还发现部分GS 肿瘤细胞细胞质呈多空泡状,类似脂母细胞,较为罕见。免疫组化检测显示,GS 与经典软组织神经鞘瘤相同,表达S-100 和SOX-10,但 不 表 达CD34、CD117、Dog1、SMA 和desmin,也有文献报道,GS 也可表达CD56、CD57[8]。
二、鉴别诊断
GS 需要与好发于消化道的其他软组织肿瘤相鉴别。
1.GIST:GIST 与GS 在术前影像学检查中很难区别,均表现为黏膜下边界清楚、密度均匀的软组织肿块。两者在组织学上也有很大相似性,肿瘤边界清楚,由梭形细胞组成,且均可见栅栏状结构。但GIST 肿瘤组织周边无淋巴细胞套,细胞密度常比GS 大,且更加均匀一致;免疫组化检测显示,CD117、Dog-1、CD34 阳性,不表达S-100 和SOX-10,以此可与GS 相鉴别。需要注意的是,罕见情况下,GS 内可混合有GIST 成分,该成分除了CD34和DOG-1 阳性外,还可检测到KIT 基因突变[9]。虽然大多数GIST 存在KIT/PDGFRA 突变,但约10%的GIST 无KIT/PDGFRA 突变(野生型GIST),其最常见的分子改变为SDH 复合体缺陷。SDH 缺陷型GIST 多见于女性患者,形态学上表现为丛状或结节状生长,肿瘤细胞呈上皮样形态,淋巴结转移较常见,但生物学行为较为惰性,免疫组化检测显示CD117、Dog-1 强阳性,以此可与GS 鉴别。
2.平滑肌肿瘤:胃是平滑肌肿瘤的好发部位,平滑肌肿瘤的影像学表现为黏膜下均质低回声、界限清楚的软组织肿块,与GS 表现相似,需通过病理诊断鉴别。组织学上,平滑肌肿瘤的细胞质呈明显嗜酸性,细胞核两端钝圆,核旁常见空泡,免疫组化检测表达SMA、Desmin 和h-Caldesmon,可与GS 鉴别。同时需注意的是,GS 可同时合并平滑肌肿瘤,如本研究中有1 例GS 患者合并有食管平滑肌瘤。
3.炎性纤维性息肉:该肿瘤最常见于胃(尤其是胃窦),病变中心多位于黏膜下层,可延伸至固有肌层或黏膜层,外观上呈息肉样隆起,影像学表现同样为黏膜下软组织肿块,无特异性表现,需通过术后病理检查与GS 鉴别。炎性纤维性息肉最经典的组织学形态是梭形细胞围绕血管形成的“洋葱皮样”结构,间质中常见大量嗜酸性粒细胞浸润,且肿瘤细胞表达CD34,不表达S-100 和SOX-10,以此可与GS 相鉴别。此外,部分炎性纤维性息肉病例的分子检测显示存在PDGFRA 突变。
4.炎症性肌纤维母细胞瘤:胃是炎症性肌纤维母细胞瘤的消化道第二好发部位,仅次于小肠和结肠。影像学表现为胃壁内肿块,与GS 一样常被误诊为胃间质瘤,需通过术后病理确诊。显微镜下可见炎症性肌纤维母细胞瘤细胞呈梭形,交错束状排列,伴以淋巴细胞和浆细胞为主的多量炎细胞浸润,甚至可有淋巴滤泡形成,易与GS 混淆。但炎症性肌纤维母细胞瘤为纤维母细胞/肌纤维母细胞性肿瘤,常表达ALK 和SMA,不表达S-100 和SOX-10,有助于鉴别[10]。
5.脂肪肉瘤:胃脂肪肉瘤的影像学特征性表现是出现脂肪密度区,但低分化或其他脂肪含量低的脂肪肉瘤其影像学表现易与胃间质瘤及GS 混淆。本研究发现,部分GS 细胞的细胞质呈多空泡状,类似脂母细胞,且表达S-100,与脂肪肉瘤相似。但盆腹腔脂肪肉瘤往往体积较大,且肿瘤细胞虽然表达S-100,但不表达SOX-10。此外,高分化脂肪肉瘤和去分化脂肪肉瘤常有MDM2 扩增,均有助于鉴别。
6.其他:GS 还需与胃丛状纤维黏液瘤、颗粒细胞瘤、韧带样型纤维瘤病、肉瘤样癌等多种良恶性肿瘤相鉴别,结合形态和免疫标志,可区别。
三、治疗及预后
目前治疗GS 的常用方法有内镜下切除[11]或手术切除。局部切除肿瘤时需保留足够的手术切缘,肿瘤若位于固有肌层内或者肿瘤直径超过3 cm,则有穿孔的风险,此时需选用手术切除[12]。GS 患者的预后较好。Hong 等[13]回顾性分析了137 例经手术治疗的GS 患者,中位随访时间为22~132 个月,所有患者均无复发和转移。同样,本研究31 例GS 患者,除1 例失访外,其余30 例术后随访6~32 个月,均无肿瘤复发和转移。
总之,临床上GS 较为罕见,临床诊断和影像学检查中易被误诊为GIST 等肿瘤,结合显微镜下肿瘤的组织学形态和免疫组化染色结果,可明确病理诊断。GS 是良性肿瘤,患者经手术切除肿瘤后预后良好。
