小米分离蛋白提取方法优化及对蛋白组成的影响
2021-03-06李书田王显瑞
张 凡,李书田,王显瑞,沈 群*
(1 中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083 2 赤峰市农牧科学研究院谷子研究所 内蒙古赤峰024031)
小米(foxtail millet),属禾本科、狗尾草属的一年生草本植物,原产于我国北方黄河流域,其种植历史可追溯到8 000年前。小米营养丰富,各种营养素比例适宜,富含膳食纤维、矿物质(钙和铁)、维生素B 和多酚类物质等。此外,小米粗蛋白属低过敏性蛋白,可供麸质过敏人群食用,且小米多肽被证实具有抗氧化、降血压、修复肝损伤以及参与机体免疫调节等功能活性[1-3]。小米蛋白质含有人体必需的8 种氨基酸,且含量远高于大米、玉米、小麦等谷物[4]。小米蛋白质是一种良好的植物来源蛋白,可以综合开发利用,以缓解蛋白质资源短缺问题。
长期以来,高质量小米蛋白质的提取是一个难以解决的问题,表现为提取率不高,蛋白质含量低[5-6]。小米胚乳中淀粉颗粒和蛋白体的紧密结合,蛋白质分子内及分子间的二硫键,高疏水性蛋白组分(醇溶蛋白)以及单宁等物质的存在,均阻碍了小米分离蛋白的提取[7-8]。常见的小米蛋白提取方法有盐法、碱法和酶法,前两种方法提取率低,资源消耗大且污染环境,剧烈的提取条件还可能导致蛋白中生物活性物质的降解[9-10]。酶法又可分为碳水化合物类酶和蛋白酶两种,前者通过水解细胞壁、纤维素、淀粉等非蛋白组分,使蛋白质与之分离,后者直接对小米蛋白进行降解及修饰,使之成为可溶的多肽而被提取出来[11]。目前大多数研究集中在如何提高蛋白提取率,忽视了小米分离蛋白(MPI)中蛋白质的含量及组成。通过分析不同酶法条件下MPI 的提取率、蛋白质含量、分子质量分布及二级结构,筛选适合的工艺并结合响应面法进一步优化,旨在获得组成全面、结构信息完整且蛋白质含量高的MPI,为其今后的深入研究、开发与利用提供试验基础。
1 材料与方法
1.1 材料与试剂
小米品种为毛毛谷(粗蛋白含量9.24%),赤峰市农牧科学研究院提供。根据小米的化学组成及细胞壁结构,选用5 种酶对其水解,分别是:α-淀粉酶(50 U/mg)、糖化酶(100 U/mg)、碱性蛋白酶(200 U/mg)及普鲁兰酶(≥1 U/mg),均购于上海源叶有限公司;复合纤维素酶(葡聚糖酶活力700 EGU/g,木聚糖酶活力250 FXU/g),丹麦诺维信有限公司。其它试剂为分析纯级。
1.2 仪器与设备
半自动凯氏定氮仪KN520,济南阿尔瓦仪器有限公司;傅里叶变换红外光谱仪,美国PkinElmer 公司;电泳槽及电泳仪,美国Bio-Rad公司;GE Healthcare 凝胶成像仪,美国通用电气医疗公司;水浴恒温振荡器,上海龙跃有限公司;冷冻干燥机FD-1A-50,北京博医康有限公司。
1.3 试验方法
1.3.1 筛选酶解方法
1.3.1.1 酶法提取小米分离蛋白 用蒸馏水将小米淘洗3 次,低温烘干,粉碎机碾磨成粉,过60 目筛,室温下按料液比1∶5 添加正己烷脱脂4 h 得小米脱脂粉,备用。按照表1 方法酶解小米脱脂粉。试验中酶解温度及溶液pH 值始终在最适酶活范围内。双酶或三酶等量添加。酶解后5 000 min 离心20 min,除2 号试验组离心、取上清外,其余组离心、沉淀,水洗数次至中性,复溶,冻干48 h,备用。
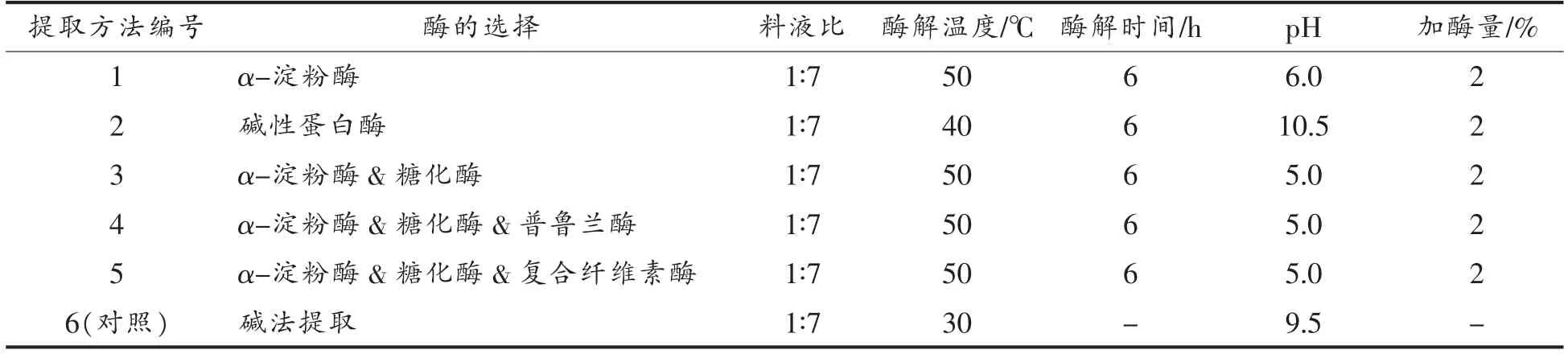
表1 不同提取方法下的酶解条件Table 1 Enzymatic hydrolysis conditions by different extraction methods
将碱法提取MPI 作为酶解法的对照。准确称取定量脱脂小米粉,按料液比1∶7 加蒸馏水,加拌均匀后用0.1 mol/L NaOH 调至pH 9.5,温度控制为30 ℃,水浴震荡1.5 h,5 000 r/min 离心20 min,取上清,调节pH 4.0,静置0.5 h,5 000 r/min 离心20 min,水洗数次沉淀至中性,复溶,冻干48 h,备用。
1.3.1.2 蛋白质含量测定 采用凯氏定氮法,参照GB5009.5-2016 方法对碱法及酶法提取物进行蛋白含量测定[12]。小米蛋白氮转化系数为5.83。由公式(1)、(2)分别计算提取率和纯化因子。
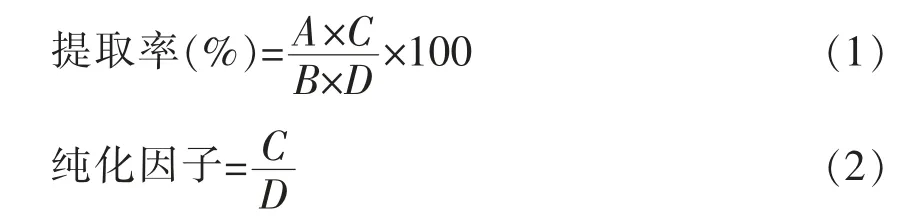
式中,A——冻干粉的质量(g);C——冻干粉的蛋白质含量(%);B——称取的脱脂小米粉质量(g);D——脱脂小米粉中蛋白质含量(%)。
1.3.1.3 蛋白质分子质量分布测定 参考徐婧婷等[13]的方法对MPI 进行聚丙烯酰胺凝胶电泳分析。主要步骤是:确定凝胶浓度→制备电泳胶→处理蛋白样品→上样→恒压下电泳→染色→脱色。使用Quantity One v4.62 对将脱色后的电泳凝胶进行分子质量分析。
1.3.1.4 蛋白质二级结构测定[14]室温条件下使用傅里叶红外光谱仪(FTIR)在波数4 000~400 cm-1范围对MPI 扫描。以光谱纯的溴化钾压片作为空白。按照1∶200 的比例加入蛋白样品和溴化钾,研磨均匀后压片。扫描条件:分辨率4 cm-1,扫描次数256。使用PeakFit v4 软件在酰胺Ⅰ带范围对蛋白质二级结构进行分析。
1.3.2 酶法提取小米分离蛋白工艺优化
1.3.2.1 单因素条件探究 根据上述试验结果,为进一步得到高蛋白含量的MPI,选择最优酶解方法进行优化。在单因素试验中考察料液比、小米脱脂粉粉碎目数、pH 值、酶解温度、加酶量和酶解时间对蛋白质含量的影响,各水平设置条件见表2。
1.3.2.2 酶法工艺优化 以酶解后所得蛋白质含量为考察值,根据单因素试验结果,选取pH 值、温度、加酶量及酶解时间为试验因素。通过Box-Behnken 的中心组合试验设计(表3)进行四因素三水平分析。
1.3.3 数据处理 所有试验均重复3 次,使用IBM 公司的SPSS Statistics 25 软件进行方差分析及Duncan 分析,采用Origin Pro 2015 软件绘图,Design-Expert 8.0.6 软件进行响应面试验设计。
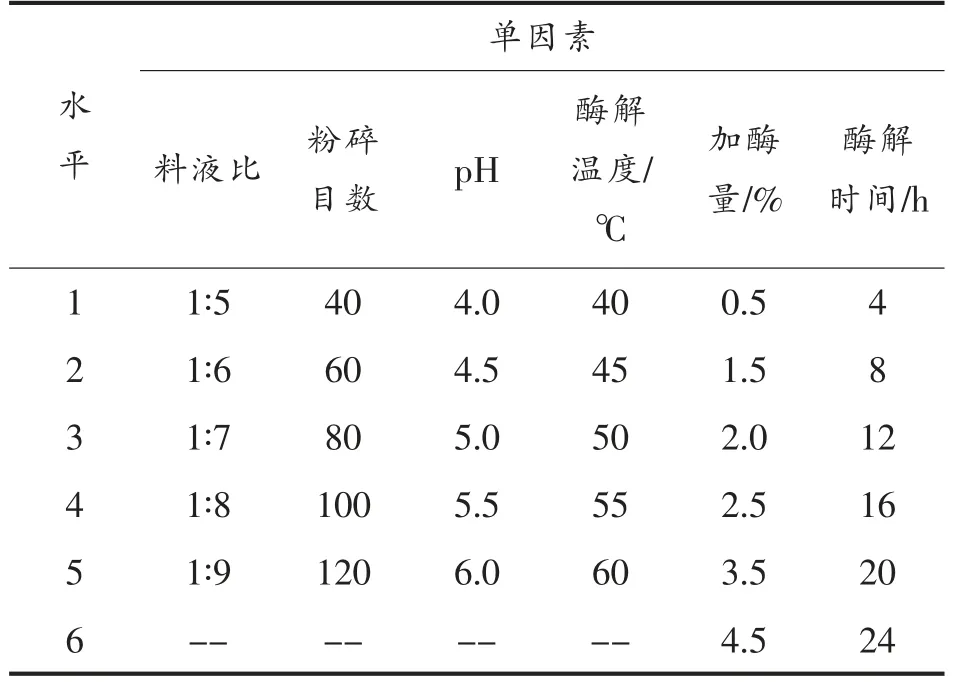
表2 酶法提取小米分离蛋白响应面分析因素和水平Table 2 Factors and levels for response surface analysis of enzymatic extraction of foxtail millet isolate protein

表3 Box-Behnken 试验因素水平编码表Table 3 The factors and levels of Box-Behnken design
2 结果与讨论
2.1 不同酶解方法的比较与筛选
2.1.1 小米分离蛋白含量 图1 显示不同提取方法下MPI 的提取率、蛋白含量及纯化因子。纯化因子代表在该方法下MPI 被提出的程度,从侧面反映MPI 中的蛋白质含量。在提取率一定的前提下,为得到蛋白质含量较高的MPI,重点研究蛋白含量。从图1 可看出,虽然碱溶酸沉条件下MPI 的蛋白质含量最高(65.91%),但是此时MPI 的提取率远低于其余5 种酶法,仅5.17%。刘剑利等[5]优化碱法提取MPI 的工艺条件后,提取率达38.79%。杨桦[11]对超声波辅助酶法提取MPI 的工艺进行优化,提取率达(74.26±1.2)%。由此可见碱法条件下MPI 的提取率远不如酶法。许多研究认为强碱条件下提取蛋白可能伴随着蛋白质的变性、水解,形成有毒物质赖丙氨酸,美拉德反应加重引起蛋白产物颜色过深等不良反应[15]。相比之下,酶法条更为温和,反应针对性强。

图1 酶解条件对MPI 提取率、蛋白质含量及纯化因子的影响Fig.1 Effects of different enzymatic hydrolysis conditions on extraction yield,protein content and purification factors of MPI
碱性蛋白酶法所得MPI 蛋白质含量较高,为41.8%。然而,碱性蛋白酶条件下会导致所提蛋白质部分水解以及结构、理化性质改变,因而不予采纳[16-17]。就MPI 蛋白质含量以及提取率而言,三酶法>双酶法>单酶法。提取率均能达到47%以上,其中α-淀粉酶/糖化酶/普鲁兰酶法提取率最高,为80.98%;α-淀粉酶/糖化酶/复合纤维素酶法的MPI蛋白质含量最高,达44.07%,此时蛋白纯化因子为4.77。
淀粉是小米的主要成分,碳水化合物类酶的加入可将除蛋白外的诸如淀粉等大分子物质水解[18]。将镶嵌在蛋白质基质中的淀粉粒以及与蛋白体紧密结合的淀粉颗粒分离开来,所得MPI 的蛋白质含量高[19]。α-淀粉酶/糖化酶/复合纤维素酶在酶解过程中,复合纤维素酶可破坏细胞壁成分,有利于淀粉酶的进入以及蛋白体的释放,α-淀粉酶作用于淀粉链上的α-1,4-糖苷键,水解产生糊精、低聚糖,糖化酶则从非还原末端切开α-1,4-糖苷键并缓慢切开α-1,6-糖苷键,使淀粉最终水解成小分子的葡萄糖。此时淀粉被水解,胚乳细胞中的蛋白被分离,获得蛋白含量最高的MPI。而在提取方法4(α-淀粉酶/糖化酶/普鲁兰酶)中,普鲁兰酶作为脱支酶的一种,可专一性水解麦芽三糖和以α-1,6 糖苷键连接起来的聚合物,与α-淀粉酶/糖化酶联合使用可彻底水解淀粉。然而,淀粉颗粒、蛋白体等物质均存在于胚乳细胞中,细胞壁的存在可能限制了酶与淀粉底物的接触,因而相同条件下,复合纤维素酶破除细胞壁屏障,释放内含物与酶发生接触,从而使淀粉水解更为彻底[20-21]。
2.1.2 小米分离蛋白分子质量分布 不同提取条件下MPI 分子质量分布见图2 及表4。提取方法不同,MPI 分子质量分布情况不同。整体而言,MPI中小分子质量的蛋白质居多。小米清、球蛋白谱带分布广泛,主要集中在高分子质量范围,其中70,56,35,20 ku 被认为是球蛋白的特征谱带[13,22],这些条带在图2 中均明显存在。文献[21]称不同酶解方法如高温淀粉酶解、高温淀粉酶/复合纤维素酶解(Multifect XL)对大米可溶性蛋白的组分没有影响。醇溶蛋白约占小米总蛋白的60%,主要包含27~13 ku 亚基,根据其溶解性不同还可细分为α醇溶蛋白(18~21 ku)、β 醇溶蛋白(15 ku)以及γ醇溶蛋白(23 ku)[23-24]。此外,谷蛋白作为小米另一贮藏蛋白,蛋白谱带虽分布广泛,但也主要集中在低分子质量范围。MPI 电泳图中相当一部分条带集中在小分子质量范围。
相比于淀粉酶类法,碱性蛋白酶法(泳道2)及碱溶酸沉法(泳道6)得到的小米总蛋白分子质量分布相似,小于30 ku 的蛋白条带分布均低于55%,可能是由于在强碱性条件下提取的蛋白主要为谷蛋白,而此时疏水性较强的醇溶蛋白未能被完全提取。有报道称,碱性条件下提取的高粱分离蛋白仅有5%~15%为醇溶蛋白组分[25]。此外,由表4 可知,碱性条件下MPI 发生蛋白质分子聚集的现象,大于85 ku 的蛋白条带明显高于其它试验组。Valenzuela 等[26]认为在pH>10 的碱性条件下,藜麦蛋白结构发生明显的聚集现象。就碳水化合物类酶而言,双酶法及三酶法条件下,MPI 分子质量分布情况没有明显差异,与单淀粉酶法略有不同。
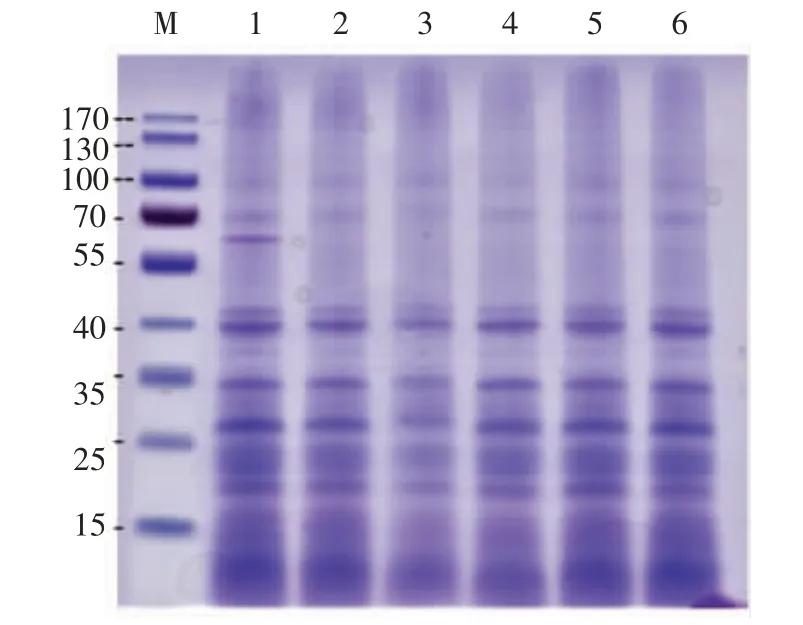
图2 不同提取方法的MPI 的SDS 电泳图Fig.2 The SDS-PAGE electrophoresis of MPI extracted by different extraction techniques

表4 不同提取方法的MPI 分子质量分布Table 4 Molecular weight distribution as a percentage of MPI extracted by different extraction techniques
2.1.3 小米分离蛋白二级结构 利用FTIR 分析不同提取方法的MPI 的二级结构信息(表5)。FTIR 可通过去卷积、二阶求导、曲线拟合等方式获得蛋白质酰胺Ⅰ带(1 700~1 600 cm-1)中的信息,分析出蛋白质的α 螺旋(1 658~1 650 cm-1)、β折叠(1 640~1 610 cm-1)、β 转角(1 700~1 660 cm-1)、无规卷曲(1 650~1 640 cm-1)结构[14]。
β 折叠是多肽链的一种伸展结构,往往与蛋白质的聚集以及天然结构破坏有关,而α 螺旋结构往往与蛋白质的天然结构存在联系[14]。当蛋白质发生变性时,蛋白质分子由卷曲态变为伸展态,α 螺旋含量变少,同时β 折叠及β 转角含量增加,无规卷曲结构指没有规则的多肽构象[27-28]。
从表6 可知,5 种酶法提取条件对小米二级结构无显著影响,β 折叠及β 转角是MPI 主要的二级结构。碱法条件下,小米分离蛋白α 螺旋结构值最小,β 折叠结构值最大,说明相比于酶法,碱法提取的MPI 酰胺基间的氢键作用力降低,分子间静电斥力的增加[29]。提取方法不同,α 螺旋/β 折叠比例不同,即具体的提取条件影响蛋白质的二级结构信息[30-31]。

表5 不同提取方法的MPI 二级结构(%)Table 5 Proportions of secondary structures of MPI extracted by different extraction techniques(%)
综上所述,碱溶酸沉法条件剧烈,不利于保持蛋白的天然结构。相比而言酶法条件更为温和,然而同样因强碱环境下不利于除谷蛋白外其余蛋白组分的提取。α-淀粉酶/糖化酶/复合纤维素酶法(提取方法4)所得MPI 提取率、蛋白含量高,且较大程度地保留了小米蛋白的结构信息,因此对α-淀粉酶/糖化酶/复合纤维素酶法进行后续条件的优化,以期获得蛋白含量更高的MPI。
2.2 酶法提取小米分离蛋白单因素条件
为了提高MPI 的蛋白质含量,选取料液比1∶7,粉碎目数60,pH 5.0,酶解温度50 ℃,加酶量2%,酶解时间12 h 条件,改变其中1 个因素,保持其它参数不变,分析各因素指标变化对蛋白质提取率的影响,结果见图3。
1)由图3a 可知,当料液比1∶7 时,MPI 的蛋白质含量最高,(58.27±0.69)%。当料液比再增加时,MPI 的蛋白质含量反而下降。这可能是由于料液比较大时,存在的浓度差促使传质推动力增大,也就是说更多非蛋白可溶性物质溶出,从而影响MPI 蛋白质含量[32]。最终选择料液比1∶7 为最佳的料液比,做后续试验。
2)由图3b 可知,粉碎目数为80 目时,MPI的蛋白质含量最高。同样,当粉碎目数增加,小米内非蛋白可溶性物质与溶剂的接触面增加,这导致MPI 蛋白质含量下降。最佳粉碎目数为80 目。
3)考虑到α-淀粉酶、糖化酶及复合纤维素酶的最适pH 值略有不同,有必要对蛋白提取环境的pH 值进行优化。由图3c 可知,当溶液pH 值由4.0 升至4.5 时,蛋白质含量显著提高,而后随着pH 值的增加而缓慢下降。溶液pH 值与蛋白质等电点的关系决定了蛋白质表面电荷的分布情况以及与蛋白水分子间的相互作用力[33]。已知小米蛋白的等电点4.0 左右,此时MPI 蛋白质含量不仅与不同pH 值下3 种酶的酶活有关,也与MPI 的溶解性有关。反应最适pH 4.5。
4)由图3d 可知,当温度50 ℃时,MPI 蛋白质含量到达最大值(62.84±0.49)%;当温度低于或高于50 ℃时,蛋白质含量均下降。同样的,复合酶体系温度的确定十分重要,要保证该温度下3 种酶均有相当强的活性,温度过高或过低均影响酶促反应的进行。在单因素优化试验中,保持蛋白提取在50 ℃环境条件下进行。
5)由图3e 可知,加酶量在0.5%~2.0%时,蛋白质含量随酶量的增加而增加,当加酶量2.0%时可获得蛋白质含量最高的MPI。加酶量继续增加(>2.0%),MPI 中蛋白质含量呈下降趋势。当反应系统中的酶少量存在时,体系处于酶反应动力学的初级阶段,所有的酶全部参与到反应中,2%的加酶量即达到饱和状态[11]。由于反应体系中底物量(小米脱脂粉)是一定的,加酶量继续增加并不会促进酶促反应的进行。最优加酶量设定为2%。
6)由图3f 可知,添加复合酶的0~12 h 内,MPI 的蛋白含量显著升高,酶解12 h 获得最高蛋白含量的MPI,(66.65±1.02)%。当酶解时间超过12 h 时,时间不再成为影响蛋白含量的主要因素。最终选择酶解时间为12 h。
2.3 响应面设计与结果
利用Design-expert 8.0 软件对表6 的试验数据进行回归分析,得到MPI 蛋白质含量Y 对4个自变量X1、X2、X3、X4的二次多项回归方程:Y=66.24 +14.48X1-2.59X2+11.37X3+3.07X4+0.21 X1X2+5.15X1X3-0.32X1X4-4.14X2X3-2.64X2X4-0.21 X3X4-17.32X12-10.93X22-14.08X32-7.25X42。响应面分析试验方差分析结果见表7。
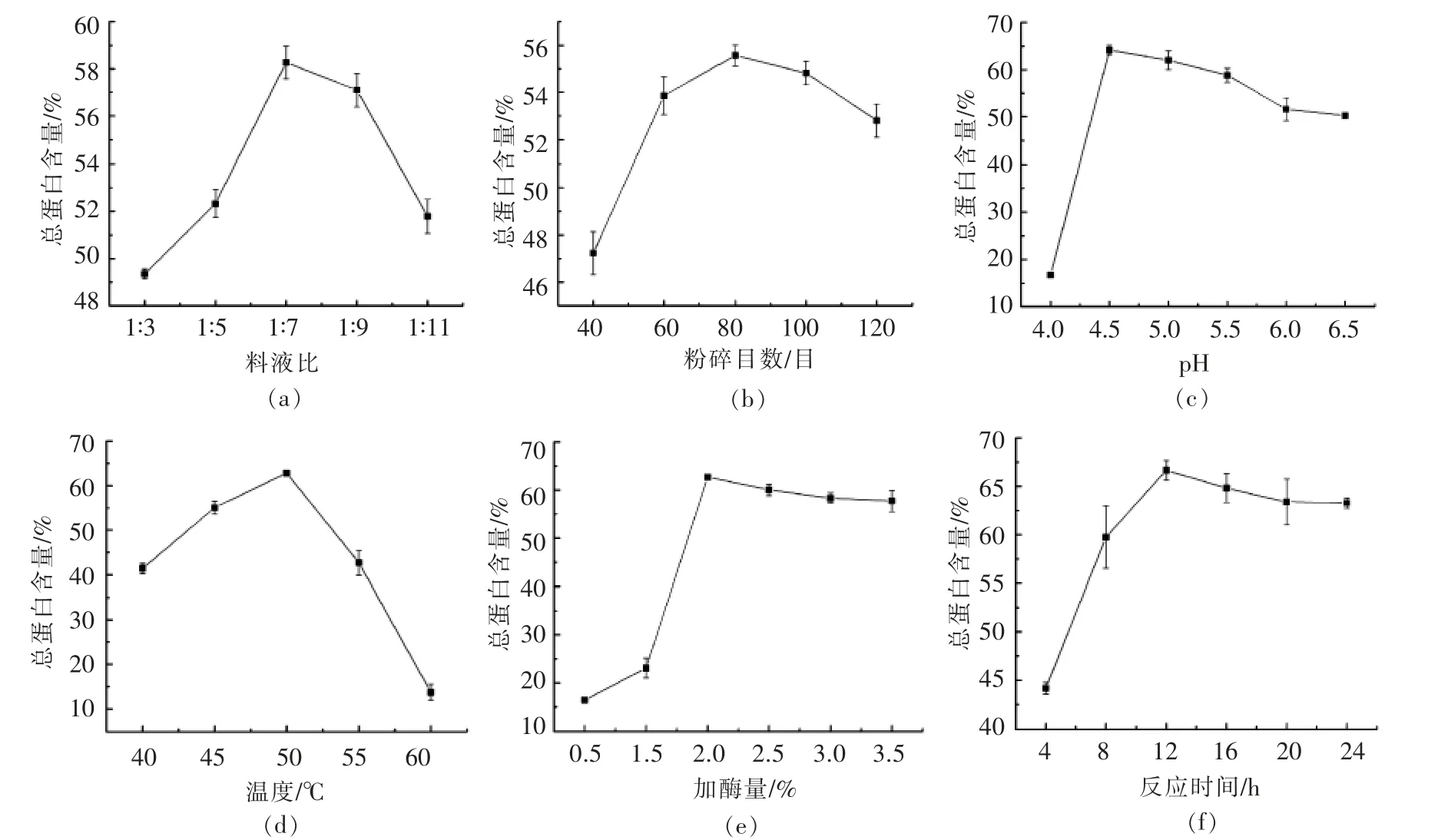
图3 不同因素对小米分离蛋白蛋白质含量的影响Fig.3 Effect of different factors on the protein content of millet protein isolate
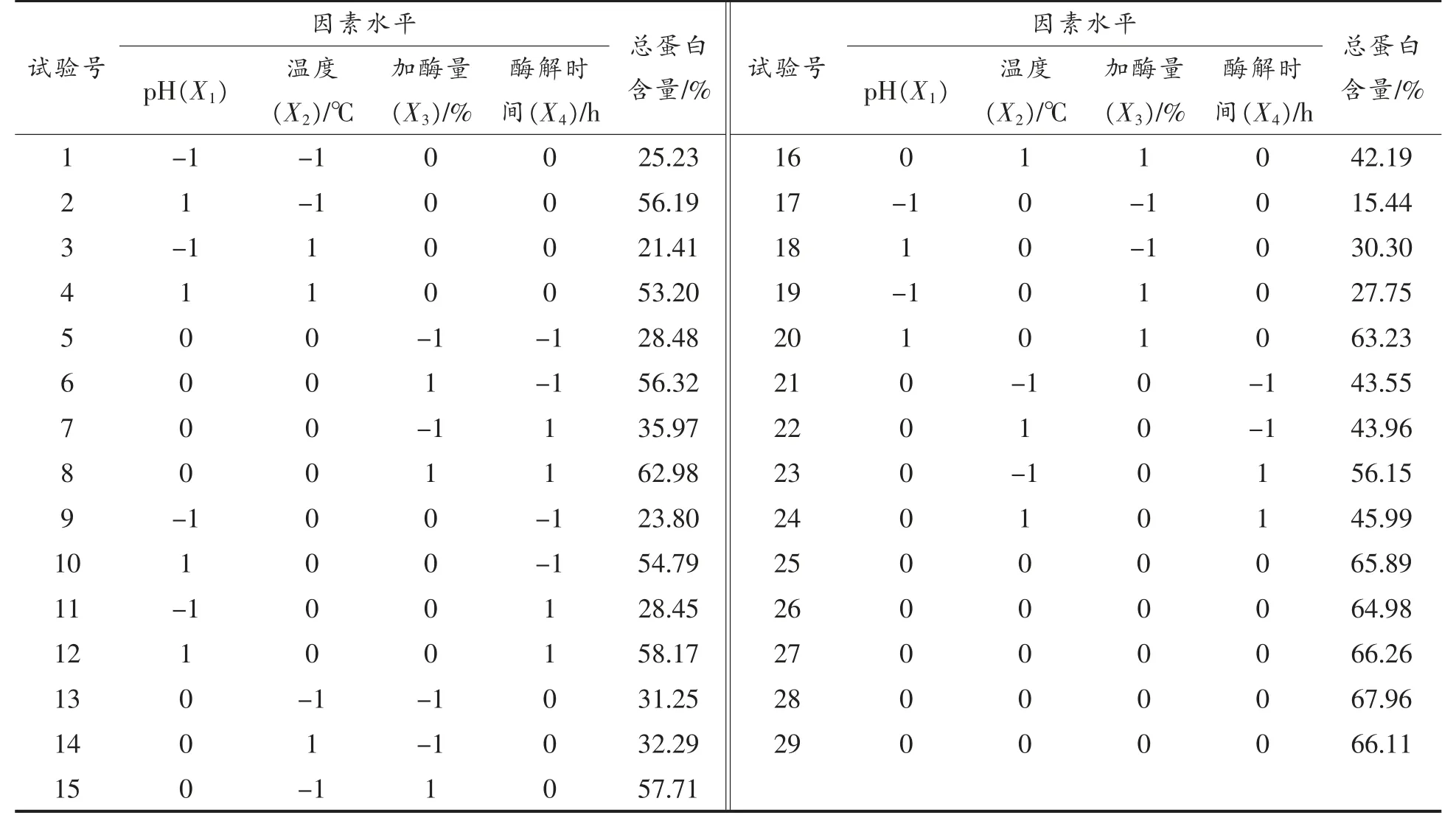
表6 响应面设计及试验结果Table 6 Program and experimental results of Box-Behnken test

表7 回归模型方差及可信度分析Table 7 Analysis of variance and reliability of regression model
由表7 可看出,回归模型P<0.0001,此二次回归方程模型差异极显著,模型的相关方程能够正确反应酶法提取MPI 蛋白含量与各因素之间的关系。失拟项P=0.0813>0.05,表示其不显著,试验误差小,模型相关系数R2=0.9872,R2Adj=0.9744,说明回归模型与实际试验拟合较好,不存在其它未考虑的影响因素。可利用此回归方程对MPI 蛋白含量进行分析、预测。
由表7 可知,X1,X2,X3,X4,X12,X22,X32,X42显著影响小米总蛋白含量,说明选取的4 个因素对小米分离蛋白蛋白含量的影响成非简单的线性关系,二次项同样对响应值影响显著。此外X1X3,X2X3,两两交互项对响应值也影响显著(图4)。响应面的陡峭程度随pH 值、加酶量的变化起伏较大,说明pH 值、加酶量对蛋白含量的影响大于反应温度和时间,该分析与表7 中方差分析结论一致。
为进一步确定三酶法提取高蛋白含量MPI 的最佳工艺,运用Design Expert 8.0.6 分析回归方程,得到最佳工艺条件为:pH 4.7,酶解温度48℃,加酶量2.2%,酶解时间10 h,此条件下预期的蛋白质含量69.11%,实际测得MPI 蛋白含量为(69.49±0.23)%,与预测值接近,偏差小,说明回归模型具有准确性和实用性。在该最佳条件下,对酶解后产物进行透析处理,将酶解后淀粉水解产生的小分子杂质除去,大分子蛋白截留在透析袋中,随后对透析后的MPI 进行蛋白质含量测定,可得蛋白质含量为(73.56±0.18)%。该方法较其它MPI提取方法有明显优势[5,11,34-35]。
3 结论
相比于碱溶酸沉法,酶法特异性强,条件相对温和,对蛋白质分子结构影响小,且蛋白提取率显著高于碱法。通过分析单酶法、双酶法及三酶法条件下的MPI 的分子质量分布、二级结构、提取率以及蛋白质含量,发现α-淀粉酶/糖化酶/复合纤维素酶法能较完整地提取小米蛋白的信息,此时蛋白质含量最高。

图4 各交互作用对MPI 蛋白含量影响的响应面图Fig.4 Response surface plots of the interaction of various factors on the MPI protein content
通过回归分析确定α-淀粉酶/糖化酶/复合纤维素酶法提取高蛋白含量MPI 的最佳pH 4.7,酶解温度48 ℃,加酶量2.2%,酶解时间10 h。该处理条件下蛋白质含量达(69.49±0.23)%,较其它MPI 提取方法优势明显。
