藻蓝色素调控RIPK1对多种非小细胞肺癌细胞活性的影响
2021-03-06李凡念刘媛璞李前程王成涛
郝 帅,李凡念,刘媛璞,李 爽,杨 起,李前程,王成涛
(北京市食品添加剂工程技术研究中心 北京工商大学食品与健康学院 北京100048)
肺癌是目前最为常见的恶性肿瘤之一,根据其肿瘤细胞的特征可以划分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(nonsmall cell lung cancer,NSCLC)两大类[1],其中非小细胞肺癌占肺癌发病率的80%以上,且转移率和死亡率极高[2],是目前人们关注的一类恶性肿瘤。目前对非小细胞肺癌最有效的治疗手段是外科手术,然而许多患者在诊断时已为晚期,丧失了手术机会,需借助放疗、化疗手段进行治疗[3]。尽管如此,5年存活率仍然只有16%[4]。非小细胞肺癌的有效治疗已成为全世界广泛关注的问题。
近年来,许多海洋天然产物被证实具有广谱的抗肿瘤活性,同时兼有高效、无毒、无副作用等特点,具有极大的药物开发的潜力,也是目前功能性食品领域的研究热点之一[5]。藻蓝蛋白(Phycocyanin,PC)是一类典型的功能性海洋天然产物。藻蓝蛋白又称为藻蓝色素蛋白,是源于螺旋藻、蓝藻等细胞中的藻胆蛋白(PBP)家族成员之一[6-7],由α 亚基和β 亚基组成的水溶性色素蛋白复合体。根据我国GB2760-2014 《食品添加剂使用标准》,藻蓝蛋白已被列为我国允许使用的天然食品着色剂[8],在饮料、糕点、糖果等食品行业都有重要应用。此外,国内外研究表明,藻蓝蛋白具有抗氧化、抗肿瘤、抗病毒等多种生理功能[9-10],是一种重要的食药同源型食品添加剂。目前,藻蓝蛋白的抗肿瘤活性是国内外的研究热点之一,相关研究显示,藻蓝蛋白对肺癌、乳腺癌、结肠癌、前列腺癌等多种癌细胞系均有不同程度的抑制效果[11-17]。其中肺癌,仅有文献[18]~[20]研究了藻蓝蛋白在非小细胞肺癌A549 细胞中的简单功能,其具体的调控机制尚不明确。深入探究藻蓝蛋白在非小细胞肺癌中的调控机制,能为藻蓝蛋白的开发利用和肺癌的治疗奠定重要的理论基础。
受体相互作用蛋白(receptor interacting protein,RIP)家族是一组能够参与调控细胞增殖和炎症信号转导的苏氨酸/丝氨酸蛋白激酶[21],其中,受体相互作用蛋白激酶1(receptor interacting proteinkinase1,RIPK1)作为RIP 家族中的第一成员,在调控细胞增殖和程序性死亡过程中发挥着重要的作用[22]。近年研究发现,RIPK1 在许多肿瘤细胞中呈现高表达,如朱广伟[23]发现特异性沉默RIPK1 的表达能够抑制胆囊癌细胞的增殖。宁志丰等[24]通过研究证明沉默RIPK1 的表达能够显著降低膀胱癌细胞T24 的体外增殖能力、克隆形成能力和侵袭能力。谭诗云等[25]将大肠癌Lovo 细胞进行体外转染RIPK1 特异性小干扰RNA(siRNA),发现细胞出现增殖缓慢、凋亡比例增加等现象。本研究中,对藻蓝蛋白处理的H1299 细胞进行转录组分析,旨在发现RIPK1 的表达差异。此外,为了深入研究藻蓝蛋白在多种肺癌中的调控机理,以H1299、H460 以及LTEP-a-2 3 种非小细胞肺癌为模型,研究藻蓝蛋白影响细胞增殖和凋亡的功能以及调控机制,为功能性食用色素藻蓝蛋白的深度利用提供重要的依据。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞株 人类非小细胞肺癌NCI-H1299细胞系(以下简称H1299 细胞系)、NCI-H460 细胞系(以下简称H460 细胞系)、LTEP-a-2 细胞系由本实验室(北京市食品添加剂工程技术研究中心)保存。
1.1.2 抗体 鼠抗β-Actin 抗体、兔抗RIPK1 抗体、兔抗Bax 抗体、鼠抗Bcl-2 抗体、抗鼠IgG 抗体、抗兔IgG 抗体,美国Cell Signaling Technology公司。
1.1.3 试剂 纯品藻蓝蛋白,内蒙古农业大学惠赠;胎牛血清,天津康源生物技术公司;1%青霉素-链霉素,美国Corning 公司;Opti-MEM 减血清培养基;Lipofectamine 3000,美国Invitrogen 公司;FastQuant cDNA 第一链合成试剂盒、SuperReal 荧光定量预混试剂增强版,天根生物技术有限公司;细胞凋亡检测试剂盒,北京拜尔迪生物技术有限公司;Western Blot 化学发光液、PVDF 膜,美国Millipore 公司;siRNA 阴性对照(以下简称NC)、RIPK1 siRNA,上海吉玛制药有限公司。
1.2 仪器与设备
恒温CO2细胞培养箱,Heraeus Eppendorf 公司;聚丙烯酰胺凝胶电泳仪及膜转印装置,美国Bio-Rad 公司;流式细胞仪,美国BD 公司;SpectraMax i3 多功能酶标仪,美国MD 公司;Tanon5200 全自动化学发光图像分析仪,北京原平皓生物技术有限公司;X-Ray 洗片机,上海德沐泰钶科贸有限公司;Phantom9900XL 扫描仪,MICROTEK 公司。
1.3 方法
1.3.1 细胞培养 H1299、H460、LTEP-a-2 非小细胞肺癌细胞株培养基均由含10%胎牛血清、1%青霉素-链霉素DMEM 培养基培养,培养条件:37℃、5% CO2恒温、恒湿培养箱中培养,确保每次用于试验的细胞株处于对数生长期且状态最佳。
1.3.2 藻蓝蛋白处理细胞 由于前期预试验结果显示4.8 μmol/L 藻蓝蛋白处理的细胞效果明显,因此本研究也采用此浓度处理细胞。称取纯品藻蓝蛋白溶于磷酸盐缓冲溶液,过滤除菌后加入细胞培养基中,配制4.8 μmol/L 浓度的培养基,用于处理3 种细胞株。放回细胞培养箱培养48~72 h,用于后续试验。
1.3.3 siRNA 的细胞转染试验 将处于最佳状态的细胞铺于60 mm 细胞培养皿中过夜培养,确保第2 天转染时细胞汇合度为30%~50%,且细胞单层均匀贴壁。配制siRNA-Lipofectamine 3000 混合物。首先取12.5 μL siRNA 加到125 μL Opti-MEM 减血清培养基中轻柔混匀;取7.5 μL 转染试剂Lipofectamine 3000 溶于125 μL Opti-MEM 减血清培养基中,同样轻柔混匀;随后将两混合物混合,室温孵育10 min,使siRNA-Lipofectamine 3000 混合物形成;最后将脂质体混合物均匀滴加到细胞中,轻晃混匀,放入细胞培养箱培养48~72 h,用于后续试验。
1.3.4 MTT 法检测细胞增殖 藻蓝蛋白处理的细胞增殖检测:以5 000 个/孔细胞量将3 种细胞接种于96 孔板中,过夜,使细胞贴壁生长,加入4.8 μmol/L 藻蓝蛋白处理,再加入10 μL MTT 溶液,6 h 后加入100 μL SDS-HCl 裂解液,12 h 后测定570 nm 处吸光值。连续测定5~6 d 吸光值并记录数据。以时间为横坐标,吸光值(OD 值)为纵坐标,绘制细胞的生长曲线,统计细胞生长情况。
转染siRNA 的细胞增殖检测:将转染24 h 的RIPK1 siRNA、NC 的细胞铺于96 孔板中,按照以上操作测定吸光值,绘制细胞生长曲线。
1.3.5 细胞凋亡检测 收集藻蓝蛋白处理48 h的细胞和转染RIPK1 siRNA 48 h 的细胞,调整细胞浓度至5×105和1×106个/mL。取1 mL 细胞悬液,4 ℃、1 000 r/min 离心5 min,弃上清;加入1 mL 冰浴预冷的PBS 缓冲溶液,轻轻震荡使细胞悬浮,4 ℃、1 000 r/min 离心5 min,弃上清;加入250 μL 1×结合液重悬细胞,然后加入5 μL Annexin V-FITC 染色液,轻轻混匀,避光室温反应15 min;加入5 μL 碘化丙啶(propidium iodide,PI),轻轻混匀,室温避光反应5 min;最后加入250 μL 1×Binding Buffer,利用流式细胞仪FITC 和PI通道检测细胞凋亡的程度。统计细胞早期、晚期凋亡比例。
1.3.6 提取细胞总RNA 并检测RIPK1 转录水平表达差异 采用TRIZOL 法提取沉默RIPK1 的3 种非小细胞肺癌细胞的总RNA,溶于DEPC 水中,-80 ℃保存。根据反转录试剂盒对RNA 进行反转录,产物cDNA 作为荧光定量PCR 试验的模板,验证转染siRNA-RIPK1 和NC 的细胞株中RIPK1 基因在转录水平上的沉默效果。荧光定量PCR 试验采用三步法进行,反应过程为:95 ℃2 min 的预变性,95 ℃30 s,60 ℃1 min,一共40 个循环。其引物序列见表1(内参基因为GAPDH)。

表1 用于定量PCR 的引物序列表Table 1 Primer sequences for qRT-PCR
1.3.7 Western Blot RIPA 裂解液提取细胞总蛋白,收集藻蓝蛋白处理72 h 的细胞和转染RIPK1 siRNA 72 h 的细胞,加两倍于细胞沉淀体积的RIPA 裂解液,将裂解充分的细胞4 ℃、12 000 r/min 离心45 min,取其上清转移到新的离心管中备用,弃细胞沉淀。取出适量蛋白上清液,用于蛋白浓度测定。蛋白浓度采用Bradford 法测定,记录数据并计算上样量。向总蛋白上清液中加入6×蛋白上样缓冲液,混匀,沸水浴煮10 min 使蛋白变性。根据计算的上样量分装蛋白放置-80 ℃保存。
按照Marker、对照组、试验组蛋白依次上样,用12% SDS-PAGE 胶分离蛋白,将蛋白质转移到聚偏二氟乙烯(PVDF)膜上,350 mA 恒流转膜1.5 h。接下来按照检测蛋白大小将蛋白剪膜,用5%脱脂奶粉封闭1.5 h,孵育一抗过夜。用TBST溶液清洗3~4 次,每次10 min,37 ℃恒温孵育二抗40~60 min,再用TBST 溶液清洗3~4 次,孵化学发光液显色,采用化学发光图像分析仪对目的蛋白条带曝光,保存图片,分析试验结果。
1.3.8 数据处理 数据处理软件采用Microsoft Excel 2010,作图软件为Origin 8.5,每个试验重复3 次。显著性差异分析采用Student t-test 双尾检验分析,其中P<0.05 为显著性差异,P<0.01 为极显著差异。
2 结果与分析
2.1 藻蓝蛋白对非小细胞肺癌H1299、H460、LTEP-a-2 细胞增殖的影响
前期研究表明,4.8 μmol/L 藻蓝蛋白对多种非小细胞肺癌具有较好的抑制效果,因此本研究采用此浓度做细胞试验。首先将藻蓝蛋白处理的H1299、H460 及LTEP-a-2 细胞用MTT 法检测细胞体外增殖能力。如图1所示,与对照组相比(未经过藻蓝蛋白处理组),藻蓝蛋白处理后,3 种细胞的体外增殖能力显著降低,表明藻蓝蛋白能够有效抑制H1299,H460 及LTEP-a-2 细胞的生长,这与和Bingula 等[18]和Li 等[19-20]在A549 细胞中的试验结果一致。
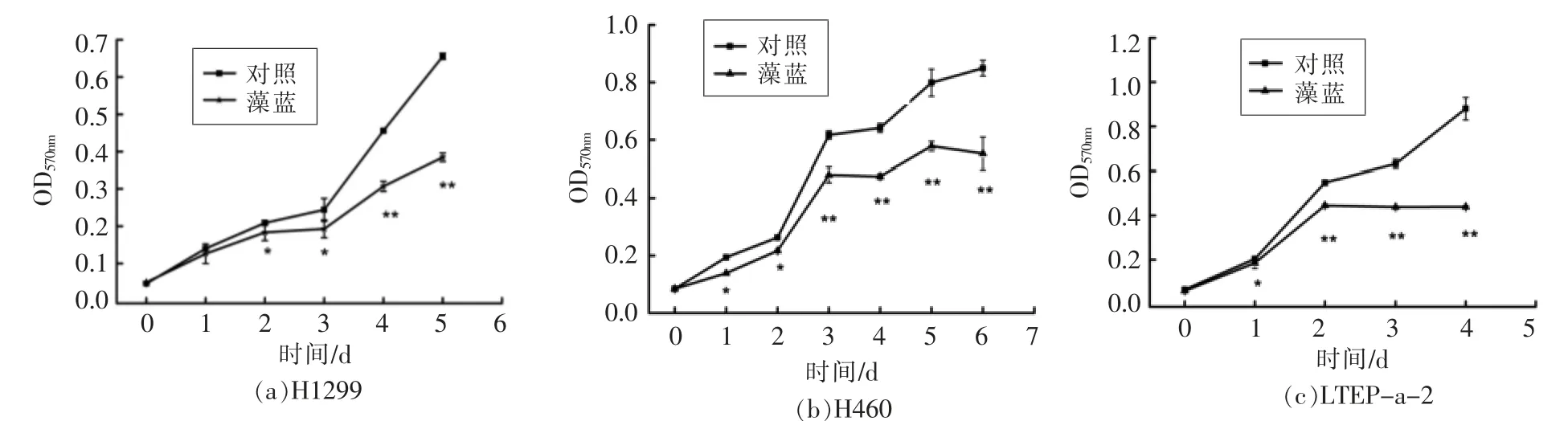
图1 藻蓝蛋白对非小细胞肺癌H1299、H460、LTEP-a-2 细胞增殖的影响Fig.1 Effect of C-phycocyanin on proliferation of NSCLC H1299,H460 and LTEP-a-2 cells
2.2 藻蓝蛋白对非小细胞肺癌H1299、H460、LTEP-a-2 凋亡的影响
随后,为证实藻蓝蛋白对细胞凋亡的影响,采用Annexin V-FITC/PI 染液对藻蓝蛋白处理的细胞进行染色,并用流式细胞仪检测细胞凋亡程度。由图2 可知,与对照组相比,藻蓝蛋白处理后,3种细胞的早期凋亡和晚期凋亡比例均显著增加,表明藻蓝蛋白能促进H1299、H460 及LTEP-a-2细胞的凋亡。这一结果与图1 中细胞增殖结果相佐证。

图2 藻蓝蛋白对非小细胞肺癌H1299、H460、LTEP-a-2 细胞凋亡的影响Fig.2 Effect of C-phycocyanin on apoptosis of NSCLC H1299,H460 and LTEP-a-2 cells
2.3 藻蓝蛋白对非小细胞肺癌凋亡相关蛋白的影响
此外,在藻蓝蛋白处理前、后的3 种细胞中检测到两个凋亡相关的经典蛋白(Bax 和Bcl-2)的表达。Bax 是经典的促凋亡蛋白,而Bcl-2 具有抗凋亡作用。从图3 可看出,与对照组相比,藻蓝蛋白处理后3 种细胞中的Bax 蛋白均出现明显上调,而Bcl-2 蛋白明显下调,这与图2 的细胞凋亡试验结果一致。
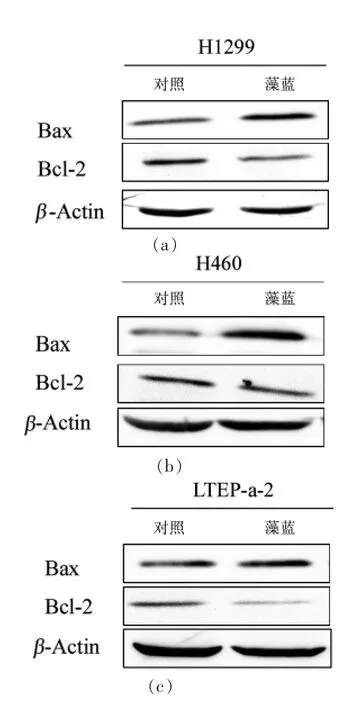
图3 藻蓝蛋白处理非小细胞肺癌H1299、H460、LTEP-a-2 后Bax 和Bcl-2 蛋白表达分析Fig.3 Analysis of Bax and Bcl-2 expressions in NSCLC H1299,H460 and LTEP-a-2 cells after C-phycocyanin treatment
2.4 藻蓝蛋白处理H1299 细胞转录组分析
在前期的研究中,采用藻蓝蛋白处理H1299细胞并进行转录组测序。分析结果表明,从转录组共筛选出1 521 个差异基因(图4),其中710 个表达上调的基因(红色点表示),811 个表达下调的基因(蓝色点表示)。其中,RIPK1 在藻蓝蛋白处理后出现极显著下调(下调比例接近80%),是一个重要的差异调控基因(图4)。由于RIPK1 能够参与调控多种肿瘤细胞的生长,因此猜想RIPK1 可能在藻蓝蛋白影响非小细胞肺癌增殖和凋亡过程中担任重要角色。随后,对藻蓝蛋白的调控机制进行研究。
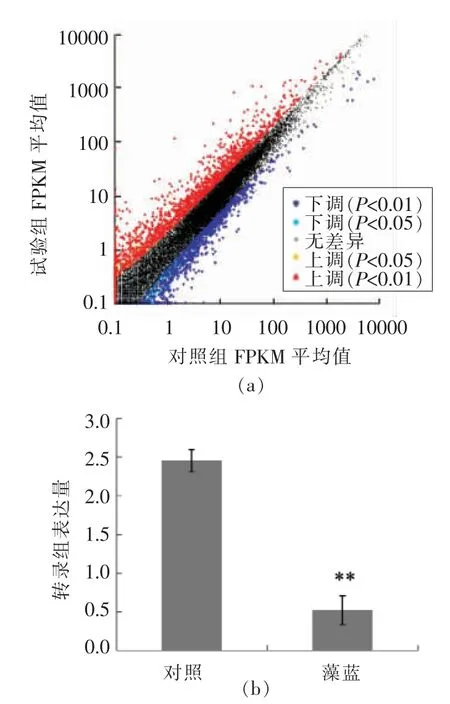
图4 转录组结果分析Fig.4 Transcriptome analysis result
2.5 定量qRT-PCR 转录组验证
基于转录组结果,采用定量PCR(qRT-PCR)技术对RIPK1 的转录水平进行验证。由图5所示,与对照组相比,藻蓝蛋白处理后,RIPK1 在H1299、H460 和LTEP-a-2 细胞中的转录水平均显著降低(降低比例超过90%),表明藻蓝蛋白能够抑制RIPK1 基因在3 种细胞中的转录,这与转录组的筛选结果一致。
2.6 RIPK1 特异性小干扰RNA(RIPK1 siRNA)的转染效果
以上研究结果表明,藻蓝蛋白能抑制3 种细胞的体外增殖,诱导细胞凋亡,并且显著降低RIPK1 基因的转录水平,因此推测藻蓝蛋白可能通过下调RIPK1 的表达来抑制细胞的增殖,促进其凋亡。随后,通过体外转染小干扰RNA(siRNA)的手段特异性沉默RIPK1 的表达,进而对细胞的增殖和凋亡进行测定。图6 显示siRNA 转染细胞后RIPK1 表达水平的检测结果。H1299、H460 和LTEP-a-2 细胞沉默RIPK1 后,分别在转录水平和蛋白水平得到明显的沉默效果,这也进一步为后续细胞增殖和凋亡验证奠定了基础。
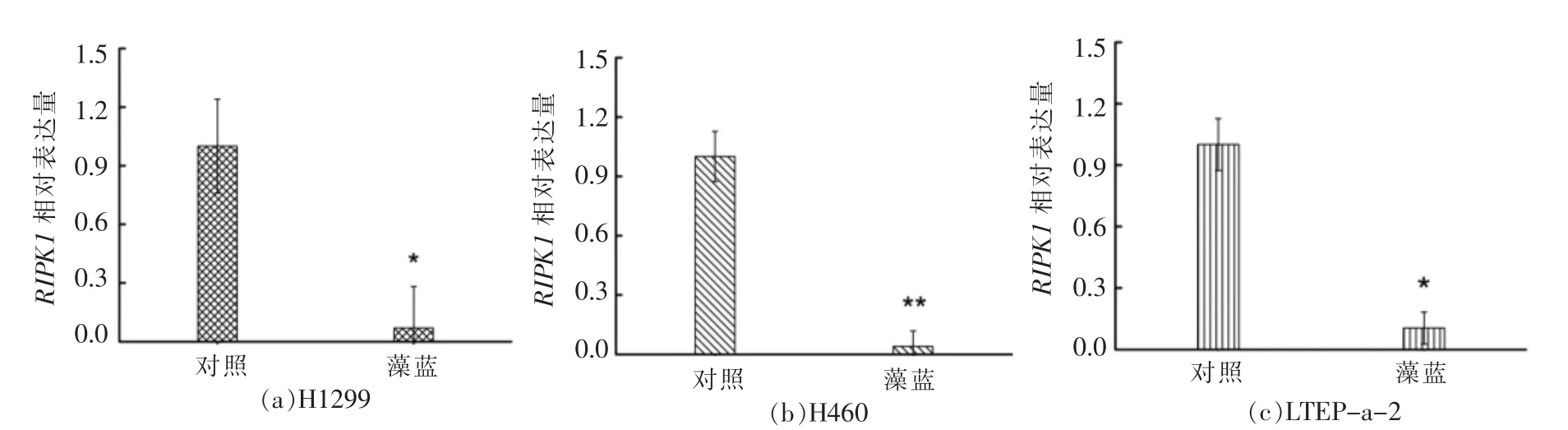
图5 RIPK1 表达量的转录组结果验证Fig.5 Validation of RIPK1 expression in transcriptome results

图6 RIPK1 小干扰RNA 在3 种细胞中的转染效果Fig.6 Transfection effect analysis of RIPK1 siRNA in three cells
2.7 沉默RIPK1 对3 种非小细胞肺癌增殖的影响
siRNA 沉默RIPK1 后,首先对3 种细胞的体外增殖能力进行验证。由图7 可知,干预RIPK1蛋白的表达均抑制了3 种细胞的体外生长能力。沉默RIPK1 后从第1 天(H460 和LTEP-a-2 细胞)或第2 天(H1299 细胞)开始,细胞的增殖数量就显著低于对照组。以上试验结果表明,RIPK1 的表达干预确实能显著影响H1299、H460 和LTEPa-23 种非小细胞肺癌的体外增殖能力,也进一步证实了RIPK1 在藻蓝蛋白介导的细胞生长抑制过程中参与了重要的调控作用。
2.8 沉默RIPK1 对3 种非小细胞肺癌凋亡的影响
此外,对沉默RIPK1 后的3 种细胞进行凋亡程度的检测,结果见图8。与对照组相比,除了H460 细胞的晚期凋亡比例没有显著差异外,干预RIPK1 的表达后,细胞的早期凋亡和晚期凋亡比例均明显增加,表明沉默RIPK1 后也能够引起H1299、H460 和LTEP-a-2 细胞的凋亡,这与藻蓝蛋白处理后的结果一致,也进一步证实RIPK1 介导了藻蓝蛋白诱导非小细胞肺癌细胞凋亡的调控过程。
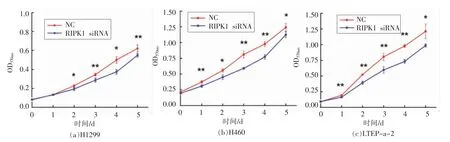
图7 沉默RIPK1 对非小细胞肺癌H1299、H460、LTEP-a-2 增殖的影响Fig.7 Effect of silencing RIPK1 on proliferation of NSCLC H1299,H460 and LTEP-a-2 cells
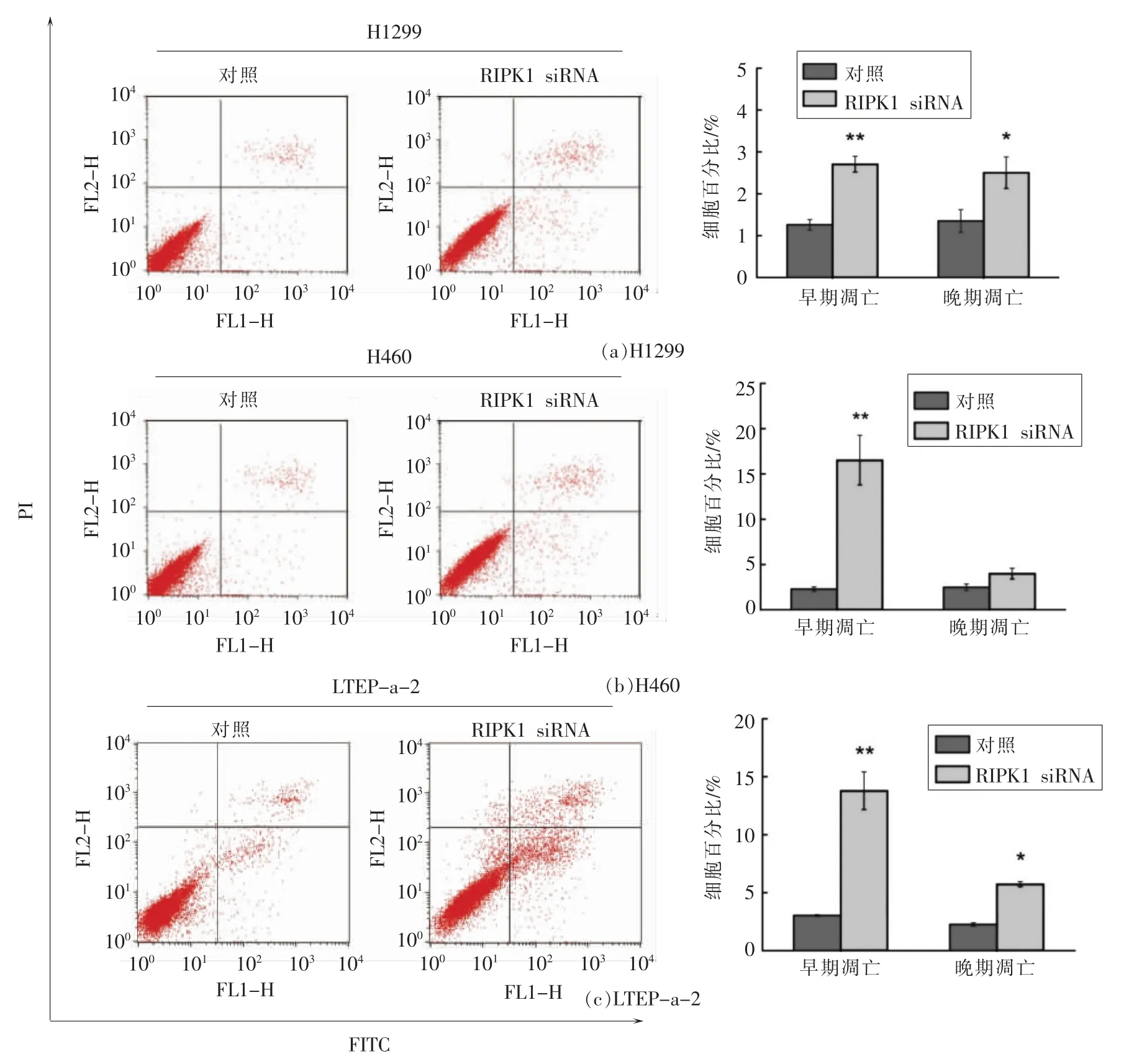
图8 沉默RIPK1 对非小细胞肺癌H1299、H460、LTEP-a-2 凋亡的影响Fig.8 Effect of silencing RIPK1 on apoptosis of NSCLC H1299,H460 and LTEP-a-2 cells
2.9 沉默RIPK1 对非小细胞肺癌凋亡相关蛋白的影响
为了进一步证实RIPK1 参与藻蓝蛋白诱导3种非小细胞肺癌凋亡过程,对沉默RIPK1 后3 种细胞中的促凋亡蛋白Bax 和抑凋亡蛋白Bcl-2 进行Western Blot 检测,结果见图9。与对照组相比,Bax、Bcl-2 蛋白表达表现出不同程度的差异,总体来看,Bax 蛋白水平出现上调,Bcl-2 蛋白水平出现下调趋势。Bcl-2/Bax 的比率倾向于引起细胞凋亡。这与图8 细胞凋亡的检测结果一致,进一步证实了RIPK1 通过调控凋亡相关蛋白Bax、Bcl-2 参与藻蓝蛋白诱导非小细胞肺癌凋亡的过程。
3 结论
本研究以3 种非小细胞肺癌H1299、H460 和LTEP-a-2 细胞为研究模型,对藻蓝蛋白影响细胞增殖和凋亡的调控机制进行研究。结果表明,藻蓝蛋白能够显著抑制3 种细胞的体外增殖能力,并诱导细胞凋亡。对其中一种细胞H1299 的转录组测序后发现,RIPK1 在藻蓝蛋白处理后出现极显著下调。在3 种细胞中采用siRNA 小干扰RNA 特异性沉默RIPK1 的表达,显著降低了RIPK1 的转录水平和蛋白水平。此外,干预RIPK1 的表达也能够显著抑制3 种细胞的体外增殖能力,并显著促进细胞的凋亡,与藻蓝蛋白处理细胞的表型结果一致。藻蓝蛋白通过下调RIPK1 的表达而抑制H1299、H460 和LTEP-a-2 细胞的体外增殖能力,促进其凋亡。

图9 沉默RIPK1 后对非小细胞肺癌H1299、H460、LTEP-a-2 中Bax 和Bcl-2 蛋白表达量的检测Fig.9 Analysis of Bax and Bcl-2 expressions in NSCLC H1299,H460 and LTEP-a-2 cells after transfection with RIPK1 siRNA
