婴幼儿配方奶粉对人结肠腺癌系Caco-2细胞和SD大鼠腹腔巨噬细胞自由基水平的影响
2021-03-06丁亚男高观祯汪惠勤周建武饶平凡
丁亚男,高观祯,汪惠勤,周建武,饶平凡
(中国科学院上海生命科学研究院-浙江工商大学食品营养科学联合研究中心 杭州310035)
氧化应激(Oxidative Stress,OS)是指机体内活性氧自由基(Reactive oxygen species,ROS)代谢失衡,ROS 浓度超过内源性抗氧化防御系统抗氧化能力而产生的现象,过量的活性氧自由基会氧化生物大分子,导致蛋白质变性、脂质过氧化,进而损伤线粒体、溶酶体,引起细胞和机体的损伤[1]。氧化应激与许多疾病都有着密切的关系,比如氧化应激和不同病因的高血压均存在密切关系[2];氧化应激是造成血管内皮细胞功能障碍的主要因素;血糖水平与氧化应激的程度密切相关;结肠上皮细胞的氧化应激会导致肠组织损伤[3]等。胃、肠道作为体内产生的活性氧与膳食抗氧化剂作用的第一场所,肠黏膜在吸收营养物质的同时不断暴露于各种外来抗原,此时处于氧化应激状态的胃、肠道黏膜细胞必须产生强有力的保护性免疫反应,如分泌细胞因子、生长因子、黏附因子等生物标志物,以应对各种致病性物质侵袭[4]。
食物的摄入是影响人体氧化-还原平衡重要的因素之一,抗氧化食品及其抗氧化成分的研究也成为近年来的研究热点。伴随着抗氧化成分的研究,抗氧化能力的各种测定方法日益完善。体外的抗氧化能力评估方法可以分为胞外和胞内2 种形式,胞外的方法包括2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐【Trolox equivalent antioxidant capacity/2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)assay,ABTS·+】、铁离子还原能力(Ferric ion reducing antioxidant power,FRAP)和氧自由基清除能力测定(Oxygen radical absorbance capacity,ORAC)等,其原理主要是通过测定样品是否具有通过氢电子转移(Hydrogen atom transfer,HAT)或单电子转移(Single electron transfer,SET)途径对自由基进行猝灭的能力[5]。胞外抗氧化能力的整体评估效应逐渐受到质疑,很多研究认为该方法不能完整体现受测样品在生物系统内的抗氧化能力[6]。近年来,一类基于细胞模型的胞内抗氧化测定方法逐渐发展并得到广泛的应用。这种统称为细胞内抗氧化活性测定方法(Cellular antioxidant activity assay,CAA)由Wolfe 等[7]和Wang 等[8]发展并完善,通常以Caco-2 和HepG2 细胞作为模型,可以对水果、蔬菜等食物的抗氧化能力做出较全面的评估[9-10]。
婴幼儿体内的氧化-还原平衡很大程度上依赖于摄入的母乳或者婴幼儿配方奶粉进行调节[11]。对使用配方奶粉的婴幼儿来说,婴幼儿配方奶粉不仅提供了营养物质和能量,也是其食物抗氧化能力的唯一或主要来源。婴幼儿配方奶粉的配方和生产过程中,受关注的不仅是营养成分的含量和稳定程度,还应包含对其抗氧化能力的评估。
婴幼儿配方奶粉是供3 岁以内婴幼儿食用的奶制品,它以牛乳或羊乳为主要原料,加入维生素和矿物质等成分,使其营养指标最大限度地接近母乳[12]。虽然世界卫生组织(WHO)大力推荐母乳喂养,但是婴幼儿配方奶粉仍有巨大的市场需求。在中国市场,特别是在2013年放开二胎政策后,婴幼儿配方奶粉的需求逐年增高,预计未来继续增长[13]。牛奶中含有天然非酶抗氧化剂(如维生素A、C 等)、抗氧化酶类以及具有抗氧化作用的蛋白质及其水解产物[14],配方奶粉中还额外添加了其它一些抗氧化剂。目前,乳制品大多以总抗氧化能力(Total antioxidative capacity)评估样品,以ABTS·+、FRAP[15]和ORAC[16]等化学方法或红外光谱等物理方法检测,少有报道应用CAA 法测定其胞内抗氧化能力[17]。
本研究报道一种用于评估婴幼儿配方奶粉的,基于巨噬细胞和Caco-2 细胞的CAA 胞内抗氧化能力评估模型,这2 种细胞分别代表消化道黏膜系统中的免疫细胞和上皮细胞。对随机选取的市售婴幼儿配方奶粉进行胞内抗氧化能力调查,以期获得该配方奶粉对消化道上皮细胞及其黏膜免疫系统自由基水平的调节能力。
1 材料与方法
1.1 试验材料
5 种品牌一段婴幼儿奶粉,购于当地超市;SD大鼠,4~8 周龄,雄性,由浙江省实验动物中心提供;人结肠腺癌系Caco-2 细胞,由中科院上海生命科学研究院细胞库提供。
1.2 试剂
细胞培养基DMEM、MEM、磷酸盐缓冲液PBS、Hank’s 缓冲液(HBSS)、胎牛血清(FBS)、青霉素-链霉素混合溶液、0.25%胰酶细胞消化液、MitoSOX Red 荧光染色液,Thermo Fisher 公司;二甲基亚砜(DMSO,细胞级)、2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)、2,2’-偶氮二异丁基脒二盐酸盐(AAPH),美国Sigma-Aldrich 公司。
1.3 仪器与设备
荧光倒置显微镜(DMI3000 B),美国Leica 公司;多功能钙流检测工作站(FlexStation 3),美国Molecular Devices 公司;电子分析天平(微量,XS105DU),Mettler Toledo 仪器(上海)有限公司;电热恒温鼓风干燥箱(XMTD-8222),上海精宏实验设备有限公司。
1.4 试验方法
1.4.1 奶粉母液的配制 5 种配方奶粉中的必需成分(蛋白质、脂肪、碳水化合物、维生素、矿物质)含量符合GB10765-2010,可选择性成分的种类和添加量存在稍许差异。
称取1 g 奶粉,加入5 mL 70 ℃的超纯水中,搅拌并置于超声水浴(70 ℃)5 min,促进溶解均匀。获得的奶粉溶液即200 mg/mL 母液,置于37℃水浴,待用。
1.4.2 细胞培养
1.4.2.1 人结肠腺癌系Caco-2 细胞培养 人结肠腺癌系Caco-2 细胞培养基为MEM,另含有12%胎牛血清、1%非必须氨基酸、1%丙酮酸钠、1%谷氨酰胺、100 U/mL 青霉素和100 μg/mL 链霉素。置于37 ℃,CO2含量为5%的恒温培养箱中培养,每2 d 更换1 次培养基。当细胞汇合度在70%~80%时进行传代。人结肠腺癌系Caco-2 细胞传代数在15~20 之间。
1.4.2.2 原代腹腔巨噬细胞培养 将SD 大鼠脱颈处死,在75%乙醇溶液中浸泡5 min。将大鼠倒立提起30 s,置于无菌操作台上,从腹腔左下角注入不含血清的DMEM 维持液10 mL,仰卧平放大鼠,轻轻揉大鼠腹部后静置5 min。小心打开大鼠腹腔皮层,用针管注射器轻轻探入腹腔并抽取体液,吸取过程中需小心,避免刺到肌肉或组织而使红细胞混杂于体液中。将得到的8~9 mL 体液移入无菌离心管中,于25 ℃条件下400×g 离心5 min。将沉淀用含10%胎牛血清,100 U/mL 青霉素和100 μg/mL 链霉素DMEM 培养基重悬,即为细胞悬液,根据试验需要调整细胞浓度,接种到培养瓶中用于试验。
1.4.3 MTT 法检测细胞存活率 将对数生长期细胞的密度调至5×105cell/mL 后,接种于透明96 孔板中,每孔加入细胞悬液200 μL,置37 ℃,CO2体积分数为5%的恒温培养箱中培养。待80%细胞融合后,分为对照组、空白对照组和样品组,分别加入样品后继续培养24 h。取出,在每孔中加入20 μL,5 mg/mL MTT 溶液,继续培养4 h。最后,每孔中加入180 μL DMSO 溶解的紫色的甲瓒晶体,振荡培养10 min 后在酶标仪上测定吸光值,测定波长570 nm。根据公式(1)计算各组的细胞存活率。
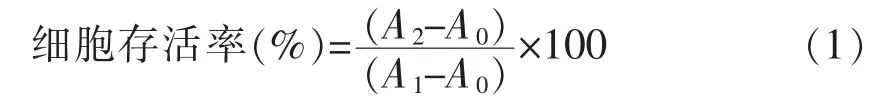
式中,A0,A1,A2——分别代表空白对照组、对照和样品组的吸光度。
1.4.4 细胞内抗氧化活性(CAA)检测 将对数生长期细胞的密度调至5×105cell/mL 后,接种于黑板透底的96 孔板中,每孔加入细胞悬液200 μL,置5% CO2、37 ℃条件下培养。待80%细胞融合后,移去残余培养基,用PBS 清洗1 次,加入100 μL 含样品的维持液,于5% CO2、37 ℃ 培养30 min。取出,每孔加入100 μL DCFH-DA 荧光探针(终浓度为25 μmol/L),继续培养30 min。移去残余培养液,在每孔中加入150 μL HBSS 清洗1次,最后在每孔中加入100 μL,600 μmol/L AAPH溶液,然后立即于发射波长538 nm,入射波长485 nm 条件下测定荧光值,测定时间1 h,每5 min 测定3 个重复孔,生成动力曲线。每个样品梯度做3个平行孔,阳性对照组和空白组做5 个平行孔。以维持液中的细胞为阴性对照,以AAPH 处理的细胞为阳性对照。根据公式(2)计算各组CAA 值。

式中,∫SA——样品组荧光曲线的积分下面积;∫CA——对照组荧光曲线的积分下面积。
1.4.5 胞浆ROS 检测 细胞接种与CAA 法相同,待80%细胞融合后,移去残余培养基,用PBS清洗1 次。每孔加入100 μL 含1 mg/mL 样品的维持液(每个梯度做3 个平行孔,空白组做5 个平行孔)。在5% CO2、37 ℃条件下继续培养5 h,移去残余培养液,然后每孔加入150 μL HBSS 清洗1次,再加入100 μL,10 μmol/L DCFH-DA 荧光探针溶液,孵育30 min,然后每孔加入150 μL HBSS清洗2 次,立即于发射波长538 nm,入射波长485 nm 条件下测定荧光值。根据公式(3)可以计算样品对细胞内的自由基清除率。

1.4.6 线粒体内ROS 检测 细胞接种与CAA 法相同,待80%细胞融合后,移去残余培养基,用PBS 清洗1 次。每孔加入100 μL 含1 mg/mL 样品的维持液(每个梯度做3 个平行孔,空白组做5 个平行孔)。于5% CO2,37℃条件下继续培养24 h,移去残余培养液,每孔加入150 μL HBSS,再移除HBSS,加入100 μL 2.5 μmol/L 线粒体超氧化物红色荧光探针(MitoSOX Red)于37 ℃下染色10 min,吸出反应液,加入150 μL HBSS 清洗2 次,用荧光倒置显微镜观察线粒体内自由基水平。
1.4.7 数据处理与分析 相关试验均做3 次平行试验,数据结果以平均值±标准偏差(±s)表示。利用Microsoft Excel 对数据进行方差分析和显著性检验,采用GraphPad Prism 5.0 软件作图,ImageJ软件处理荧光图像。显微观察试验做3 次平行,以确保试验的重现性。
2 结果与分析
2.1 配方奶粉对细胞存活率的影响
如图1a所示,在质量浓度10~4 400 μg/mL-1范围,5 种婴幼儿配方奶粉对Caco-2 细胞存活率均无明显影响,既未造成细胞毒性,也未表现出对Caco-2 细胞的促生长作用。如图1b所示,在巨噬细胞的MTT 测试中,质量浓度为4 400 μg/mL 时,1,2,4 号及5 号配方奶粉样品均表现出对巨噬细胞显著的促生长作用(P<0.05)。在质量浓度为1 100 μg/mL 时,1 号和2 号样品也表现出对巨噬细胞显著的促生长作用(P<0.05)。在其余受测质量浓度下,5 种配方奶粉样品对巨噬细胞存活率均无明显影响。通过MTT 法评估5 种婴幼儿配方奶粉对2 种细胞存活率的影响,在后续细胞试验中选取的配方奶粉质量浓度在40~1 000 μg/mL范围,以避免配方奶粉的细胞毒性或增殖作用对后续测试结果的影响。
2.2 配方奶粉的胞内抗氧化活性
如图2所示,在腹腔巨噬细胞和Caco-2 细胞的CAA 模型中,不同质量浓度(0.04,0.20,1.00 mg/mL)下的5 种婴幼儿配方奶粉均表现出不同程度的胞内抗氧化活性。在2 种细胞的CAA 测定中,配方奶粉的抗氧化能力均表现出一定的质量浓度相关性,质量浓度越高的样品表现出的胞内抗氧化能力越强。相同的配方奶粉样品在腹腔巨噬细胞和Caco-2 细胞的CAA 模型中分别表现出不同的抗氧化能力。如图2a所示,在Caco-2 细胞CAA 模型中,表现出最强胞内抗氧化活性的是为5 号样品(1 mg/mL),CAA 值分别达到56 个CAA单位。如图2b所示,在巨噬细胞CAA 模型中3 号样品表现出最强抗氧化活性,为63 个CAA 单位,在Caco-2 细胞的CAA 模型中其抗氧化值为53个CAA 单位。类似的,相同质量浓度的同一样品在2 个细胞系中的CAA 值均不同。

图1 婴幼儿配方奶粉对Caco-2 细胞(a)、腹腔巨噬细胞(b)存活率的影响Fig.1 Effects of infant formula milk powders on the survival rate of Caco-2 cells(a)and peritoneal macrophages(b)
如图3所示,在Caco-2 和腹腔巨噬细胞2 种细胞CAA 模型中,质量浓度为1 mg/mL 的婴幼儿配方奶粉的DCFH 氧化动力学曲线有明显不同,表现出不同的动力学特征。在图3a Caco-2 细胞模型中,自由基清除速率随时间的延长而不断增加,而图3b 腹腔巨噬细胞模型中,自由基清除速率基本保持一致。

图2 婴幼儿配方奶粉在Caco-2 细胞(a)、腹腔巨噬细胞(b)中的抗氧化力Fig.2 Antioxidant capacity(in CAA units)of infant formula milk powders in Caco-2 cells(a)and peritoneal macrophages(b)
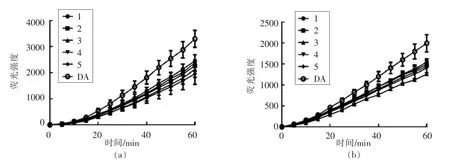
图3 婴幼儿配方奶粉对Caco-2 细胞(a)、腹腔巨噬细胞(b)过氧化氢自由基氧化DCFH 的动力学曲线图(±s,n=3)Fig.3 Effects of infant formula milk powders on the kinetics of the oxidation of DCFH by hydroxyl radical on Caco-2 cells(a)and peritoneal macrophages(b)(±s,n=3)
2.3 配方奶粉清除细胞内自由基能力
荧光染料DCFH-DA 是一种广泛使用的自由基捕获剂[18],它进入细胞后被细胞膜中脂酶水解成DCFH,随后被细胞内的ROS 氧化生成具有荧光的DCF-。通过检测DCF-荧光强度反映细胞胞浆的ROS 含量[19]。
图4 显示5 种婴幼儿配方奶粉对胞内自由基清除效率。对Caco-2 细胞胞内自由基清除率最高的为1 号样品。腹腔巨噬细胞中,胞内自由基清除率最高的为3 号样品。这二者的胞内自由基清除率都超过30%。出乎意料的是,在CAA 模型中表现出具有抗氧化活性的受测奶粉并未完全表现出胞内自由基清除能力。无论对Caco-2 细胞还是腹腔巨噬细胞,2 号与4 号样品均未表现出胞内自由基清除能力,反而使胞浆自由基含量升高。
2.4 配方奶粉对线粒体内自由基的影响
线粒体不仅是能量物质ATP 产生的场所,也是活性氧ROS 的主要来源,同时也是细胞氧化应激损伤的靶器官[20]。为了探明配方奶粉调整的胞内自由基和线粒体自由基之间的关系,进一步调查了配方奶粉对线粒体活性氧自由基的影响。
线粒体超氧化物红色荧光探针(MitoSOX Red)是活性氧ROS 特异性荧光指示剂,其荧光强度和线粒体内的ROS 浓度成正比,可用于线粒体内ROS 水平的检测。由图5、6 和7 可知,在腹腔巨噬细胞和Caco-2 细胞中,2 号和4 号样品造成的红色荧光强度都显著高于对照组,而1 号、3 和5 号样品造成的红色荧光强度明显低于对照组,这表明1 号、3 号和5 号样品可降低线粒体活性氧自由基浓度,而2 号和4 号样品则会增加线粒体活性氧自由基浓度。在腹腔巨噬细胞和Caco-2细胞中,线粒体活性氧自由基造成的红色荧光强度存在较大差异,腹腔巨噬细胞线粒体活性氧自由基水平相对较高,表现为线粒体超氧化物红色荧光探针(MitoSOX Red)荧光强度高。配方奶粉对胞浆自由基浓度的影响及线粒体活性氧自由基浓度的影响有较好的相关性,胞内自由基清除率最高的1 号和3 号样品对线粒体活性氧自由基的清除能力也为最好,2 号和4 号样品在影响胞内自由基浓度上升的同时也影响线粒体活性氧自由基浓度上升。这样的相关性提示配方奶粉对胞浆自由基浓度的改变是通过影响线粒体氧自由基浓度而实现的。
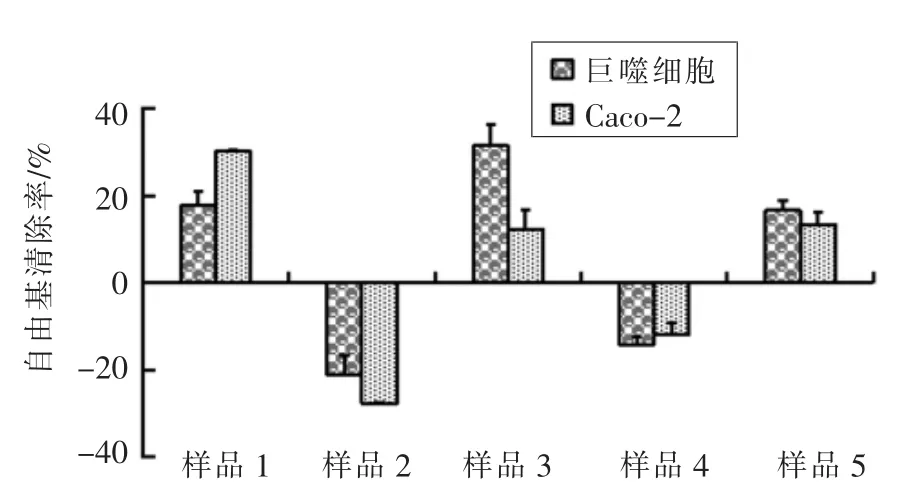
图4 婴幼儿配方奶粉对细胞内自由基的清除率Fig.4 Free radicals scavenging rate within cells by infant formula milk powders

图5 婴幼儿配方奶粉对线粒体内荧光强度的影响Fig.5 Effects of infant formula milk powders on fluorescence intensity in mitochondria

图6 婴幼儿配方奶粉对腹腔巨噬细胞线粒体内自由基影响Fig.6 Effects of infant formula milk powders on free radicals in mitochondria of peritoneal macrophage

图7 婴幼儿配方奶粉对Caco-2 细胞线粒体内自由基影响Fig.7 Effects of infant formula milk powders on free radicals in mitochondria of Caco-2 cells
3 结论与讨论
CAA 法测抗氧化能力与其它化学分析法相比具有更高的生物相关性,试验结果更具有理论说服力和应用价值[7]。研究者对CAA 法进行不断的调整和改进,使其与受测样品在体内表现出的生理活性更匹配。1999年,Wang 等[8]使用H2O2诱导的PC12 细胞氧化应激的CAA 模型评价黄酮类化合物的抗氧化作用,后继报道的CAA 模型中诱导剂由H2O2改为AAPH,PC12 细胞被改为HepG2和Caco-2 细胞[8,21-22]。方法改进的目的不仅在于获得更稳定的结果,还在于能更好地反应受测样品的特性和生理活性。
婴幼儿时期摄入的母乳或配方奶粉不仅需促进婴幼儿消化道黏膜系统(包括吸收和免疫功能)的完善,还需进行体内氧化-还原平衡的调节。本研究中选择Caco-2 为细胞模型的原因在于:它具有肠细胞样特征,常被用作肠上皮细胞的吸收模型,配方奶粉作用于Caco-2 细胞,表现出胞内抗氧化活性,可能与婴幼儿消化道黏膜吸收功能相关联。另外,消化道黏膜不仅是营养成分吸收的界面,也是对外来颗粒物质吞噬和处理的界面。有研究显示,食品中胶体颗粒可以通过与免疫细胞直接作用的方式,调节消化道黏膜免疫系统的氧化应激水平[23]。奶制品富含胶体颗粒的事实众所周知,它和消化道黏膜免疫系统的作用是必然的,这是本研究中选择巨噬细胞作为模型的原因,以期能探明配方奶粉对消化道黏膜免疫系统氧化应激水平的调节。
本研究随机选取5 种市售一段婴幼儿配方奶粉,在2 种细胞的CAA 模型中进行胞内抗氧化性的测试,结果表明,5 种配方奶粉在2 种细胞的CAA 模型中均表现出胞内抗氧化活性,说明这5种配方奶粉均能促进婴幼儿消化道黏膜吸收和免疫功能的完善。CAA 值的差异较为明显,说明不同配方及加工工艺的配方奶粉的胞内抗氧化能力的存在差异性。
同时,本研究调查了配方奶粉对2 种细胞的胞浆及线粒体内自由基浓度的调整能力。结果显示,依照自由基浓度的调控方向,5 种配方奶粉可分为下调和上调自由基浓度2 种类型。其中,1号、3 号和5 号样品对胞内自由基和线粒体活性氧自由基均表现出明确的清除效果,而2 号及4号样品明显升高了胞内自由基和线粒体活性氧自由基浓度。
2 号和4 号样品在CAA 模型中的胞内抗氧化活性与胞浆及线粒体自由基清除能力数据的差异,可能是不同氧化应激状态下细胞对抗氧化物质的响应程度不同所致。CAA 模型中通过加入外源性氧化剂AAPH 来提高胞内自由基浓度[24],体现在较高的氧化应激状态下配方奶粉的胞内抗氧化作用,而不加AAPH 的细胞模型更好地体现了在较低的氧化应激状态下对胞内自由基水平的调节作用。这也提示CAA 模型的调整因素除了细胞类型、外源诱导剂类型外,外源诱导剂浓度或细胞内的自由基浓度也应考虑在内。
诞生是从母体分离的过程,意味着婴儿开始暴露于较高水平的氧化应激环境中。在自身氧化-还原系统完善之前,婴幼儿体内的氧化应激很大程度上只能依赖于摄入的母乳或者婴幼儿配方奶粉进行调节[11]。在较高的氧化应激水平下,摄入的母乳或配方奶粉具有一定的抗氧化能力,然而在尚未能达到平衡所需最低剂量时,体内仍表现为氧化应激状态。从胞内抗氧化结果来看,无论在较高或较低的氧化应激水平,胞内抗氧化活性不同的配方奶粉有可能产生截然不同的调节效果。
不同婴幼儿配方奶粉的胞内抗氧化能力的差异或许可以给我国消费者人群中出现的“上火”症状提供些许解释。有研究认为“上火”是机体受到应激因素刺激引起的一种维持机体内环境的适应性反应[25]。这种由于不同应激原引起的体内环境制约过程与抗氧化平衡状态有一定相关性[26]。氧化应激与炎症是密切相关的生理过程,两者往往相互促进加剧[27]。然而,配方奶粉胞内抗氧化能力表现不佳,不能直接等同于可能引起体内的轻微炎症反应,还需进一步用细胞或动物的炎症模型判定。
奶粉“上火”的机制尚未明确,有研究认为奶粉喷雾干燥过程中,营养物质破坏、结合水丧失,造成肠道黏膜受损,从而引起“上火”症状[28]。也有研究认为,这是由于奶粉加工过程中产生的美拉德反应产物引起肠道炎症[29]。无论如何,婴幼儿配方奶粉使用过程中被认知为“上火”的不良反应确实存在,应引起产业界的重视。在探明奶粉“上火”内在机制之前,需建立一套完善的抗氧化模型对奶粉的抗氧化能力进行评估。贴近真实生理环境且全面的抗氧化模型对未来奶粉配方和加工工艺的调整都具有指导意义。
