樱桃番茄果脯加工糖煮液中果胶和微颗粒对其流变特性的影响
2021-03-06姚舒婷周声怡吴文艳刘东红叶兴乾
程 焕,姚舒婷,周声怡,吴文艳,刘东红,叶兴乾*
(1 浙江大学生物系统工程与食品科学学院 智能食品加工技术与装备国家地方联合工程实验室浙江省农产品加工技术研究重点实验室 馥莉食品研究院 杭州310058 2 浙江大学宁波研究院 浙江宁波315100)
樱桃番茄果实酸甜可口,风味独特,富含番茄红素和多酚类物质,具有很高的抗氧化活性[1-2]。樱桃番茄果脯是我国传统食品,深受大众喜欢。樱桃番茄果脯糖煮液在多轮循环渗糖过程中,果实中胶体物质、悬浮纤维微粒等物质逐渐渗出到糖煮液中,使之变成黏稠、浑浊且难以过滤的深色糖液,因其黏度高,无法继续用于渗糖工艺而被废弃。以年产500 t 的果脯厂为例,每年至少产生50~150 t 高浓度渗糖废水,造成资源浪费的同时也给环境带来巨大负担[3]。对废糖液降黏处理再利用成为一个亟待解决的问题。
目前果脯加工废糖液回用处理方法主要有酶处理、澄清剂处理和过滤等。肖春玲等[4]研究通过明胶单宁法处理樱桃番茄果脯糖煮液。陈洁兰等[5]通过果胶酶处理甘薯果脯废糖液,用于循环渗糖。已有研究认为糖煮液的黏度主要来源于果胶等胶体物质、悬浮果肉屑及纤维颗粒等,然而尚未进行验证。相关研究表明,有果肉颗粒悬浮且含有可溶性果胶、多糖等物质的果汁、果酱,其流变特性由悬浮颗粒的特性、浓度和液体的性质决定[6-9]。番茄酱的黏稠度主要由果胶和干物质含量决定[10]。目前尚缺乏对樱桃番茄果脯糖煮液黏度成因的系统研究。本文对樱桃番茄果脯糖煮液成分、流变特性及黏度成因进行了研究,为果脯加工废糖液的循环利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜樱桃番茄购于云南元谋;白砂糖为市售1 级。樱桃番茄果脯糖煮液,浙江大学实验室。无水乙醇、咔唑、磷酸、考马斯亮蓝G-250 等均为分析纯试剂;浓硫酸为优级纯试剂;果胶酶(10 万U/g)为食品级。
1.2 仪器与设备
阿贝折光仪,上海光学仪器工厂;1510 全波长酶标仪,美国Thermo Fisher 公司;S210pH 计,梅特勒-托利多仪器(上海)有限公司;MS105 DU电子天平,瑞士Mettler Toledo 公司;MCR302 旋转流变仪,奥地利安东帕;Beckman Coulter LS13320 激光粒度仪,美国Beckman Coulter;磁力搅拌水浴锅,常州金坛良友仪器有限公司;Hitachi(日立)高速低温冷冻离心机,HITACHI日立集团;RE52-AAA 型旋转蒸发仪,上海亚荣生化仪器厂。
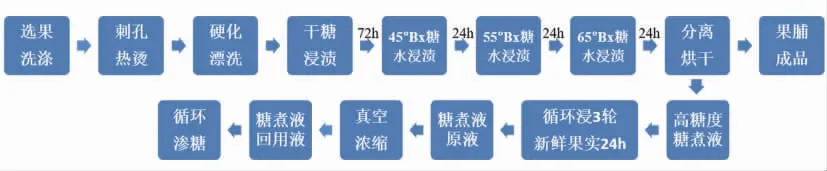
图1 樱桃番茄果脯的加工流程Fig.1 The production process of preserved cherry tomato
1.3 试验方法
1.3.1 樱桃番茄果脯糖煮液原液和回用液的制备
按图1所示樱桃番茄果脯加工流程生产果脯,得到高糖度糖煮液(约60°Bx),腌渍3 轮新鲜的樱桃番茄,每轮腌渍24 h,得到糖煮液原液(约27 °Bx),经真空浓缩得到糖煮液回用液(约50°Bx)。加工关键点如下:
1)干糖腌渍 白砂糖与鲜果的质量比为2:5,一层一层交错腌渍,浸糖时间24 h。
2)45°Bx 糖水腌渍 加入0.5%的柠檬酸和0.03%的焦亚硫酸钠,将糖煮液加热并调整至45°Bx 糖度,与鲜果的质量比为1∶1,再把鲜果放入糖煮液中,浸糖24 h。
3)55°Bx 糖水腌渍 将樱桃番茄与糖煮液分离,将糖煮液加热并调整至55°Bx 糖度,将鲜果放入糖煮液中,浸糖24 h。
4)65°Bx 糖水腌渍 将樱桃番茄与糖煮液分离,将糖煮液加热并调整至65°Bx 糖度,把鲜果放入糖煮液中,浸糖24 h。
5)循环浸3 轮新鲜果实24 h 将新鲜樱桃番茄经刺孔热烫和硬化漂洗后与高糖度糖煮液以质量比1∶1 混合,浸糖24 h,重复3 次。
6)真空浓缩 糖煮液原液在70 ℃下真空浓缩去除约50%体积的水分。
1.3.2 樱桃番茄果脯糖煮液上清液和沉淀的制备
将糖煮液在4 ℃,8 000×g 转速下离心15 min,分离得到上清液和微颗粒物质。
1.3.3 果胶酶溶液的制备及酶处理 准确称取1.8 g 果胶酶,加入30 mL 40~50 ℃蒸馏水溶解,配成6%的果胶酶溶液。取4 份40 mL 樱桃番茄果脯糖煮液,分别加入0.05‰,0.20‰,0.60‰和0.80‰果胶酶在45 ℃下酶反应10 h。
1.3.4 糖煮液理化指标测定 可溶固形物含量:采用阿贝折光仪测定;pH 值:采用pH 计测定;浊度:采用浊度仪进行测定;水溶性蛋白质含量:采用考马斯亮蓝法测定[11];果胶:采用咔唑分光光度法测定[12];沉淀干重含量:先将糖煮液离心得到微颗粒,后采用重量法;粗纤维:根据GB/T5009.10-2003《植物类食品中粗纤维的测定》测定。
1.3.5 糖煮液的流变分析 流变学测定采用德国HAAKE 公司RS6000 旋转流变仪。
频率扫描:在温度25 ℃,扫描应力1%,频率扫描范围0.1~100 Hz 条件下检测糖煮液的G′和G″。
流变曲线:在25 ℃下,剪切速率2~300 s-1范围,用同轴圆筒系统测定糖煮液黏度随剪切速率的变化[13],根据幂律公式和Ostwald's 模型拟合流变曲线并对结果进行分析。

式中:η——黏度,Pa·s;K——稠度系数,Pa·sn;γ——剪切速率,s-1;n——流变指数,表征偏离牛顿流体程度的指数。
1.3.6 粒径测定 在25 ℃下,用激光粒度仪测定糖煮液的粒径分布情况,粒径范围0.04~2000 μm,分散介质的折光率为1.333,吸收率为0。吸取稀释一定倍数的糖煮液样品,将其置于样品池中,采用动态光散射法测定糖煮液的粒径[14]。
1.3.7 光学显微分析 采用具有拍摄功能的光学显微镜观察糖煮液的微观结构,选择100 倍目镜。
1.3.8 数据处理 每组试验重复3 次,结果以平均值±标准偏差表示。使用SPSS 17.0 软件进行数据分析,采用OriginPro 7.5 软件制图。
2 结果与分析
2.1 理化指标分析
在生产上,一般将糖煮液原液在70 ℃条件下真空浓缩,去除约50%体积的水分,得到糖煮液回用液用于回腌果脯,其理化特性如表1所示。糖煮液原液经离心得到的原-上清液和糖煮液原液在可溶性固形物和pH 值方面没有显著差异,而在浊度上存在显著差异(P<0.05),微颗粒使糖煮液的浊度从7.72 增至966.67。糖煮液原液和糖煮液回用液的浊度存在显著差异(P<0.05),而糖煮液原液-上清液和糖煮液回用液-上清液的浊度没有显著差异,说明微颗粒是糖煮液浊度产生差异的主要原因。糖煮液原液经真空浓缩1 倍成糖煮液回用液后,糖煮液的可溶性固形物含量、浊度、蛋白质含量、果胶含量和沉淀干重都显著增加,pH值下降。真空浓缩处理对可溶性果胶的影响并不大,结果与Anthon 等[15]对番茄酱的相关研究一致。根据叶小平[16]的报道,樱桃番茄中的可溶性果胶为0.08%~0.18%,而糖煮液上清液中的果胶含量为0.005‰~0.009‰,显著低于樱桃番茄中果胶含量。

表1 樱桃番茄果脯糖煮液的理化指标Table 1 General physical/ chemical properties of sugar cooking liquid from preserved cherry tomato
2.2 糖煮液流变特性分析
如图2所示,在频率0.01~100 Hz 范围,糖煮液原液和糖煮液回用液的弹性模量G′均大于黏性模量G″,糖煮液原液和糖煮液回用液均呈现类固体状态,表明溶液中存在类凝胶结构[17]。糖煮液回用液的弹性模量和黏性模量均大于糖煮液原液,说明浓缩使糖煮液的类固体性质加强,这可能与糖煮液回用液单位体积内微颗粒的数量、形状和分布等发生变化有关[18]。
将糖煮液原液和回用液分别离心得到相应的上清液,在25 ℃,剪切速率2~300 s-1范围测定相应的流变曲线(图3)。在整个剪切速率范围,糖煮液黏度随剪切速率的增大而变小,表现为一种剪切变稀行为,为非牛顿流体,且剪切变稀行为随着浓度的增大变得更加显著。这主要由糖煮液中的可溶性糖、果胶、悬浮物颗粒等之间的相互作用导致的[19]。然而,在剪切速率大于25 s-1后,上清液黏度不再发生变化,表现出牛顿流体特性。
利用OriginPro 7.5 软件对糖煮液原液和回用液曲线进行Ostwald's 模型拟合,得到相关流变参数见表2。其中n 为流变指数,K 为稠度系数。从表2 可以看出,糖煮液原液的K=0.0049,糖煮液回用液的K=0.067,由此可知稠度系数K 随糖煮液浓度的增加而显著上升,表观黏度也随之增大。这可能是由于浓缩使糖煮液中的水分减少,加强了果胶、蛋白等可溶物和固体微颗粒等之间的相互作用,形成致密网状结构,增加表观黏度[20]。糖煮液原液的非牛顿指数n=0.938,糖煮液回用液的非牛顿指数n=0.785,两者的n 值均小于1,表明在试验的剪切速率范围(2~300 s-1)内,糖煮液属于假塑性流体[21]。糖煮液原液的流动行为更接近于理想状态的牛顿流体,而糖煮液回用液的表观黏度更大,剪切变稀行为更为明显。
2.3 糖煮液中果胶对流变特性的影响
樱桃番茄果脯加工时,糖煮液在多次循环利用过程中,樱桃番茄的可溶性果胶及果胶酸等胶体物质逐渐渗出至糖煮液中。以上果胶等物质的聚集可能是造成糖煮液的高黏度,导致其不能再次渗糖的主要原因。而本试验中经多轮渗糖工艺加工得到的糖煮液原液和回用液上清液中的果胶含量分别为0.005‰和0.009‰,低于樱桃番茄中果胶含量的百分之一。糖煮液原液经不同浓度的果胶酶酶解后的流变变化如图4所示,在剪切速率100 s-1时,糖煮液原液、原-上清液、0.05‰果胶酶处理、0.20‰果胶酶处理、0.60‰果胶酶处理和0.80‰果胶酶处理的表观黏度分别为3.43,2.42,3.49,3.42,3.35 mPa·s 和3.39 mPa·s。通过果胶酶处理,糖煮液原液黏度最多可降低2%,说明糖煮液中的可溶性果胶并不是造成糖煮液高黏度的主要原因。

图2 糖煮液的黏弹性频率扫描曲线Fig.2 Frequency scanning curves of viscoelasticity of sugar cooking liquid

图3 糖煮液原液和回用液及其上清液的流变变化Fig.3 The rheological changes of original and reusable sugar cooking liquid and their serum

表2 糖煮液原液和回用液的Ostwald's 模型及参数Table 2 The Ostwald's model-parameters of original and usable sugar cooking liquid
2.4 糖煮液中微颗粒对流变特性的影响
如图3所示,糖煮液原液和原-上清液在100 s-1剪切速率下的表观黏度分别为0.003 Pa·s和0.002 Pa·s,糖煮液原液去除微颗粒后黏度下降了33%。糖煮液回用液的表观黏度为0.024 Pa·s,而回用-上清液的表观黏度为0.01 Pa·s,说明糖煮液回用液去除微颗粒后黏度下降了58%。由此可见,糖煮液中的微颗粒在低浓度时对糖煮液的黏度贡献较小,而在高浓度时对糖煮液的黏度贡献大。在类似于糖煮液的体系中,微颗粒的浓度是影响黏度的主要因素,浓缩可减小物质间的间距,使微颗粒等发生形变,加强了物质间的相互作用,使表观黏度显著增加[22]。
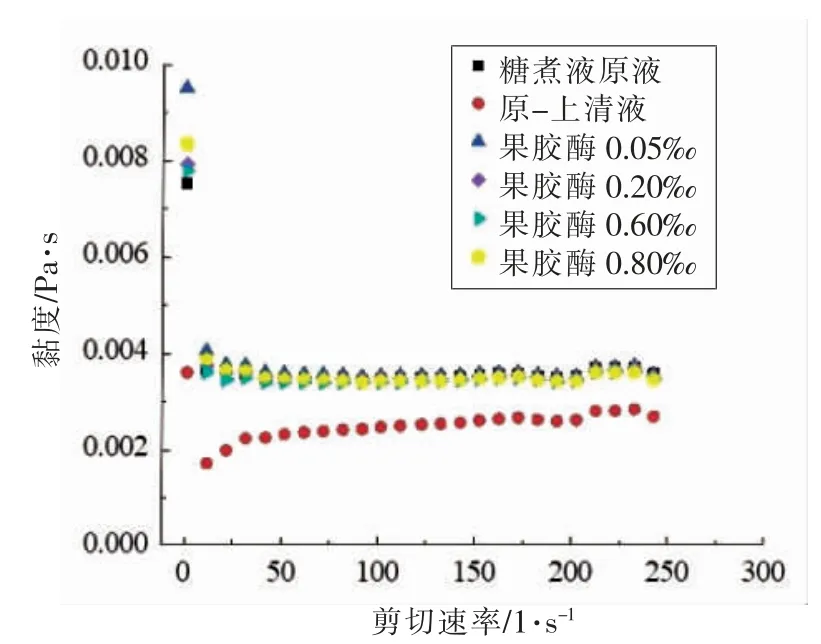
图4 不同浓度果胶酶处理后的糖煮液流变特性变化Fig.4 The rheological changes of sugar cooking liquid treated with pectinase of different concentrations
将同等体积的糖煮液原液和回用液离心得到的微颗粒沉淀组分对换,测定糖煮液流变特性的变化。如图5所示,糖煮液原液中的沉淀被换成回用液的沉淀后,在整个剪切速率范围(2~300 s-1),糖煮液的表观黏度随着剪切速率的增大而变小,稠度系数K 从0.0049 增至0.0218,流变指数n 从0.938 减至0.718,剪切变稀行为变得更加显著。在100 s-1剪切速率下,糖煮液的表观黏度从0.003 Pa·s 增至0.005 Pa·s,增加约67%。而将糖煮液回用液中的沉淀换成糖煮液原液的沉淀后,稠度系数K 从0.067 减至0.0263,流变指数n 从0.785 增至0.879,糖煮液回用液仍表现为剪切变稀,而回用液的表观黏度从0.024 Pa·s 降至0.015 Pa·s,黏度降低了约38%。
由此可见,糖煮液经浓缩,糖煮液中的微颗粒对流变的作用显著增加,即回用液微颗粒沉淀物在回用液中的黏度贡献高于原液微颗粒沉淀物在其体系中的黏度贡献。虽然上清液和微颗粒对糖煮液的黏度都有影响[23-25],但是微颗粒在高浓度条件下对糖煮液的黏度贡献高于上清液。糖煮液中的微颗粒是糖煮液剪切变稀,成为假塑性流体的主要原因。本研究结果与Tanglertpaibul 等[26]对番茄浓缩汁上清液和微颗粒对流变影响的研究结果一致。

图5 糖煮液原液和糖煮液回用液沉淀对换前、后的流变Fig.5 Viscosity measurement of original and reusable sugar cooking liquid with exchanged pulp
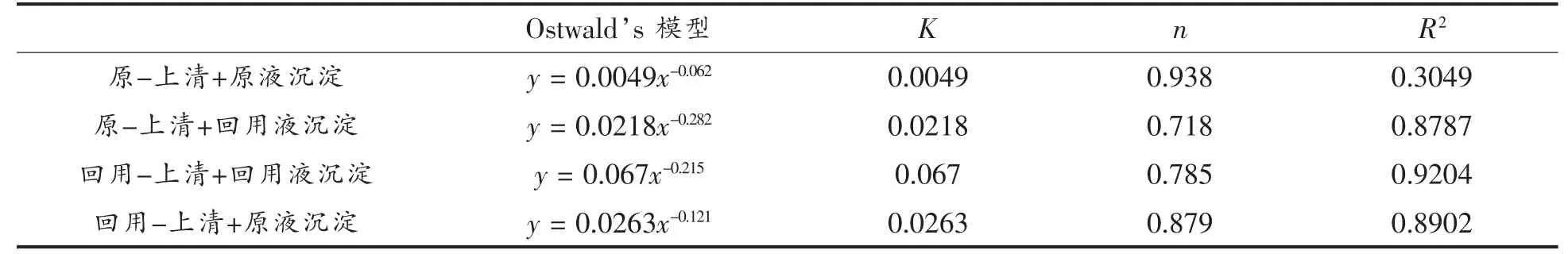
表3 糖煮液原液和糖煮液回用液沉淀对换前、后的Ostwald's 模型及参数Table 3 The Ostwald's model-parameters of original and reusable sugar cooking liquid with exchanged pulp
2.5 微颗粒成分及其水提物对糖煮液流变特性的影响
2.5.1 微颗粒成分分析 将糖煮液原液和糖煮液回用液分别离心得到相应的微颗粒沉淀物。如表4所示,糖煮液原液中的微颗粒含量为0.21%,而糖煮液回用液中的微颗粒含量为0.65%,可能是浓缩处理增加了微颗粒与可溶性糖等的相互作用,导致离心后的微颗粒沉淀中含有部分可溶性糖。微颗粒主要由植物细胞、植物细胞碎片和植物细胞聚集物组成[27]。原液微颗粒中含有12.312%的蛋白质,24.545%的粗纤维和0.269%的果胶,回用液微颗粒中含有6.389%的蛋白质,17.142%的粗纤维和0.196%的果胶。

表4 糖煮液微颗粒的理化分析Table 4 General physical/ chemical properties of pulp of sugar cooking liquid
2.5.2 粒径和光学显微分析 如图6所示,糖煮液原液和回用液的粒径分布图主要由2 个主峰组成:第1 个峰大约位于0.1~80 μm 范围,第2 个峰大约位于80~500 μm 范围。糖煮液原液的粒径分布中有2 个峰,80~500 μm 峰面积大于0.1~80 μm 峰面积,离心后得到的原-上清液粒径分布在0.1~80 μm 范围,说明糖煮液中可溶性物质粒径分布在0.1~80 μm 范围,微颗粒粒径主要分布在80~500 μm 范围。糖煮液经浓缩得到糖煮液回用液,其粒径分布于2 个峰中,与糖煮液原液的粒径分布相比,糖煮液回用液的0.1~80 μm 峰面积减小,80~500 μm 峰面积增大,说明浓缩使单位体积糖煮液中的微颗粒增多,且其中的可溶性糖、果胶、悬浮物颗粒等之间的相互作用加强,形成更加大粒径的颗粒。如图7所示,在100 倍光学显微镜下,糖煮液原液中的颗粒呈单个分散分布,而糖煮液回用液中的颗粒聚集成团,与糖煮液原液相比,微颗粒粒径变大,大粒径颗粒物变多,与粒径分析的结果相一致,可能是由于糖煮液回用液中的微颗粒、果胶、可溶性糖等物质相互作用,聚集缠绕,形成了不可逆的致密网络[28]。
2.5.3 微颗粒水提物对糖煮液流变特性的影响糖煮液原液微颗粒中含有12.312%的蛋白质和0.269%的果胶,亲水性的蛋白质和果胶是微颗粒与糖煮液中水溶性物质相互作用的中间介质。将糖煮液原液微颗粒经多次低温水提去除果胶、蛋白等水提物后又复溶至原糖煮液上清液中,测定其流变特性,结果如图8所示。复溶的糖煮液原液、糖煮液原液和原-上清液在100 s-1剪切速率下的表观黏度分别为0.0029,0.0034 Pa·s 和0.0024 Pa·s,去除水提物使微颗粒对糖煮液原液的黏度贡献降低了约50%,说明果胶、蛋白等微颗粒水提物对糖煮液流变特性有重要作用,可通过影响微颗粒与水溶液中物质的相互作用而影响糖煮液的流变特性。
3 结论
樱桃番茄果脯加工过程中的糖煮液原液和糖煮液回用液均呈类固体状态,表现出剪切变稀的非牛顿流体特性。在100 s-1剪切速率下,糖煮液回用液的表观黏度是糖煮液原液的8 倍,这可能由于在糖煮液回用液中,单位体积的微颗粒数量更多且粒径更大,物质间距减小,易发生形变,果胶、蛋白等可溶物和微颗粒等之间的相互作用加强,聚集缠绕,形成了致密的网状结构,因此黏度显著增大,不利于再次糖渍。糖煮液原液和回用液的上清液中的果胶含量极低,原液经果胶酶处理后黏度仅降低2%,进一步说明糖煮液中的可溶性果胶并不是造成糖煮液黏度高的主要原因。而原液和回用液中的微颗粒对糖煮液黏度有显著影响,去除微颗粒后,糖煮液原液和回用液的黏度分别降低了33%和58%,且表现出牛顿流体的特性,说明糖煮液中的微颗粒是造成糖煮液黏度高的主要原因。进一步研究发现,微颗粒中果胶、蛋白等水提物对糖煮液流变的影响很大。去除果胶、蛋白等水提物后,微颗粒对糖煮液的黏度贡献降低了约50%,说明果胶、蛋白等水提物可能在上清液水溶物与微颗粒相互作用形成致密网络的过程中发挥重要作用。
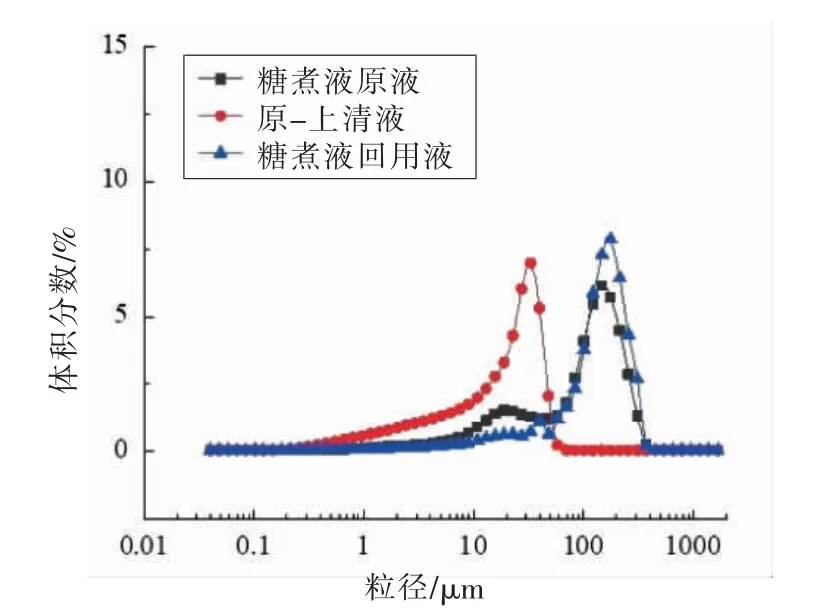
图6 糖煮液原液和糖煮液回用液的粒径分布Fig.6 The particle diameter distribution of original and usable sugar cooking liquid

图7 糖煮液原液(a)和糖煮液回用液(b)的显微镜结构图(100×)Fig.7 Structure of optical microscope of original(a)and usable(b)sugar cooking liquid(100×)

图8 微颗粒水提物对糖煮液流变的影响Fig.8 Effect of water extract of pulp on the flow behavior of sugar cooking liquid
