全小米膳食干预对轻度高血压患者肠道菌群的影响
2021-03-06侯殿志
侯殿志,陈 静,沈 群
(中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083)
目前,高血压已成为全球公共的健康问题,其不仅是心血管疾病和中风的最关键的风险因子,而且与肥胖、糖尿病及代谢综合征密切相关。高血压的病因是基因、代谢和环境相互作用的累积结果,遗传因素和饮食都与其发病有关,并且迄今尚未阐明其发病机制[1]。肠道菌群是与宿主共生的多样的微生物生态系统,其在多种生理过程的调节中起作用,且宿主的健康状况与肠道菌群关系密切。近几十年来,新的证据也不断表明肠道微菌群与各种疾病之间存在着密切的联系,包括2 型糖尿病[2],动脉粥样硬化[3],结肠直肠癌[4]和肝硬化[5]等。对高血压患者的肠道微生物组成分析显示,与正常血压受试者相比,高血压患者肠道菌群的丰度降低,组成结构发生变化,提示肠道微生态失衡与人类高血压相关[6]。另外,血压的内稳态维持是一个复杂的过程,由肾脏控制,并受遗传、环境和内分泌等因素的调节。最近的研究表明,微生物组主要通过分泌各种生物活性代谢物,如短链脂肪酸(SCFA),参与血压的调节[7]。
全谷物含有丰富的维生素、矿物质、植物化学物质和其它营养素,已被证明可有效控制血压的升高。在一项针对全谷物消费对心血管疾病影响的研究中,超重和肥胖成人每天摄入100 g 全谷物16 周后,受试者舒张压显著降低了5.8 mmHg[8]。鉴于最近的研究表明肠道菌群在高血压调控中发挥着中重要作用,在全谷物对健康有益的背景下考虑肠道微生物的影响是非常有必要的。小米作为一种全谷物,具有降糖[9]、抗癌[10]等功效。本实验室先前开展的人群试验已表明全小米膳食干预12周后,轻度高血压受试者的舒张压和收缩压分别降低了3.49 mmHg 和4.13 mmHg[11]。然而,小米是否会对轻度高血压患者的肠道菌群产生影响仍不清楚。本研究的主要目的是分析全小米膳食对轻度高血压受试者肠道菌群结构、组成和短链脂肪酸产生菌情况的影响。
1 材料和方法
1.1 材料与试剂
东方亮小米,购于山西东方物华农业科技有限责任公司。
QIAquickRPCR 产物纯化试剂盒,德国QIAGEN 公司。
1.2 仪器与设备
双螺杆挤压SLG30-IV,中国济南赛百诺科技开发有限公司;MIseq 测序仪,美国Illumina 公司;96 孔DNA 提取试剂盒,美国MoBio 公司;One-Drop OD-1000+分光光度计,南京五义科技有限公司;电泳槽DYY-6B 和电泳仪DYC-280,北京六一仪器厂;GoTaqRHot Start Colorless Master Mix,美国Promega 公司。
1.3 方法
1.3.1 小米主食样品的制备 为改善小米的质构和风味,将小米粉进行挤压处理。挤压小米粉处理条件为:小米粉水分含量16%,双螺杆挤压机挤压腔四区温度分别为:Ⅰ区60 ℃、Ⅱ区90 ℃、Ⅲ区120 ℃、Ⅳ区175 ℃,螺杆转速280 r/min。挤压后所有样品均粉碎,过80 目筛(0.15 mm),得到本试验所需挤压小米粉样品,存放于-80 ℃冰箱中备用。
本试验所采用的全小米食品形式为本实验室研制的全小米馒头和饼,其中小米生粉和小米挤压粉的含量比例为3∶1。全小米馒头和饼的制备参考Hou 等[11]的方法。
1.3.2 研究对象 受试者包括一般健康的40~65岁轻度高血压患者(根据世界卫生组织国际高血压学会指南,130 mmHg ≤SBP ≤139 mmHg,80 mmHg≤SDP≤89 mmHg),接受两次筛选访问。排除标准包括:使用抗高血压药物;冠状动脉疾病、糖尿病或其它慢性疾病的病史;已知影响血压的激素或药物的使用;膳食补充剂的使用。过去3 个月内,体重指数BMI≥35 kg/m2,空腹甘油三酯≥500 mg/dL,空腹血糖≥126 mg/dL,促甲状腺激素浓度异常。所有参与者都签署了书面知情同意书。经过一系列临床筛选及后续12 周的膳食干预后,最终45 名参与者全部完成了膳食干预及生理指标检测,其中,男性17 人,女性28 人。
这项研究得到了北京大学生物医学伦理学委员会的批准(IRB00001052-14034)。临床试验注册号:ChiCTR-OON-16008603。
1.3.3 试验设计及膳食干预 由于很难找到一种安慰剂的口感和颜色与全小米馒头和饼相似,因此,采用12 周的开放标签和自我对照的试验形式进行膳食干预。本试验除每天接受等量的全小米产品外,无其它膳食或生活方式建议。
根据《中国居民膳食指南》(2016年),参与者在干预期间每天获得含50 g 纯小米制作的馒头或饼作为部分主食的替代品。此外,为了确保纯小米产品的及时定量摄入,参与者应每周与研究人员会面,在收到下次全小米产品之前,回收上一次的产品包装袋。参与者在基线(0 周)和试验完成(末期12 周)后接受统一的临床和实验室测量。
1.3.4 便样收集 粪便样本由受检人自行采集,为避免尿液的干扰,保证样品未受到污染,为每位受检人提供一套粪便收集器、收集管和收集操作说明。测微生物菌群的收集管采用德国Invitek 公司生产的PSP 管,该管内含粪便稳定液,可常温保存至少3 d,不仅可保证粪便内微生物无增殖现象,而且无需低温冷冻运输。粪便样本至少各取花生粒大小,运送到实验室称重后,将样品管保存至-80 ℃冰箱待检。
1.3.5 肠道菌群分析 肠道菌群检测委托天益健康科学研究院(镇江)有限公司(中国江苏镇江),使用MIseq 测序仪(美国Illumina 公司)检测。
1)DNA 提取和鉴定 选用美国MoBio 公司96 孔DNA 提取试剂盒提取样本的基因组DNA,之后采用Onedrop 仪器和1%琼脂糖凝胶电泳检测DNA 的纯度和浓度。取适量样品于离心管中,用无菌水稀释样品至质量浓度0.5 ng/μL。抽提基因组DNA 需达到以下标准:总量≥2 ng,纯度260/280≥1.8 和260/230≥1。
2)PCR 扩增 以稀释后的基因组DNA 为模板,根据测序区域的选择,使用带Barcode 的特异引物以及美国Promega 公司的GoTaqRHot Start Colorless Master Mix 进行聚合酶链式反应(Polymerase Chain Reaction,PCR),确保扩增准确性和效率。
3)PCR 产物的混样和纯化 使用2%琼脂糖凝胶检测PCR 产物;将各PCR 产物等浓度混样,充分混匀后上电泳检测,其引物对应的区域为:16S V4 区引物为515F-806R。PCR 产物使用QIAGEN 公司的QIAquickRPCR 产物纯化试剂盒纯化回收产物。
4)文库构建和上机测序 使用Pico Green荧光定量以及Agilent 2200 TapeStation 电泳工作平台检测,合格后使用MiSeq 上机测序。
5)测序数据处理 采用Illumina MiSeq 测序平台得到的下机数据存在一些可能会干扰分析结果的低质量数据,因此需先做数据预处理,具体方法是:对V4 可变区测序后,对高通量测序的原始数据依据Barcode 的信息,将单个样品数据拆分出来,取出引物序列,进行质量控制。通过质量检查的序列,应用Ribosomal Database Project(RDP)Classifier 2.3 进行序列比对(Alignment),确定每条序列的分类等级(界、门、纲、目、科、属、种)。应用Mothur 软件中的Furthest neighbor 方法(http://www.mothur.org/wiki/Cluster)聚类生成可操作分类学单元(Operational taxonomic units,OTU),并按照序列数量生成OTU 丰度谱。任意2 条序列相似度达到97%以上,将这些序列划分为一个OTU。基于OTU 聚类分析结果,可对OTU 进行α 多样性分析。基于分类学信息,可在各分类水平上进行群落结构的统计分析等。
1.4 数据分析
采用SPSS 22.0 统计软件进行数据分析。对所有连续变量进行正态性检验,满足正态性的数据表示为均数±标准差,不满足正态性的数据用中位数和四分位数表示。在干预前、后配对数据比较过程中,正态性连续变量使用配对t 检验,非正态性连续变量采用非常参数检验(Kruskal Wallis 秩和检验或Wilcoxon 秩和检验方法),对2 组及多组间进行统计分析。
2 结果与分析
2.1 基于稀释性曲线的测序深度分析
稀释性曲线可以用来评价测序量是否足够和涵盖了所有菌群类别,并间接反映样品的物种丰度。利用所测16S rDNA 序列中各种已知的OTU的相对比例,计算抽取n 个序列(n≤序列总数)时对应的OTU 数量的期望值,然后根据一组n 值与其相应的期望值作图[12]。当曲线趋于平坦时,即认为测序深度已基本覆盖样品中所有的物种,测序数量足够;反之,则表示存在较多未被测序检测到的物种,继续测序增加数据量,还可能发现更多OTU。由图1 可知,样品序列数量在30 000~40 000时,OTU 增加趋于平缓,继续增加数据量可能并不能有效得到更多的OTU。本次测序有效,样品微生物分析深度足够。
2.2 肠道微生物多样性(α-diversity)分析
2.2.1 Shannon-Wiener 曲线分析 如图2所示,各样品Shannon 值的不同,代表其微生物多样性不同。各样品趋于平衡时的最高值不同,说明各样品间多样性存在差异。除此之外,该曲线还表明样品测序量足够,能够完整反映研究所需生物信息。
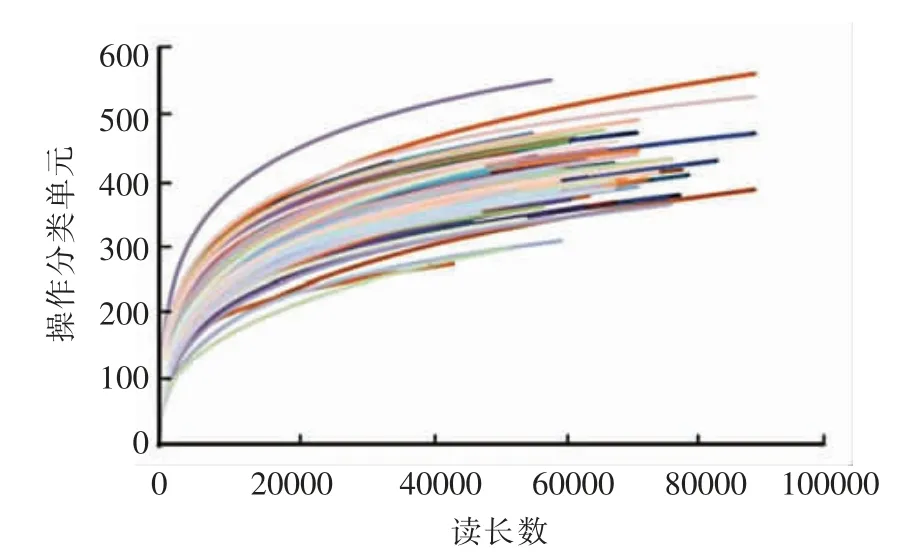
图1 稀释性曲线Fig.1 Rarefaction curves

图2 Shannon-Wiener 曲线Fig.2 Shannon-Wiener curves
2.2.2 微生态多样性指数分析 用4 个生态学参数评价细菌群落的物种丰度(用ACE 指数和Chao1 指数表示)及群落的多样性(用Simpson 指数和Shannon 指数)[13]。其中,ACE 指数用来评估群落中含有OUT 的数量(物种总数),Chao1 指数采用Chao1 算法来估算、评价群落中OUT 的数目;Simpson 指数用来描述群落多样性程度,Simpson 指数越高,微生物群落多样性越低;Shannon指数是用来估算群落多样性和均匀度,Shannon 指数越高,微生物群落的多样性越高。由图3 可知,经12 周的干预,受试者肠道菌群的相对丰度指数(ACE 和Chao1)显著增加,说明全小米膳食可显著改善轻度高血压患者的肠道菌群丰度。而在干预前、后,受试者肠道菌群的Shannon 指数和Simpson 指数没有显著变化,表明其肠道菌群多样性及均匀度没有显著变化。
研究表明,肠道菌群生态失衡与许多慢性疾病相关,包括与心血管系统相关的疾病,例如糖尿病、肥胖症和心脏功能障碍等[14-15]。目前已发表的相关数据显示,与正常对照组相比,高血压人群肠道菌群的丰度(Chao1)降低,Shannon 指数也下降[16]。此外,在另一篇有更多受试者参与的报道中,与对照组相比,高血压受试者肠道菌群的丰度和多样性均显著降低[6]。这说明肠道菌群的生态失衡与高血压之间存在密切的关联。本试验12 周膳食干预结束后,虽然受试者肠道菌群的多样性未发生显著改善,但是从其相对丰度的显著改善上,Cotillard 等[17]发现膳食可显著改善肥胖人群肠道菌群的丰度,且肠道菌群丰度的提高伴随着代谢紊乱的改善。作者推测小米在一定程度上可通过改善肠道菌群的丰度对血压进行调控。
2.2.3 门水平上肠道菌群结构组分分析 在初步了解了小米对轻度高血压受试者肠道菌群的丰度和结构后,进一步分析受试者肠道菌群的种群。通过分析测序结果可知,受试者粪便样本在门水平上获得的所有序列包括19 个菌门,其中以厚壁菌门(Firmicutes)(52.01% )和拟杆菌门(Bacteroidetes)(36.79%)为主,其次是变形菌门(Proteobacteria)(1.85%)和放线菌门(Actinobacteria)(1.63%),这4 种菌门占细菌总数的90%以上(表1)。这与先前报道的成年人群肠道菌群的主要组成是一致的[18]。经12 周的全小米膳食干预后,受试者肠道菌群中厚壁菌门、拟杆菌门、变形菌门和放线菌门的相对丰度并没有统计学上的显著变化(表1)。然而,厚壁菌门相对丰度呈现上升趋势,变形菌门和放线菌门相对丰度则呈下降趋势,拟杆菌门则几乎没有变化。
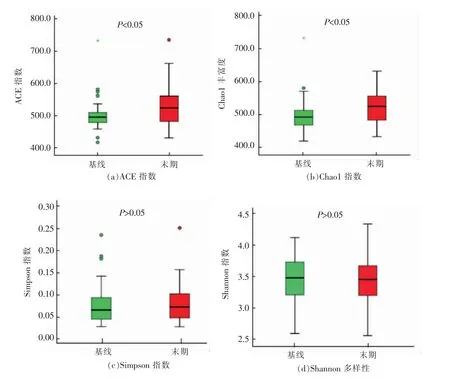
图3 受试者肠道菌群α-多样性指标变化情况Fig.3 Changes in the α-diversity of subjects’ gut microbiota
一般而言,厚壁菌门(F)与拟杆菌门(B)的比率(F/B)被认为与人类肠道菌群组成具有显着相关性,可潜在地用作病理状况的生物标识物,与肥胖、糖尿病和心血管疾病等均存在密切联系[19-20]。本试验中,干预前、后受试者肠道菌群的F/B 比值分别是2.87 和2.93,略有升高,并不显著(图4)。这也与干预前、后这2 个菌门的相对丰度没有显著变化的结果相一致,并且厚壁菌门的上升趋势也导致F/B 比值略有增加。目前,有研究[21]认为肥胖人群肠道菌群中厚壁菌门占优势,厚壁菌门/拟杆菌门比值较高;也有研究[22]认为糖尿病患者肠道菌群中拟杆菌门占优势,而厚壁菌门/拟杆菌门比值较低。关于厚壁菌门/拟杆菌比率对于肥胖和糖尿病的影响仍存争议。另外,Mariat 等[23]发现人类肠道菌群内F/B 比值随年龄而变化,婴儿、成年人和老年人的F/B 比值分别为0.4,10.9 和0.6。由此可见,F/B 受多种因素的影响。就高血压而言,关于人类高血压患者肠道菌群中厚壁菌门与拟杆菌门的比率较正常人群的变化还未见报道。单从全小米膳食引起的F/B 比值的变化对于血压是否有利,还需进一步的试验验证。
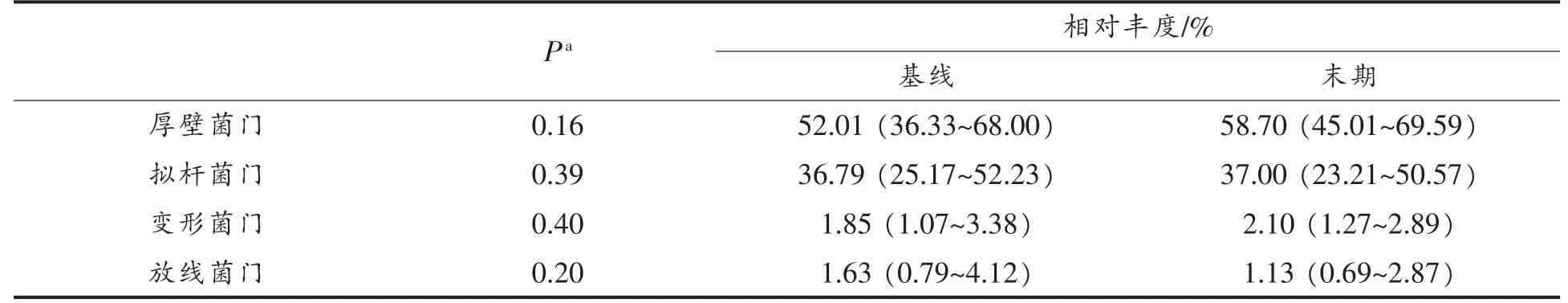
表1 受试者肠道菌群门水平相对丰度变化[M(P25-P75)]Table 1 Changes in the relatively abundance of subjects’ gut microbiota at the phylum level[M(P25-P75)]
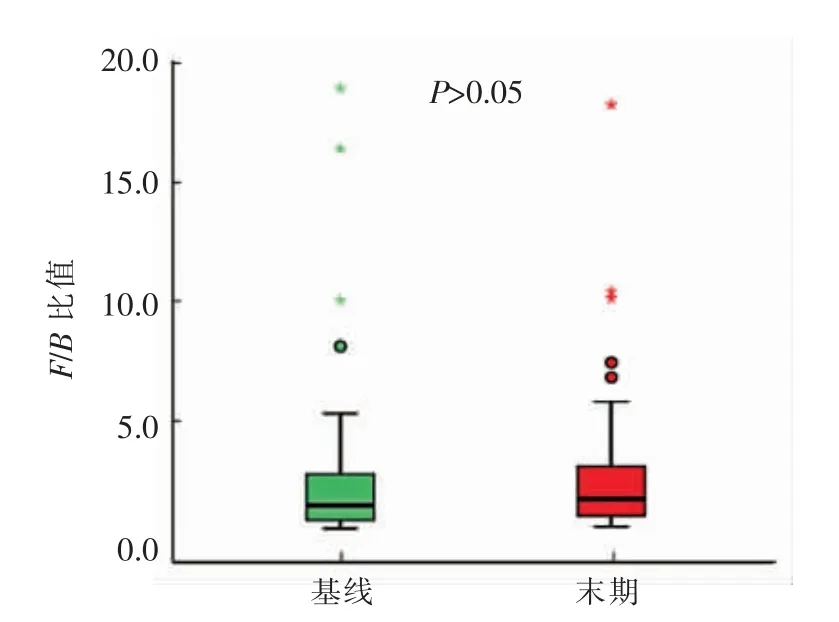
图4 门水平上受试者肠道菌群厚壁菌门和拟杆菌门比例(F/B)变化Fig.4 Changes in Firmicutes/Bacteroidetes ratio(F/B)of subjects’ gut microbiota at the phylum level
2.2.4 属水平上肠道菌群结构组分分析 在属水平上,肠道菌群结构组成的分类更为复杂。图5 显示受试者属水平上的菌群组成结构变化。其中20种菌属占整个肠道菌群的85%以上,主要以拟杆菌属(Bacteroides)、普氏菌属(Prevotella)、柔韧梭菌属(Faecalibacterium)、瘤胃球菌属(Ruminococcus)和假丁酸弧菌属(Pseudobutyrivibrio)等菌属为主。显著性分析表明,全小米膳食干预12 周后,仅柔韧梭菌属和乳杆菌属(Lactobacillus)的相对丰度得到显著提高(P<0.01),说明食用小米主食品可以调节某些菌属的相对丰度(表2)。此外,本试验中,虽然有些菌属未达到统计学显著性,但是也表现出一定趋势。例如,拟杆菌属和假丁酸弧菌属呈现上升趋势,而双歧杆菌属(Bifidobacterium)呈现下降趋势。
王宇[24]比较了6 个属内18 种共计61 株常见发酵乳酸菌发酵脱脂乳后血管紧张素Ⅰ转换酶(ACE)抑制率的大小,结果表明乳杆菌属的ACE抑制活力最强。从这一点来看,全小米膳食干预对于乳杆菌属的显著提升应该有利于受试者血压的降低。另外,刘金宝等[25]通过对新疆哈萨克族正常血压人群和高血压人群肠道菌群种属结构进行对比分析,发现哈萨克族高血压患者肠道菌群中梭菌属的数量较健康人群显著增多,而拟杆菌属明显减少,由此推测拟杆菌属和(或)梭菌属对新疆哈萨克族高血压的发生和发展具有间接的重要影响。但是在本研究中,全小米膳食干预后受试者肠道微生物中拟杆菌属表现出上升趋势,这是与之前的研究结果相一致的。但是,梭菌属却呈现出显著上升,出现差异性的原因可能是梭菌属中有一类为丁酸盐产生菌,该菌被报道[26]在超重和肥胖孕妇肠道菌群中与血压呈负相关。具体有可能是梭菌属中哪种菌种引发血压的变化,还需进一步试验验证。另外,从图6 中发现丁酸盐产生菌呈上升趋势。据此作者推测小米膳食干预有可能是部分提高梭菌属中丁酸盐产生菌的丰度。
另外,双歧杆菌属通常被认为是有益菌。据文献报道,双歧杆菌属在Ⅱ型糖尿病患者中减少7%,在肥胖患者中几乎不存在,并且双歧杆菌属丰度的降低也是生态失调的特征[27]。值得注意的是,经12 周的全小米膳食干预后,受试者体内的双歧杆菌属在一定程度上表现出下降趋势。据文献表明,双歧杆菌在模拟人体结肠环境的情况下,可利用小米纤维作为碳源进行发酵,然而过程比较缓慢[28]。可能由于本试验干预时间的限制,双歧杆菌可能还没显现升高趋势。总的来说,小米膳食干预确实可对轻度高血压受试者肠道菌群中的某些菌属进行调控,从而达到调控血压的目的。
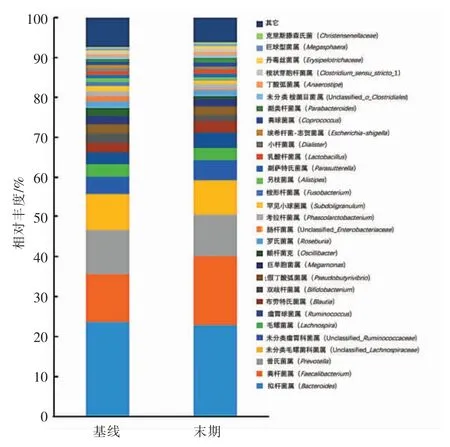
图5 属水平上受试者肠道菌群组成结构变化Fig.5 Changes of gut microbiota composition in subjects at the genus level

表2 属水平上受试者肠道菌群相对丰度的变化[M(P25-P75)]Table 2 Comparison of subjects’ gut microbiota composition at the genus level[M(P25-P75)]
2.3 乙酸盐、丁酸盐和乳酸盐产生菌分析
分析发现,在基线时轻度高血压受试者的乙酸盐产生菌、丁酸盐产生菌和乳酸盐产生菌的相对丰度分别为43.23%,19.94%和3.62%(图6)。由此可见,在人体肠道菌群中,与乳酸盐产生菌相比,乙酸盐产生菌和丁酸盐产生菌相对丰度要高很多。此外,在干预前、后,虽然高血压受试者的肠道菌群中丁酸盐产生菌和乙酸盐产生菌的相对丰度没有显著差异,但是丁酸盐产生菌的相对丰度增加较为明显,比基线时上升了20%(图6)。据相关文献[29]报道,高血压相关肠道菌群生态失调的特征是乳酸盐产生菌的积累及乙酸盐和丁酸盐产生菌的减少。另外,Gomez-Arango 等[26]研究表明,在妊娠16 周的超重和肥胖孕妇肠道菌群中,丁酸盐产生菌和丁酸盐的相对丰度与血压和纤溶酶原激活物抑制剂-1 水平呈显著负相关,提高丁酸盐产生能力可能有助于维持肥胖孕妇的正常血压。从本试验结果可看出,全小米膳食干预引起的丁酸盐产生菌的积累对于轻度高血压受试者血压的降低是非常有利的。
另外,丁酸盐作为关键菌群代谢的短链脂肪酸盐之一,对人体有多种益处。有研究[30]表明,丁酸盐可以改善心血管疾病和Ⅱ型糖尿病人的胰岛素敏感性,并减少肠和脂肪组织中的炎症。据研究报道,SCFA 的降压机制可能是由于肠道菌群产生的SCFA 对血压的调节作用与肾感觉神经有关[31]。这些SCFA 可以激活2 种SCFA 受体:GPR41 和Olfr78。由SCFA 引起入球小动脉中的肾素释放而导致血压升高受到Olfr78 的调节。反过来,这个过程可通过GPR41 的血管扩张作用而受到抑制,从而使血压降低。不过,SCFA 对血压的直接和间接作用仍需进一步证明。
3 结论
本文从膳食的角度出发,证实全小米膳食干预可在一定程度改善轻度高血压受试者的肠道菌群。经12 周的全小米膳食干预后,轻度高血压受试者肠道菌群丰度得到显著提高,可显著调节属水平上柔韧梭菌属和乳杆菌属的相对丰度,且丁酸盐生产菌的相对丰度较基线上升20%。由此可见,采用全小米饮食干预,能够调节肠道菌群组成结构,从而起到预防和治疗高血压的作用,同时也从肠道菌群层面上,为高血压的预防和治疗提供新策略。基于本研究结果,未来还可对高血压受试者肠道菌群的代谢物及特定调控菌进行深入分析和探讨。

图6 受试者肠道菌群中乙酸盐、丁酸盐及乳酸盐产生菌的变化Fig.6 Changes in the relative abundance of acetate-,butyrate- and lactate-producing bacteria in the subjects’ gut microbiota
