磷酸化和糖基化对大豆蛋白体外消化性的影响
2021-03-06刘静媛王睿粲郭顺堂邢霁云杨柏崇
刘静媛,王睿粲,吕 莹*,郭顺堂,邢霁云,杨柏崇
(1 食品质量与安全北京市实验室 北京102206 2 北京农学院食品科学与工程学院 北京102206 3 中国农业大学食品科学与营养工程学院 北京100083 4 谱尼测试集团股份有限公司 北京100194)
大豆蛋白是食品加工领域一种重要的蛋白质,具有良好的溶解性、乳化性和凝胶性等功能特性[1],被广泛应用于婴儿食品、饮料、肉制品和冷冻制品等各类加工食品中[1-4]。目前,很多研究对大豆蛋白进行糖基化和磷酸化改性,以提高大豆蛋白的加工性。然而,这两种改性对大豆蛋白消化性和吸收的影响如何,目前尚不完全清楚。
蛋白质的营养价值主要取决于氨基酸组成和胃、肠道消化酶解物的转运吸收情况。研究显示,除游离氨基酸外,肽也是机体吸收氨基酸的重要形式。人和动物肠道吸收蛋白质的主要路径是小肽转运载体(Oligopeptide transporter,PepT1),其转运蛋白质消化产物的能力要高于氨基酸转运载体[5-7]。PepT1 的底物为二肽或三肽,其转运能力与肽段的带电性、结构、分子质量及疏水性有关[8],因此蛋白质消化产物性质的差异也影响其转运吸收。
本研究围绕磷酸化和糖基化大豆分离蛋白体外胃、肠道消化产物的性质展开研究,分析酶解物的分子质量、带电性、疏水性和氨基酸组成等指标。采用体外结肠腺癌单层细胞(Caco-2)模型研究改性大豆蛋白酶解物肠道细胞的转运情况,明确糖基化和磷酸化对大豆蛋白体外消化性的影响。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕,山松生物制品有限公司;胃蛋白酶(P7000)、胰酶Pancreatin(P1750),Sigma 公司。
1.2 仪器与设备
高效液相色谱系统(1100)、色谱柱【分析柱,ZORBAX SB-C18(7.8 mm×300 mm)】,美国Agilent 公司;千分之一电子天平(GF-300),日本ND公司;荧光光谱仪(LS-55),美国Perkin Elmer 公司;pH 计(PP-25-P11),Sartorius 公司;水浴恒温磁力搅拌器(SHJ-A),金坛市华峰仪器公司;冷冻干燥机(FD-1),北京博医康技术公司;离心机(LXJ-I1B),上海安亭科学仪器厂;紫外-可见分光光度计(Spectrum SP-2100UV),上海光谱仪器有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备 将低温脱脂豆粕与水以1∶15 比例混合,以6.0 mol/L NaOH 调节pH值至8.0,室温下提取1 h 后,离心(4 000×g,30 min)。取上清以6.0 mol/L HCl 调节pH 值至4.5,静置30 min 后,离心(4 000×g,20 min),去除上清液,沉淀以蒸馏水洗2 次,将沉淀复溶后再以NaOH 调节pH 值至7.0,注入透析袋,于蒸馏水中透析48 h,除去盐离子,冷冻干燥,得大豆分离蛋白[9],用于制备改性大豆分离蛋白。取经透析的大豆分离蛋白溶液,于沸水浴中90 ℃热处理10 min,使其胰蛋白酶抑制剂失活。冷冻干燥,得对照组大豆分离蛋白(Soybean protein isolate),记为SPI。
用蒸馏水将未经热处理的大豆分离蛋白复溶并调节蛋白质量分数为4%,进行磷酸化和糖基化改性。磷酸化改性条件为:将大豆分离蛋白溶液pH 值调至8.0,分别添加2%,3%,5%的三聚磷酸钠(Sodium tripolyphosphate,STP),45 ℃搅拌4 h,调pH 值至4.0,离心(2 000×g,10 min),去除上清液,沉淀以蒸馏水洗2 次,取沉淀,回调pH 值至7.0。所得溶液注入透析袋,于蒸馏水中透析48 h,除去未反应的磷酸根及盐离子,沸水浴90 ℃热处理10 min,冷冻干燥,得磷酸化大豆分离蛋白(P2-SPI,P3-SPI,P5-SPI)。糖基化改性条件为:葡萄糖(Glucose,G)/葡聚糖(Dextran,D,10 ku):SPI = 1∶1(m/m),于100 ℃加热反应1 h 后调pH值至4.5,离心(2 000×g,10 min),去除上清液,沉淀以蒸馏水洗2 次,取沉淀,回调pH 值至7.0。所得溶液注入透析袋,于蒸馏水中透析48 h,除去未反应的葡萄糖和葡聚糖分子以及盐离子,沸水浴90 ℃热处理10 min,冷冻干燥,得糖基化大豆分离蛋白(G-SPI,D-SPI)。
1.3.2 改性大豆蛋白胃、肠道体外消化 根据Marambe 等[10]的方法略作改动。称取一定量的胃蛋白酶,用pH 2.0 的0.2% NaCl 溶液配制成质量分数2.5%的胃蛋白酶溶液。称取一定量的胰酶,用pH 7.0 的0.68% KH2PO4和0.062% NaOH 混合溶液配制成质量分数0.5%胰酶溶液。采用Folin-酚法测定样品SPI、P2-SPI、P3-SPI、P5-SPI、GSPI,D-SPI 的蛋白含量,将样品蛋白含量调整为20 mg/mL,并将样品溶液的pH 值调至2.0,在37℃水浴中平衡10 min,加入胃蛋白酶溶液,使得胃蛋白酶在样品中的最终浓度为200 U/mg 蛋白,于37 ℃水浴消化60 min。胃酶消化结束后,将各样品pH 值调至7.0,在37 ℃水浴中平衡10 min,加入胰酶,使终浓度为0.4 × USP/mg 蛋白,在37 ℃条件下进一步消化120 min,沸水浴中加热至90 ℃保持10 min,冷冻干燥后得到相应的SPI 消化产物,分别记为E-SPI、E-P2SPI、E-P3SPI、E-P5SPI,E-GSPI 和E-DSPI。
1.3.3 改性大豆蛋白体外消化产物分子质量 采用体积排阻高效液相色谱法(Size high perform liquid chromatography,SE-HPLC)分析胃、肠道酶解物的分子质量。称取一定量的待测样品,用pH 7.4 的0.03 mol/L Tris-HCl 缓冲溶液,调整样品质量浓度为5 mg/mL,用0.45 μm 的微孔滤膜过滤后进样。色谱条件是:Agilent 1100 高效液相色谱系统,色谱柱为Protein Pak 60 凝胶色谱柱(waters,分离范围1~20 ku);检测温度27 ℃;流动相:pH 7.4 的0.03 mol/L Tris-HCl 缓冲溶液;检测波长214 nm;流速0.5 mL/min;上样量20 μL。分子质量校正曲线所用标准品为:AB2-95(3 313 u)、AB2-81(5 856 u)、AB2-80(7 823 u)、蛋清溶菌酶(14 400 u)、胰蛋白酶抑制剂(20 100 u),根据标准品分子质量的对数与保留时间作回归分析,获得的回归方程为T=25.8677-3.2830 lg MW(R2=0.9943,P<0.05),式中,MW 为分子质量(u),T 为保留时间(min)。根据标准品分子质量的对数与保留时间之间的回归方程计算样品的分子质量。
1.3.4 改性大豆蛋白体外消化产物电荷分布
1)阳离子交换层析:SP Sephadex C25 阳离子交换柱(Φ2.6 cm × 20 cm)用pH 7.0 的0.02 mol/L 磷酸缓冲液平衡,流速为2.0 mL/min。将消化产物复溶于pH 7.0 的0.02 mol/L 磷酸缓冲液中,制备样品质量浓度为400 mg/mL 的溶液,之后用0.45 μm 微孔滤膜过滤。取1.0 mL 滤液进样,在0~120 min 内,采用pH 7.0 的0.02 mol/L 磷酸缓冲液溶液洗脱分离未吸附的肽组分;120~300 min内,采用含有0.5 mol/L NaCl 的pH 7.0 的0.02 mol/L 磷酸缓冲液进行洗脱。检测波长为220 nm,运用系统自带的HD-A 色谱处理记录系统记录图谱的变化。
2)阴离子交换层析:DEAE-Sepharose 阴离子交换柱(Φ2.6 cm×20 cm)用0.02 mol/L pH 7.0的磷酸缓冲液平衡,流速为2.0 mL/min。将消化产物复溶于pH 7.0 的0.02 mol/L 磷酸缓冲液中,制备成样品质量浓度为400 mg/mL 的溶液,之后用0.45 μm 的微孔滤膜过滤。取1.0 mL 滤液进样,在0~120 min 内,采用pH 7.0 的0.02 mol/L 磷酸缓冲液溶液洗脱分离未吸附的肽组分;120~180 min内,采用含有0.5 mol/L NaCl 的pH 7.0 的0.02 mol/L 磷酸缓冲液洗脱;180~240 min 内,采用含有1.0 mol/L NaCl 的pH 7.0 的0.02 mol/L 磷酸缓冲液洗脱;240~360 min 内,采用含有2.0 mol/L NaCl的pH 7.0 的0.02 mol/L 磷酸缓冲液洗脱。检测波长为220 nm,运用系统自带的HD-A 色谱处理记录系统记录图谱的变化。
1.3.5 改性大豆蛋白体外消化产物表面疏水性指数 参照Haskard 等[11]的检测方法并略有改进。表面疏水性指数(S0)采用ANS-荧光探针法测定。用pH 7.0 的0.01 mol/L 磷酸盐缓冲液对样品进行梯度稀释,制备改性大豆蛋白酶解物质量浓度为0.2 mg/mL 的样品稀释液。ANS-荧光探针染液(1.25 mmol/L)采用相同的缓冲液配制。吸取0.5 mL ANS 染液与4.5 mL 样品稀释液混合均匀,避光静置2 h。将混合液在波长375 nm 处激发,用荧光光谱仪扫描波长390~470 nm 范围的荧光发射光谱,狭缝宽10 nm,扫描速率200 nm/min。以最大荧强度对蛋白浓度作图,利用线性回归求回归曲线的斜率,即表面疏水性指数(S0)。
1.3.6 改性大豆蛋白体外消化产物氨基酸组成分析 大豆蛋白消化产物氨基酸组成分析采用HPLC-异硫氰酸苯酯柱前衍生法。所有样品采用6 mol/L HCl 进行全水解。采用0.1 mol/L HCl 溶液配置2 mg/mL 的全水解样品,取100 μL 异硫氰酸苯酯的乙腈溶液和100 μL 三乙胺(0.1 mol/L HCl 溶解),与200 μL 全水解复溶样品混合,在黑暗条件下常温衍生反应1 h。反应结束后,加入400 μL 正己烷,振荡均匀,静止10 min,吸取下层液体,用0.22 μm 滤膜过滤,进行HPLC 分析。
HPLC 洗脱程序:Venusil AA 氨基酸分析专用柱(4.6 mm×250 mm,5 μm);流动相A:pH 8.2的10 mmol/L 磷酸缓冲液;流动相B:80% 乙腈。流速1.0 mL/min,检测波长254 nm,进样量10 μL。
1.3.7 Caco-2 细胞单层模型的建立 采用25 cm2细胞培养瓶培养Caco-2 细胞。培养液为含有10%的胎牛血清(体积分数),1%非必需氨基酸(体积分数),100 U/mL 青霉素和0.1 mg/mL 链霉素的高糖培养基。培养条件为37 ℃,含5% CO2,相对湿度90%,Caco-2 细胞在培养瓶中分布达80%时,用含有0.5% EDTA 的胰酶消化细胞,然后以4×105~5×105细胞/mL 浓度接种于6 孔Transwell细胞培养板的上侧。每隔2 d 更换1 次细胞培养液。
Caco-2 单层细胞培养到14 d,用Hank's 平衡缓冲液(Hank's Balanced Salt Solution,HBSS)清洗Caco-2 细胞2~3 次,然后在单层细胞上侧(AP)和下侧(BL)分别加入1.5 mL 和2.7 mL HBSS 溶液,在37 ℃平衡30 min,移除AP 侧的HBSS 溶液,加入1.5 mL 不同改性大豆蛋白体外消化产物样品,将加入样品的Transwell 培养板在37 ℃下吸收转运2 h,收集下侧的溶液进行微量氨基酸组成分析。
1.3.8 数据统计与分析 试验数据采用Origin 8.0 的软件作图,采用SPSS 16.0 进行单因素方差分析,得到的结果以平均值±标准差表示。以方差分析ANOVA 来检测平均值之间的差异,以P<0.05 为差异显著。
2 结果与讨论
2.1 消化产物的分子质量
采用体积排阻色谱法分析不同改性处理的大豆蛋白消化产物的分子质量分布,结果见表1。不同大豆蛋白消化产物中,分子质量低于1 ku 的肽段所占比例最大。同时,改性使得大豆分离蛋白的消化产物分子质量分布发生明显变化,即,磷酸化大豆分离蛋白消化产物和糖基化大豆分离蛋白消化产物中分子质量低于1 ku 的肽段所占比例与对照【未改性的大豆蛋白酶解物(E-SPI)】相比均升高,说明两种改性方式均提高了小肽产量。由于小肽转运载体(PepT1)转运底物主要是二肽和三肽(分子质量低于1 ku),因此,推测两种改性均有利于大豆蛋白酶解物的吸收。

表1 不同SPI 体外消化产物的分子质量分布Table 1 Molecular weight distribution of different SPI hydrolysates by in vitro digestion
2.2 消化产物的电荷分布
蛋白质消化产物在体内吸收的过程中,消化产物的带电情况影响其与PepT1 的相互作用,进而决定了其被吸收的情况[12]。
本研究分别采用阳离子交换柱(SPSephadex)和阴离子交换柱(DEAE-Sepharose)探究不同电荷的消化产物组分所占比例,得到如图1所示的两个洗脱色谱图。图1a 为阳离子交换柱,阳离子交换介质结合溶液中带正电荷的基团,带负电及不带电荷的基团不被结合而最先被洗脱,随着洗脱液中阳离子浓度的提高,结合在交换填料上的正电荷基团被洗脱液中阳离子交换而洗脱下来。在0~120 min 内,被洗脱出的F1 峰和F2 峰为非正电荷组分(即带负电荷或电中性组分),在120~360 min 内,洗脱出的F3 峰为带正电荷的组分。类似地,图1b 为阴离子交换柱,阴离子交换介质则相反,结合溶液中带负电荷的基团,最先洗脱出来的是带正电和不带电荷的基团,随着洗脱液阴离子浓度的增加,带负电荷组分逐渐被洗脱出来。在0~120 min 内,被洗脱出的F′1 峰表示非负电荷组分(即带正电荷或不带电组分),在120~360 min 内,随着洗脱液中氯离子浓度从0.5 mol/L增加到2.0 mol/L,被洗脱出的组分F′2、F′3、F′4 和F′5 均为带负电荷的组分,且负电荷量依次增加。

图1 磷酸化和糖基化改性大豆蛋白体外消化物的离子交换色谱图Fig.1 Ion exchange chromatography of SPI hydrolysates by in vitro digestion
不同改性大豆蛋白体外消化产物电荷组分所占比例见表2。在阳离子交换层析过程中,与对照(E-SPI)相比,E-P2SPI 中正电荷组分(F3)比例提高,而随着磷酸化程度的提高,E-P3SPI 和EP5SPI 的正电荷组分逐渐下降,与E-SPI 相比分别下降了6.58%和8.28%。低磷酸化改性大豆蛋白酶解物比未改性大豆蛋白酶解物正电荷组分高,而随着磷酸化程度的提高,正电荷组分减少。葡萄糖糖基化消化产物(E-GSPI)和葡聚糖糖基化消化产物(E-DSPI)中F3 所占比例显著高于E-SPI,即糖基化改性大豆蛋白酶解物中正电荷组分比例显著高于未改性大豆蛋白酶解物。
接着,采用阴离子交换层析分析不同改性大豆蛋白体外消化产物的电荷分布情况,发现不同改性的大豆蛋白体外消化产物(E-P2SPI、EP3SPI、E-P5SPI、E-GSPI、E-DSPI)中带负电荷的组分(F′2+F′3+F′4+F′5)显著高于对照(E-SPI)。
有研究表明,小肽转运载体PepT1 更易与中性不带电荷的小肽相结合[12]。根据阴阳离子交换原理,进一步分析了大豆蛋白体外消化产物中电中性组分的分布情况。表2 中,阳离子交换柱(SPSephadex C25)中F1+F2 组分(非正电荷组分)与阴离子交换柱(DEAE-Sepharose)中F′2+F′3+F′4+F′5 组分(负电荷)的差值,即电中性组分(I)。同时,阴离子交换柱(DEAE-Sepharose)中F′1(非负电荷组分)与阳离子交换柱(SP-Sephadex C25)中F3 组分(正电荷)的差值,即电中性组分(II)。如表2所示,采用两种计算方法得到的阳离子交换柱(SP-Sephadex C25)中电中性组分(I)和II 电中性组分(II)差异不显著,说明该方法的可行性。由表2 可看出,所有大豆蛋白体外消化产物样品的中性不带电荷的组分所占比例均最大。低水平磷酸化SPI 消化产物(E-P2SPI)较E-SPI 而言,电中性组分的比例显著降低,然而,随磷酸化程度提高,电中性组分所占比例逐渐增加,然而,始终低于E-SPI。葡萄糖糖基化SPI 消化产物(E-GSPI)电中性组分所占比例低于对照,而葡聚糖糖基化SPI消化产物(E-DSPI)电中性组分所占比例高于对照。有研究表明,PepT1 倾向于优先与中性不带电荷组分结合[12]。分析改性大豆蛋白体外消化产物带电性的性质,磷酸化改性可能会抑制大豆蛋白胃、肠道酶解物的转运,且随着磷酸化程度的提高,磷酸化样品与小肽转运载体的亲和力逐渐提高,而其亲和力仍低于对照。糖基化改性大豆蛋白体外消化产物呈现的结果不一致,葡聚糖E-SPI大豆蛋白体外消化产物(E-DSPI)与PepT1 亲和力高于未改性的样品(E-SPI),而葡萄糖糖基化产物E-GSPI 低于E-SPI,这可能与参与改性的两种糖的分子质量不同有关。

表2 阳离子和阴离子交换柱层析分离的不同样品的不同电荷组分比例Table 2 Different charge component ratio of E-SPIs separated by SP-Sephadex and DEAE-Sepharose
2.3 消化产物表面疏水性指数(S0)
蛋白质消化产物性质中,除分子质量和电荷外,疏水性也影响酶解物的转运吸收。采用ANS荧光探针法测得不同改性大豆蛋白消化产物表面疏水性如图2所示。未改性大豆蛋白(E-SPI)和磷酸化大豆蛋白(E-P2SPI、E-P3SPI、E-P5SPI)胃、肠道体外消化产物的表面疏水性指数分别为11.579,11.285,11.470和12.075。低磷酸化程度大豆蛋白消化产物(E-P2SPI、E-P3SPI)与E-SPI 相比,差异不具有显著性,而高磷酸化程度(EP5SPI)消化产物表面疏水性显著高于E-SPI(P<0.05),且磷酸化大豆分离蛋白消化产物的表面疏水性指数随磷酸化程度的增加,呈升高趋势。EP2SPI 中的小分子质量组分所占比例明显高于对照E-SPI(表1)。在胃、肠道消化过程中,随着酶解的进行,蛋白质分子链不断缩短,亲水基团暴露的越来越多,使溶解性越来越好。低分子质量组分含量高的消化产物亲水性提高,相应的疏水性下降,这是E-P2SPI 的表面疏水性指数略低于对照组(E-SPI)的原因,但两者之间无显著性差异(P>0.05)。然而,随着磷酸化程度的提高,磷酸化引入的静电斥力作用相对增强,进而导致消化产物内部的疏水基团暴露的更多[13],因此,消化产物表面疏水性呈现随磷酸化程度的提高而增高的趋势(E-P5SPI 显著高于E-P2SPI 和E-P3SPI,P <0.05)。

图2 磷酸化和酰基化大豆蛋白体外消化物的表面疏水性指数(S0)Fig.2 Surface hydrophobicity(S0)of different SPI hydrolysates by in vitro digestion
糖基化大豆蛋白(E-GSPI 和E-DSPI)胃、肠道体外消化产物的表面疏水性指数分别为9.087和9.820,与E-SPI(11.579)相比,糖基化大豆分离蛋白消化产物表面疏水性指数均显著降低,可能由于糖基化引入大量亲水性羟基,经胃、肠道消化后暴露更加彻底,从而导致其消化产物疏水性降低。E-GSPI 疏水性指数较E-SPI 降低了21%,EDSPI 降低了14%,E-DSPI 的表面疏水性指数降低程度高于E-GSPI,可能是由葡聚糖引入的空间位阻作用所致。
结合Nielsen 等[14]的研究,PepT1 易与表面疏水性强的小肽相结合,磷酸化SPI 的消化产物尤其是E-P5SPI 更易与PepT1 结合,从而更易被吸收。而糖基化SPI 消化产物与E-SPI 相比,不易与PepT1 结合。
2.4 消化产物氨基酸组成
蛋白质在胃、肠道消化过程中释放的氨基酸种类及数量是评价蛋白质营养价值的重要指标[15]。经不同改性处理的SPI 对应消化产物的氨基酸组成情况如表3所示。
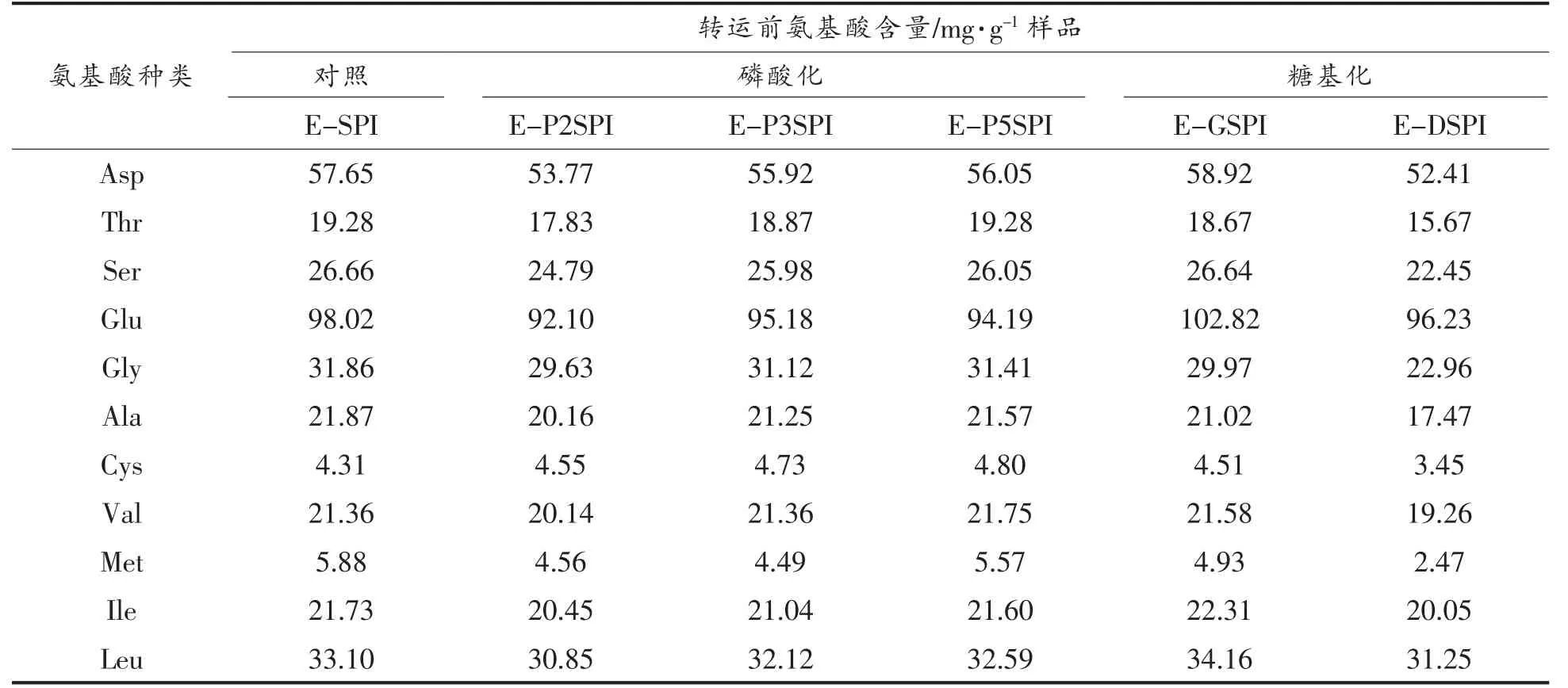
表3 Caco-2 细胞转运前不同SPI 消化产物的氨基酸组成情况Table 3 Amino acid composition of different SPI hydrolysates before Caco-2 cells transportation
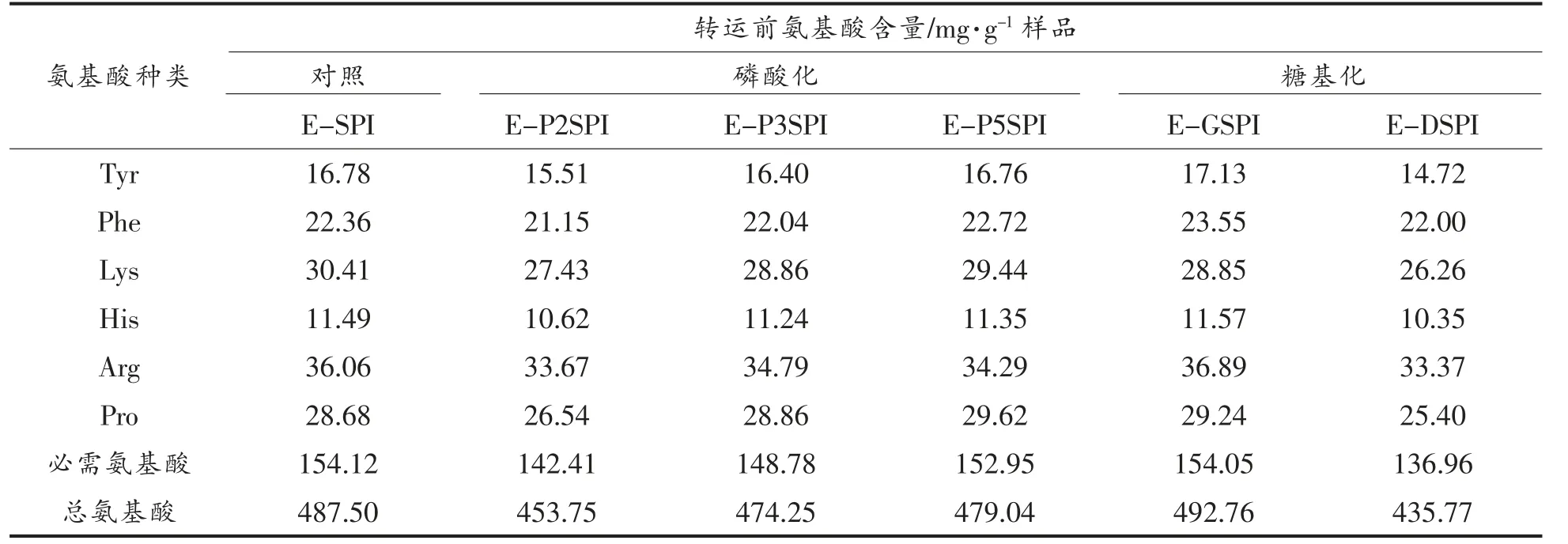
(续表3)
对总氨基酸含量而言,体外消化后磷酸化改性大豆蛋白体外消化酶解物均低于未改性样品(E-SPI),E-P2SPI 的总氨基酸含量下降最多,约6.9%。糖基化改性中葡萄糖糖基化大豆蛋白的体外酶解物(G-DSPI)总氨基酸略高于E-SPI,而葡聚糖糖基化改性蛋白制得的消化产物(E-DSPI)下降了10.7%。各种SPI 对应的必需氨基酸变化趋势与总氨基酸的趋势大致相同。同样,与未改性样品(E-SPI)相比,改性样品中必需氨基酸含量下降最显著的是E-DSPI,下降约11.7%。大豆蛋白的限制性氨基酸为Met 和Cys。与E-SPI 相比,各种改性大豆蛋白体外酶解物的Met 均有所下降,其中E-DSPI 的Met 含量与E-SPI 相比差异最大,降低约58.0%。对Cys 而言,E-DSPI 较E-SPI下降了19.9%,而其它改性蛋白差异不明显。
对于其它氨基酸,磷酸化和糖基化样品的Lys、Arg、Ser 和Thr 含量较E-SPI 均有不同程度的下降,可能是由于这些氨基酸参与了改性反应,从而降低其可检测量。田少君等[16]证实三氯氧磷与大豆分离蛋白反应的实质主要是Lys 及Arg 残基进行氨基磷酯化反应。也有研究发现酪蛋白磷酸化位点在羟基氨基酸上[17]。Sung 等[18]则认为,三聚磷酸钠磷酸化的主要位点是Ser 和Lys。关于糖基化位点,Guerra 等[19]报道糖基化主要发生在Lys的ε-NH2上,Lys 和还原糖反应形成复合物,使得Lys 不能被消化酶识别,从而降低了有效Lys 的含量。
进一步分析各种蛋白质体外消化酶解物中的非极性疏水氨基酸(Ala,Val,Leu,Ile,Pro,Phe,Met)、极性中性氨基酸(Thr,Ser,Gly,Cys,,Tyr)、酸性氨基酸(Asp,Glu)和碱性氨基(Lys,His,Arg)酸所占比例,结果见表4。对于未改性SPI,各种氨基酸中非极性疏水性氨基酸所占比例最高,其次是酸性氨基酸,极性中性氨基酸和碱性氨基酸比例相近。磷酸化改性SPI 的各种氨基酸比例与SPI相比变化不明显。而糖基化改性SPI,非极性疏水性氨基酸和极性中性氨基酸比例下降,酸性氨基酸比例略有升高。
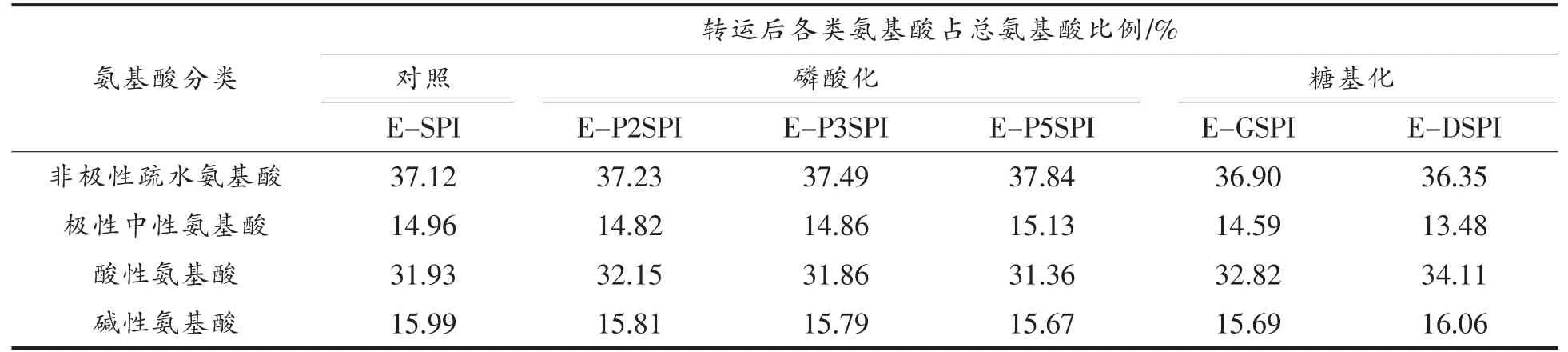
表4 Caco-2 细胞转运前不同SPI 消化产物的氨基酸分类Table 4 Amino acid category in different SPI hydrolysates before Caco-2 cells transportation
2.5 消化产物经Caco-2 细胞转运后的氨基酸组成分析
Caco-2 细胞是人体的结肠腺癌细胞,经过分化具有肠吸收细胞的特点,且能表达PepT1 转运载体,广泛应用于蛋白质和肽吸收情况的评价[21]。本研究在评估了不同改性处理大豆蛋白体外消化酶解物的性质基础上,采用Caco-2 单层细胞模型进一步考察糖基化和磷酸化改性对大豆蛋白体外消化和吸收的影响。不同改性SPI 对应消化产物在Caco-2 单层细胞模型转运后的氨基酸组成情况见表5。

表5 Caco-2 细胞转运后不同SPI 消化产物的氨基酸组成Table 3 Amino acid composition of different SPI hydrolysates after Caco-2 cells transportation
由表3 可知,与对照样品(E-SPI)相比,磷酸化和糖基化改性大豆蛋白体外消化物转运的肽段总氨基酸和必需氨基酸仍呈下降趋势,而下降程度均低于各样品所对应的转运前总氨基酸及必需氨基酸的下降程度。其中,E-DSPI 经Caco-2 细胞转运后的总氨基酸和必需氨基酸与对照相比下降程度远低于E-DSPI 未转运前,对于大豆蛋白的限制性氨基酸Met 和Cys,E-DSPI 中Met 含量与E-SPI 相比下降了58.0%,然而Caco-2 肠道单层细胞转运后,E-DSPI 的Met 含量较转运对照下降了5.9%。对Cys 而言,E-DSPI 较E-SPI 下降19.9%,转运后E-DSPI 中Cys 含量反而高于ESPI 中Cys 含量,这些结果说明肠道细胞转运可缓解改性造成的大豆蛋白酶解物氨基酸含量下降或损失的现象。
对Caco-2 细胞单层模型转运后,各种改性蛋白质的非极性疏水氨基酸、极性中性氨基酸、酸性氨基酸和碱性氨基酸所占比例进行分析,结果见表6。对于对照E-SPI,转运后疏水性氨基酸所占比例仍高于极性中性氨基酸、酸性氨基酸和碱性氨基酸。同时,转运后的疏水氨基酸所占比例明显高于转运前疏水氨基酸所占比例(表4)。也就是说,在转运过程中,疏水性氨基酸更易被吸收转运。有研究报道,PepT1 小肽转运载体上参与二肽和三肽结合的位点为保守的疏水氨基酸[7]。此外,可以看到极性和中性氨基酸比例显著提高,而酸性氨基酸比例明显下降,导致极性和中性氨基酸所占比例高于酸性氨基酸和碱性氨基酸,这与Kottra 等[12]的报道一致,即电中性小肽的吸收效果最好。表2 结果也表明,大豆蛋白的体外酶解物中携带电中性电荷的肽段比例最高,决定了经Caco-2 细胞吸收后极性中性氨基酸比例明显提高。对于磷酸化和糖基化的大豆蛋白样品,不同种类氨基酸比例与对照大致相同。其中,磷酸化大豆蛋白转运的疏水性氨基酸比例明显高于对照SPI 和糖基化大豆蛋白,Caco-2 细胞中的PepT1 小肽转运载体易与表面疏水性强的小肽结合[14]。图2 显示磷酸化大豆蛋白体外酶解物的表面疏水性(尤其是E-P5SPI)高于对照和糖基化大豆蛋白,这可能是导致其疏水性氨基酸比例提高的原因。对于糖基化大豆蛋白(尤其是E-DSPI),其转运的非极性中性氨基酸的比例高于对照。研究表明,PepT1对底物亲和力顺序为中性肽>阳离子肽>阴离子肽[12]。表2 结果显示,E-DSPI 的中性电荷肽含量明显高于对照,进一步解释了这一现象。
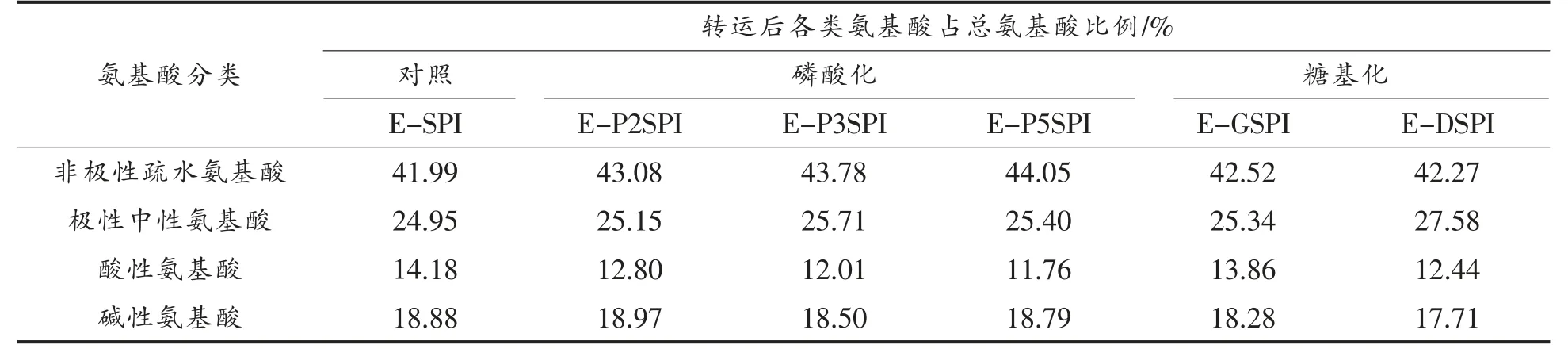
表6 Caco-2 细胞转运后不同SPI 消化产物的氨基酸分类Table 6 Amino acid category in different SPI hydrolysates after Caco-2 cells transportation
可见,影响蛋白质消化产物吸收的因素很多,除与酶解物氨基酸组成有关外,还受消化产物性质,如分子质量、电荷分布及表面疏水性等的影响。消化产物与肠吸收细胞小肽转运载体的相互作用决定了肽段和氨基酸被吸收转运的程度。与未改性大豆蛋白相比,磷酸化和糖基化改性大豆蛋白消化产物从氨基酸组成上看,均显著降低了蛋白质的营养性,然而经Caco-2 单层细胞模型转运后,这种现象明显缓解,尤其是必需氨基酸含量。小肽转运载体对底物的选择性,倾向于对电中性、低分子质量、疏水性强肽段的吸收,缓解了磷酸化和糖基化改性降低大豆蛋白营养性的影响。
3 结论
磷酸化和糖基化改性改变了大豆蛋白体外消化酶解物的性质。从氨基酸组成上看,总氨基酸、必需氨基酸和大豆蛋白的限制性氨基酸(Met 和Cys)含量降低。同时,磷酸化和糖基化改性后大豆蛋白体外消化产物的分子质量均下降。磷酸化改性降低了消化产物的电中性肽段含量,糖基化改性(E-DSPI)则相反。磷酸化改性(E-P5SPI)提高了消化产物的疏水性,而糖基化改性则显著降低了肽段的表面疏水性指数。经肠细胞Caco-2 转运后,在消化产物分子质量、带电性及疏水性等因素的共同作用下,磷酸化和糖基化改性造成的大豆蛋白氨基酸损失降低,蛋白质消化酶解物性质决定其被转运吸收的情况。
