基于适配体的纳米金光学探针可视化法快速测定中药材中的啶虫脒
2021-03-06尤金坤魏小红陈媛媛叶淑敏余宇燕张红艳
尤金坤,魏小红,陈媛媛,叶淑敏,余宇燕,张红艳
(福建中医药大学 药学院,福州 350122)
啶虫脒化学名称为N-(N-氰基-乙亚氨基)-N-甲基-2-氯吡啶-5-甲胺,属于氯化烟碱类化合物,是一种新型杀虫剂,通过作用于昆虫神经系统突触部位的烟碱乙酰胆碱受体,从而干扰刺激的传导,使神经系统通路堵塞,进而导致乙酰胆碱在突触部位积累,达到杀虫目的,被广泛应用于蚜虫、飞虱、蓟马等虫害防治中[1-3]。随着中药材产业规模化发展,大面积集中种植导致病虫害日渐严重,而啶虫脒因杀虫效果良好,且与传统的杀虫剂相比,具有毒性低的优势,被广泛应用到中药材生产种植中。但啶虫脒易残留在植物体内,进而通过食物链蓄积在人体内,可能对用药人群造成健康危害[4-5]。为了评价啶虫脒对中药材采收及使用安全性的影响,需对其残留情况进行研究及评估。
目前啶虫脒传统的测定方法为色谱法和免疫分析法[6-9]。色谱法主要依托于大型仪器进行定量分析,如气相色谱-串联质谱法(GC-MS/MS)、液相色谱-串联质谱法(LC-MS/MS)等[10-12],虽然这些检测方法已经得到广泛的应用,但是需要繁琐的样品预处理,而且所需仪器大多体积大、价格昂贵、携带困难,不适合现场快速检测。免疫分析法尽管检测快速、特异性强,但是抗体不易获取且制备周期长。因此,发展灵敏准确、快速便捷的新型传感器对啶虫脒农药残留物的测定具有重要意义。
适配体,又被称为“化学抗体”,具有目标物类别广泛、稳定性好、成本低廉且易于修饰等特点,被广泛应用于生物传感器的生物识别探针中[13]。纳米金具有许多独特的物理和光学性质,它兼具合成方法简单、性质稳定、生物亲和性好、消光系数高、易于修饰等优点。而由纳米金制备的光学探针操作方法简单,可以快速观察到结果,在各种化合物的鉴别和测定中得到了广泛应用[14]。
本工作结合纳米金与适配体的独特性质,采用纳米金作为光学探针,适配体作为识别元件,建立一种可视化纳米金比色传感器,以期实现对中药材中啶虫脒农药残留的现场快速测定。
1 试验部分
1.1 仪器与试剂
Infinite M200 PRO 型多功能酶标仪;ZNCLBS型恒温磁力搅拌器;H-7650型透射电子显微镜(TEM);DFY-600型高速万能粉碎机。
氯金酸溶液:0.1 g·L-1,取1 mL 10.0 g·L-1氯金酸溶液,用水定容至100.0 mL。
柠檬酸三钠溶液:0.01 g·mL-1,称取0.101 6 g的柠檬酸三钠,用水溶解并定容至10.00 mL。
啶虫脒标准溶液:1 g·L-1,称取0.010 3 g的啶虫脒,用甲醇溶解并定容至10 mL容量瓶中。其他所需质量浓度均由此溶液用甲醇逐级稀释制得。
阿特拉津、吡虫啉、毒死蜱、甲胺磷标准溶液:100 mg·L-1。
啶虫脒适配体序列:5′-TGTAATTTGTCTGCAGCGGTTCTTGATCGCTGACACCATATTATGAAGA-3′。
啶虫脒适配体溶液:100μmol·L-1,使用时用水稀释至所需浓度。
所用试剂均为分析纯,试验用水为超纯水。实际样品信息见表1。
表1 实际样品Tab.1 Real samples
1.2 试验方法
1.2.1 纳米金溶液的制备
采用柠檬酸还原法合成纳米金[15]。在剧烈搅拌下将100 mL 0.1 g·L-1氯金酸溶液加热至沸腾,迅速加入3 mL 柠檬酸三钠溶液,保持溶液持续沸腾10 min后,停止加热,继续搅拌15 min。待溶液冷却至室温,用0.22μm 滤膜过滤,将制备好的纳米金溶液置于4 ℃下避光保存。
1.2.2 样品中啶虫脒的测定
将中药材样品粉碎,过孔径为0.154 mm 的筛网,混匀后,取1 g于10 mL 离心管中,加入6 mL甲醇,超声提取15 min后,以3 500 r·min-1转速离心10 min。取上清液1 mL 于2 mL 离心管中,加入100 mg无水MgSO4、50 mgN-丙基乙二胺,涡旋2 min后,以8 000 r·min-1转速离心5 min,分离出样品溶液。在酶标板中加入150μL 的纳米金溶液和1.00 μmol·L-1啶虫脒适配体溶液30μL,混匀后在室温下反应15 min;在上述溶液中加入样品溶液,室温下反应20 min;再加入200 mmol·L-1的NaCl溶液30μL,混合均匀后静置5 min。通过多功能酶标仪对样品溶液进行400~700 nm 的紫外-可见吸收光谱扫描,读取各溶液在520,650 nm 处的吸光度。
2 结果与讨论
2.1 试验原理
经柠檬酸根稳定的纳米金会在静电排斥作用下保持稳定,但在高盐环境下,纳米金之间的静电排斥作用会被屏蔽,从而发生聚集,导致溶液颜色发生变化。当以上体系中有适配体或啶虫脒存在时,会发生如1所示的变化。
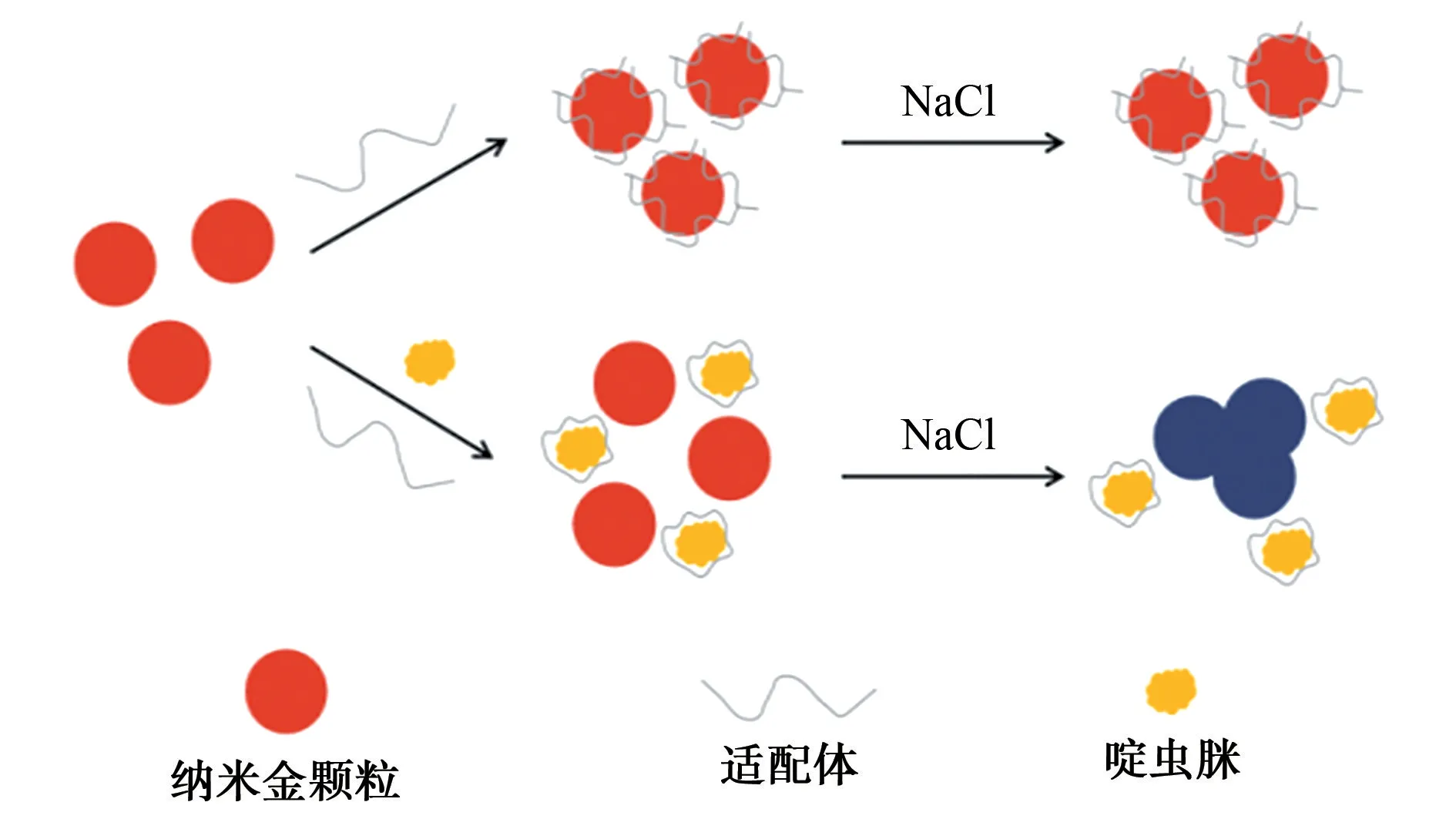
图1 比色传感器原理图Fig.1 Schematic illustration of the mechanism of colorimetric sensor
如图1所示:适配体可以通过静电作用吸附在纳米金表面,使纳米金在高盐溶液中维持分散状态;当在纳米金-适配体体系中加入啶虫脒时,啶虫脒与适配体发生特异性结合,将适配体从纳米金表面解离下来,纳米金失去保护后,将在高盐环境下团聚,体系的颜色由红色变为蓝色。
纳米金、纳米金-啶虫脒、纳米金-适配体-盐及纳米金-适配体-啶虫脒-盐等4 种体系中纳米金的紫外-可见吸收光谱变化见图2。其中,OD 为光密度。
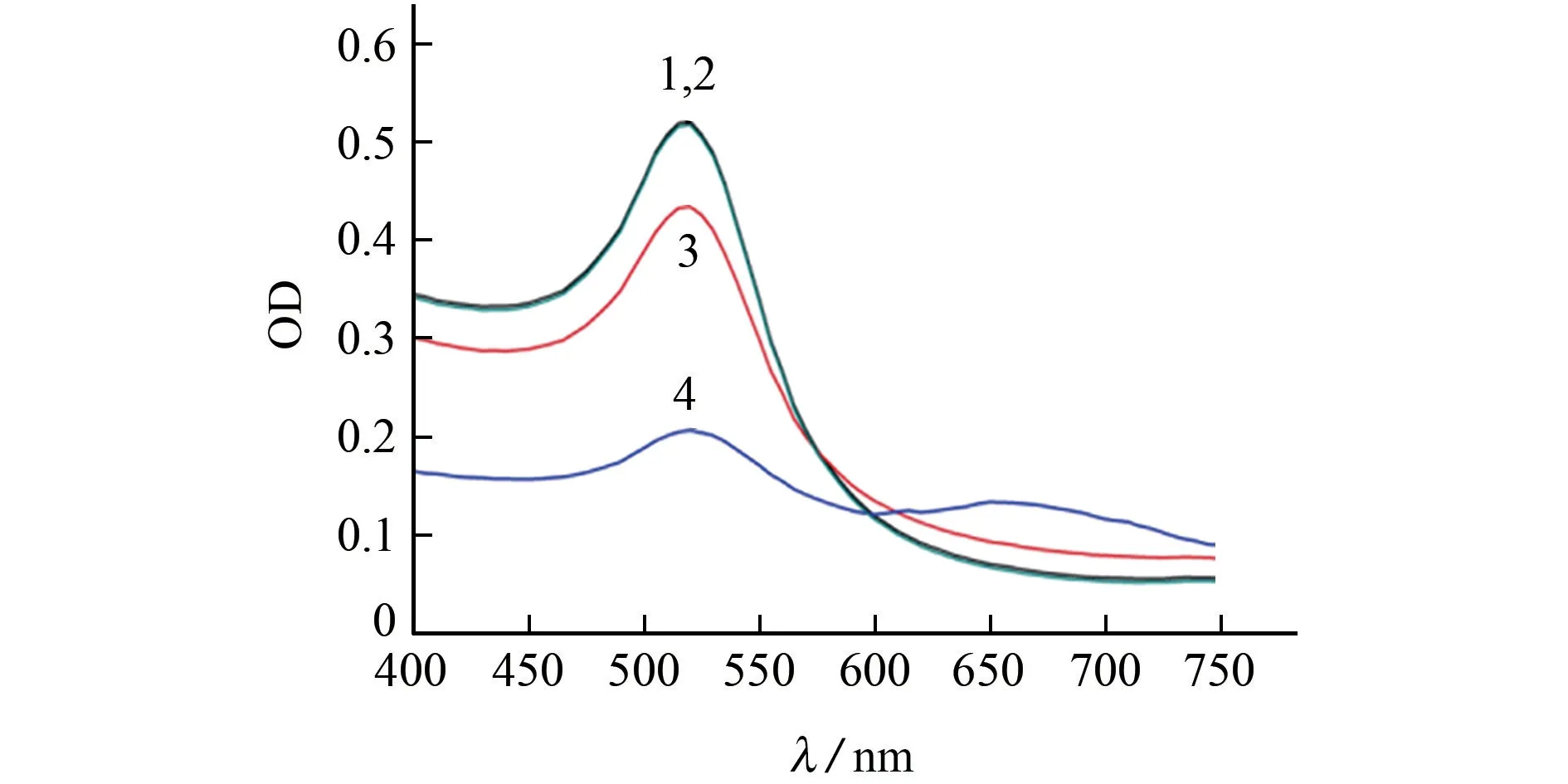
图2 纳米金在不同体系中的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectrum of gold nanoparticles in different systems
由图2可知:当纳米金颗粒以分散状态存在时,最大吸收峰在520 nm 处,溶液颜色为红色;单独加入啶虫脒后,纳米金的吸收光谱和颜色均没有发生变化;加入适配体和盐溶液后,溶液颜色没有明显变化,最大吸收峰仍在520 nm 处,强度没有明显降低,这是由于适配体上的含氮碱基会与纳米金结合,从而保护纳米金免受高盐诱导,保持均匀的分散状态;加入适配体、啶虫脒和盐溶液后,体系颜色变成蓝色,520 nm 处的OD 值下降了超过一半,且在650 nm 处产生了新的吸收峰,这是由于适配体会与啶虫脒产生特异性结合,而失去保护的纳米金在高盐的诱导下发生聚集的作用。
2.2 纳米金的表征
对制备好的纳米金溶液进行400~700 nm 内的紫外-可见吸收光谱扫描和TEM 形貌表征,结果见图3。其中,图3(b)中的内插图为纳米金颗粒TEM 放大图。
由图3 可知:纳米金的特征吸收峰在520 nm处,峰形尖锐无杂峰,与文献[16]报道的一致;纳米金颗粒为圆球形,分散均匀且粒径均一,粒径约为18 nm。
2.3 试验条件的选择
2.3.1 NaCl溶液浓度
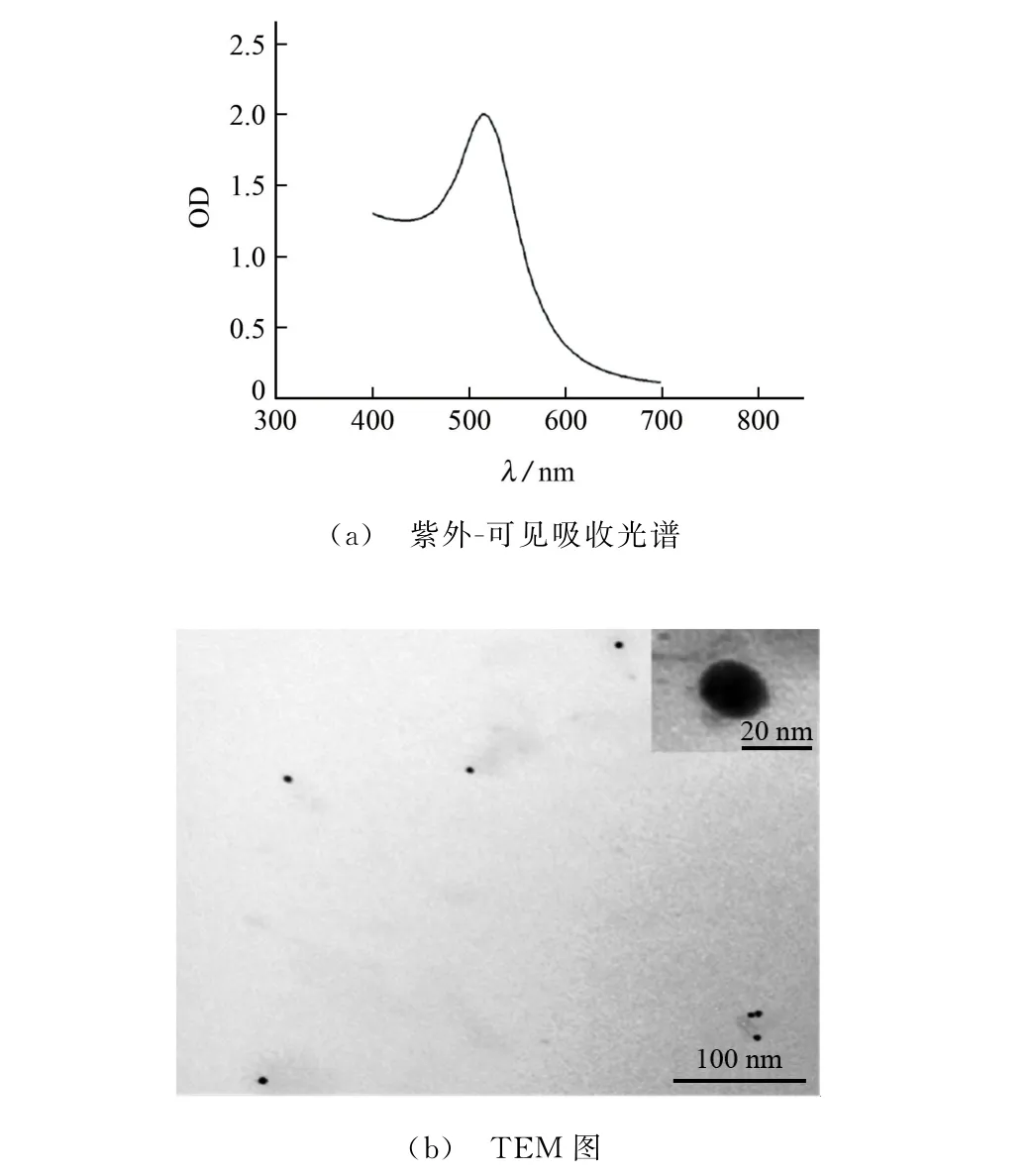
图3 纳米金的紫外-可见吸收光谱和TEM 图Fig.3 UV-Vis absorption spectrum and TEM image of gold nanoparticles
NaCl能够破坏纳米金表面的双电层,使纳米金颗粒发生团聚[17]。随着NaCl溶液浓度的增加,发生团聚的纳米金颗粒数量增多,体系的颜色会由红色逐渐变为蓝色。纳米金比色传感器中NaCl溶液浓度会直接影响整个体系灵敏度,过高NaCl溶液浓度会使纳米金在没有啶虫脒存在下发生团聚,过低NaCl溶液浓度则会导致纳米金聚集不完全,影响结果的准确度。因此,NaCl溶液浓度的选择至关重要。
按照1.2.2节试验方法(其中,用水代替适配体溶液,用甲醇代替样品溶液)考察了NaCl溶液浓度分别为0,50,100,150,200,300,350 mmol·L-1时对测定的影响,结果见图4。
由图4 可知:当NaCl 溶液浓度为50~350 mmol·L-1时,纳米金在520 nm 处的OD 值随着NaCl溶液浓度的增加而逐渐降低;当NaCl溶液浓度低于200 mmol·L-1时,纳米金溶液为红色;当NaCl溶液浓度为200 mmol·L-1时,体系颜色变化明显,且520 nm 处的OD 值显著下降。因此,最终选择200 mmol·L-1的NaCl溶液开展后续试验。
2.3.2 适配体溶液浓度
按1.2.2节试验方法(其中,用甲醇替代样品溶液)考察适配体溶液的浓度分别为0,0.25,0.50,0.75,1.00,2.00,3.00μmol·L-1时对测定的影响,结果见图5。
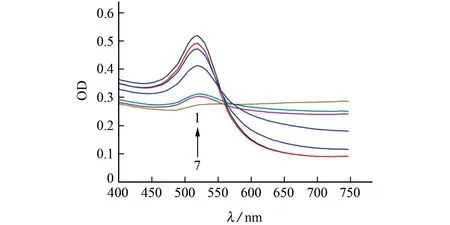
图4 纳米金在不同浓度NaCl溶液中的紫外-可见吸收光谱Fig.4 UV-Vis absorption spectrum of gold nanoparticles in the different concentrations of NaCl solution
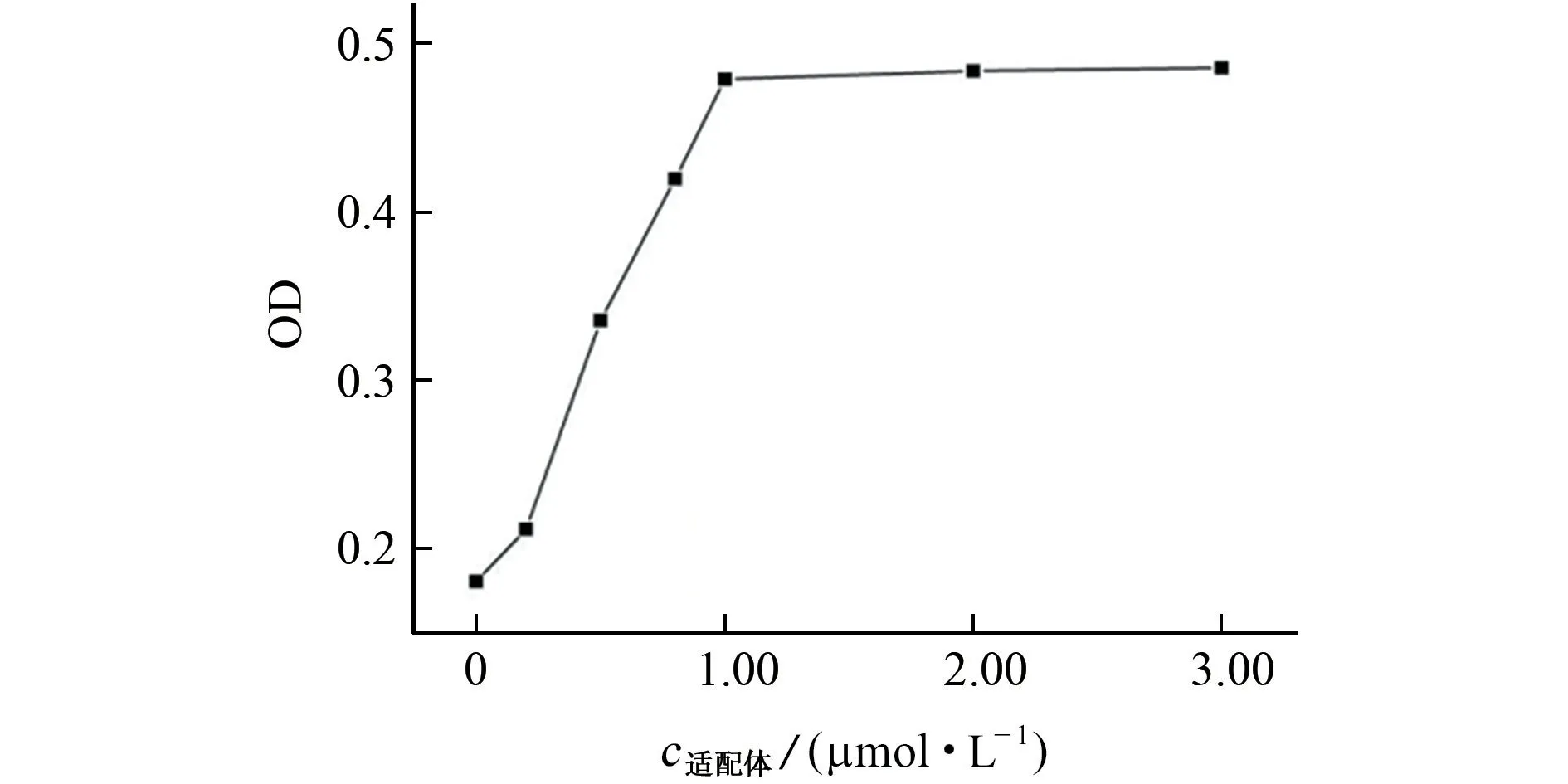
图5 纳米金在不同适配体溶液浓度下的OD值Fig.5 OD values of gold nanoparticles in the different concentrations of aptamer solution
由图5 可知,当适配体溶液浓度小于1.00μmol·L-1时,纳米金分散状态随着适配体溶液浓度的增加而逐渐变好;当适配体溶液浓度大于等于1.00μmol·L-1时,体系OD 值基本不再变化。因此,最终选择1.00μmol·L-1适配体溶液开展后续试验。
2.3.3 纳米金-适配体和啶虫脒-适配体作用时间
按照1.2.2 节试验方法(分别用甲醇和200μmol·L-1啶虫脒标准溶液替代样品溶液)考察纳米金-适配体作用时间分别为0,5,10,15,20,25 min,啶虫脒-适配体反应时间分别为0,5,10,15,20,30 min时对测定的影响,520 nm 处的OD 值随体系作用时间的变化见图6。
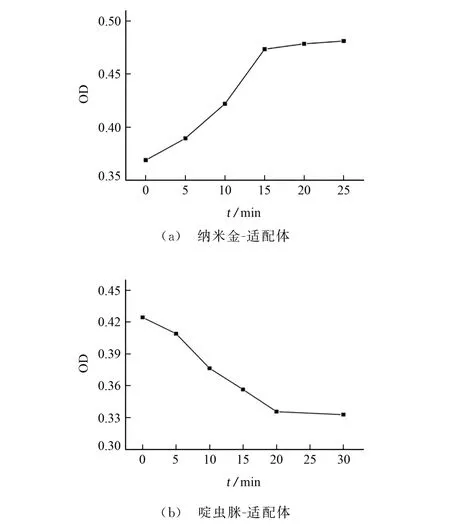
图6 2种体系作用时间对520 nm 处OD值的影响Fig.6 Effect of reaction time of the 2 systems on OD value at 520 nm
由图6可知:520 nm 处的OD 值随着纳米金-适配体作用时间的延长而增加,当作用时间达到15 min后,体系OD 值不再发生明显变化,说明体系中的纳米金与适配体已经结合完全,因此试验选择纳米金-适配体的作用时间为15 min;520 nm 处的OD 值随着啶虫脒-适配体作用时间的延长而降低,当作用时间为20 min时,OD 值没有明显变化。因此,试验选择啶虫脒-适配体的作用时间为20 min。
2.4 标准曲线和检出限
按照1.2.2 节试验方法对0,1,5,10,20,50,100,150,200,250,300μg·L-1的啶虫脒标准溶液系列进行测定。结果显示:随着啶虫脒质量浓度的增加,体系颜色逐渐由红色向蓝色转变,在20~200μg·L-1范围内,650 nm 和520 nm 处吸光度的比值与啶虫脒质量浓度呈良好的线性关系,线性回归方程为y=3.100×10-3x+3.105×10-1,相关系数为0.991 4。
按照1.2.2 节试验方法对样品空白重复测定8次,计算650,520 nm 处吸光度比值的标准偏差,以3倍标准偏差与标准曲线斜率的比值计算检出限,所得结果为1.13μg·L-1。
2.5 特异性试验
为研究体系的特异性,按照1.2.2 节试验方法对相同质量浓度(200μg·L-1)啶虫脒、阿特拉津、吡虫啉、毒死蜱、甲胺磷进行测定,结果见图7。
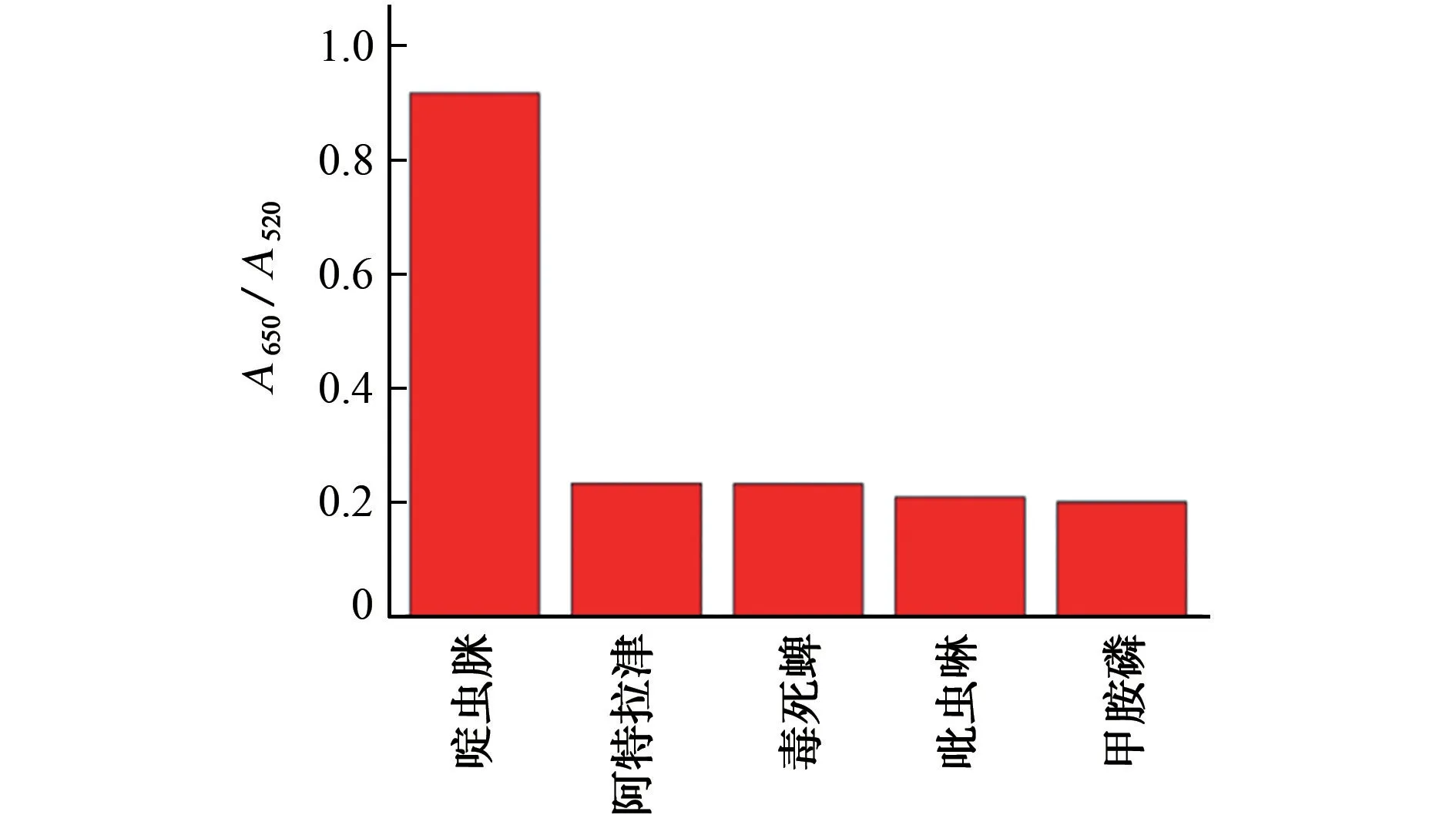
图7 加入不同农药后的响应值Fig.7 Response values after adding the different pesticides
由图7可知,除了啶虫脒,其他4种农药的溶液颜色及其在650,520 nm 处的光吸收均未发生明显变化,说明选择的其他4种农药对啶虫脒的测定没有显著影响,本体系具有良好的特异性。
2.6 精密度和回收试验
对7种空白中药材进行3个浓度水平的加标回收试验,每个浓度水平平行测定5次,计算回收率和测定值的相对标准偏差(RSD),结果见表2。
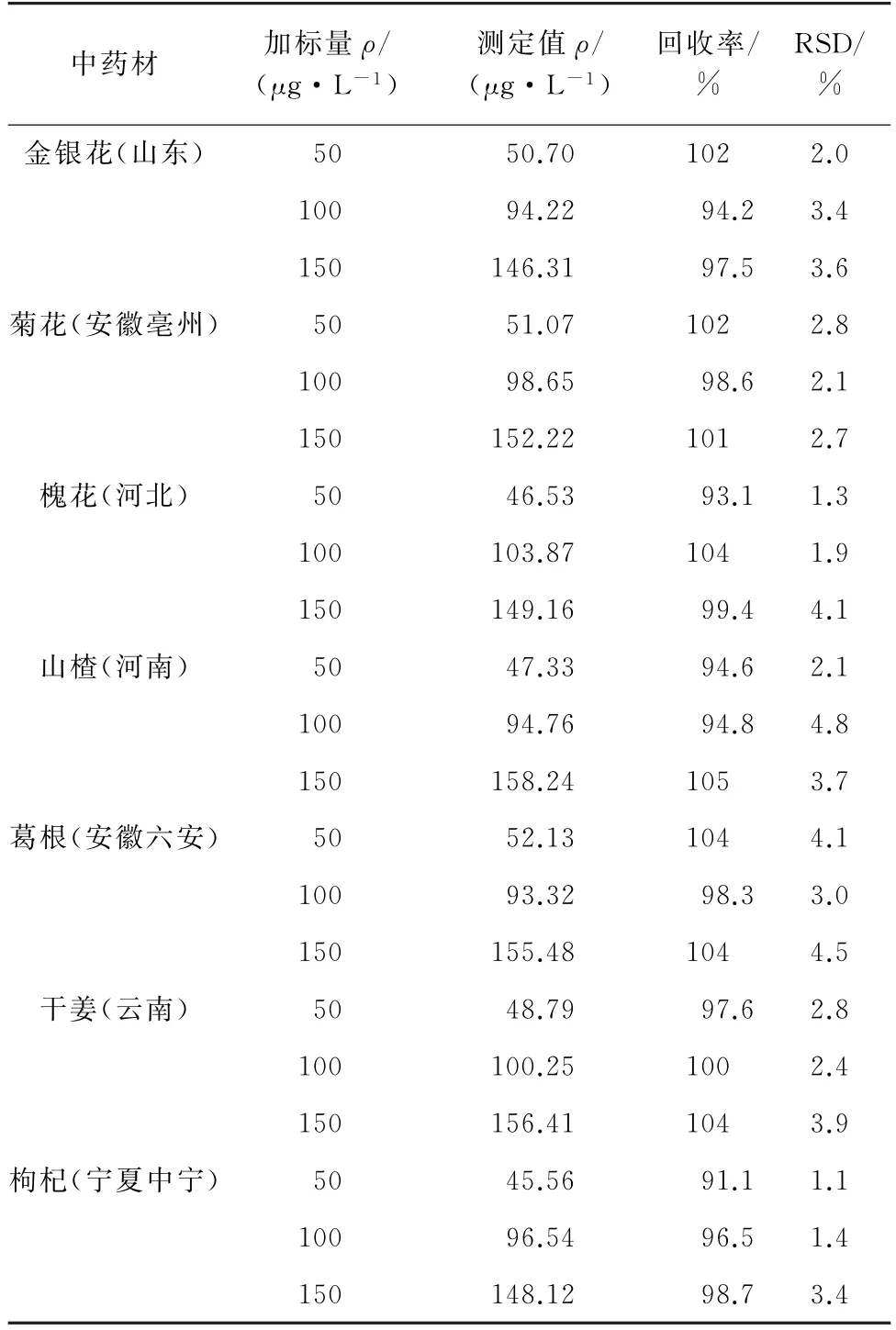
表2 精密度和回收试验结果(n=5)Tab.2 Results of tests for precision and recovery(n=5)
由表2 可知,啶虫脒的回收率为91.1%~105%,RSD 为1.1%~4.8%,表明该方法精密度和回收率良好。
2.7 样品分析
按照1.2.2节试验方法对21份样品进行测定,仅在来自河南商丘的金银花和来自宁夏惠农的枸杞中检出了啶虫脒,检出质量分数分别为329.10,125.22μg·kg-1。
本工作建立了一种基于纳米金-核酸适配体的可视化纳米金比色传感器用于中药材中啶虫脒残留量测定的方法。该方法操作简单、特异性高,可通过肉眼直接半定量分析样品,具有现场检测开发前景,为中药材中农药残留检测及药材质量评价提供依据。
