外源SNP对铝胁迫下大麦苗期根部生理及DNA损伤的影响
2021-03-05张蓝天方云霞张子玲牛春玉吴玉环张晓勤薛大伟
张蓝天,方云霞,张子玲,李 佳,牛春玉,张 弦,吴玉环,张晓勤,薛大伟
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
铝(Aluminium, Al)是酸性土壤中对植物产生毒害的主要因子,在土壤中的含量仅次于氧和硅.通常情况下,大部分铝以固态硅酸盐形式存在于土壤中,对植物和环境无毒害作用[1].当土壤的pH低于5.0时,铝溶解度会大大增加,转变为离子态,导致土壤中高活性铝的含量迅速增加,从而对植物产生毒害.大麦(HordeumvulgareL.)是集经济作物、粮食作物和饲料作物于一体的农作物,在众多禾本科农作物中,受铝毒害尤为严重,这极大地限制了大麦在酸性土壤中的种植.铝对植物的毒害主要表现为导致根、茎生长迟缓,新叶变小,叶片失绿、卷曲,茎变短,叶柄萎缩;从生理生化方面来看,表现为抑制酶的活性和DNA复制,破坏细胞的信号传导,扰乱激素平衡,引起氧化胁迫和膜的损伤等,最终导致生物量和产量的下降.
硝普钠(sodium nitroprusside, SNP)是外源一氧化氮(nitric oxide, NO)供体.NO是植物体内一种重要的氧化还原信号分子,属于活性氮范畴.NO参与植物种子萌发、生长发育、光化学反应、衰老等一系列生理过程[2-3].除此之外,Wang等研究发现NO能显著缓解铝对决明子的毒害,NO预处理能显著缓解铝对植株生长的抑制,减少铝胁迫引起的膜脂过氧化和活性氧(reactive oxygen species, ROS)的积累[4].Ruan等研究发现,合适浓度的SNP处理能显著增强小麦幼苗超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性,缓解由NaCl处理引起的小麦叶片氧化损伤[5].
通过观测根长、SOD和POD活性变化、H2O2和丙二醛(malondialdehyde, MDA)含量变化等,初步探讨NO对铝胁迫下大麦根部受损的缓解作用.其次,利用SRAP (sequence-related amplified polymorphism)分子标记分析大麦根部DNA的损伤情况.通过对SRAP图谱与生理生化指标的综合分析,探索外源SNP缓解大麦根部铝毒害的生理及分子机制,为解决酸性土壤中的铝毒问题,提高大麦产量和质量提供理论参考.
1 材料与方法
1.1 实验设计
大麦处理:对Z17和GP两个大麦品种进行萌发处理,培养至生长出2~3片幼叶后再进行实验.
铝处理:分别用0、10、20、50、100 μmol·L-1的AlCl3(含1 mmol·L-1CaCl2,pH=5.5)对大麦进行24 h铝处理,测量并计算相对根长.根据铝处理后的实验结果选取适宜的铝浓度进行后续实验.
SNP处理:通过铝处理获取适宜的铝浓度(10 μmol·L-1)进行下述实验.设置处理组:(1) Control:全营养液培养;(2) Al+0:10 μmol·L-1;(3) Al+50:10 μmol·L-1+50 μmol·L-1SNP;(4) Al+100:10 μmol·L-1+100 μmol·L-1SNP;(5) Al+200:10 μmol·L-1+200 μmol·L-1SNP;(6) Al+300:10 μmol·L-1+300 μmol·L-1SNP.大麦全营养液成分参考Zhang等[1]提供的方法.
1.2 相对根长的计算
用刻度尺分别测量对照组和各处理组大麦幼苗的根长,求得平均值并计算相对根长.
相对根长(relative root length, REL)=[(待测组根伸长量-Control组根伸长量)/Control组根伸长量]×100%.
1.3 抗氧化酶活性及MDA、H2O2含量测定
SOD活性测定采用氯化硝基四氮唑蓝(nitrotetrazolium blue chloride, NBT)光化还原法[6].POD活性测定采用愈创木酚氧化法[7].过氧化氢(H2O2)含量测定采用紫外分光光度技术[8].MDA含量通过硫代巴比妥酸(thiobarbituric acid, TBA)显色法测定[9].SOD活性、H2O2含量以及MDA含量测定均重复3次.
1.4 DNA提取和SRAP分析
铝处理后大麦幼苗根部DNA提取和SRAP筛选采用Mengoni等的方法[10].通过独立实验从17对引物中筛选出7对(表1)多态性较好的SRAP引物,交由英潍捷基(上海)贸易有限公司合成.通过凝胶电泳后DNA条带的消失和出现显示多态性变化.

表1 本研究所用的引物序列Tab.1 The sequence of SRAP primers
1.5 基因组模板稳定性估计
SRAP图谱的变化可以用基因组模板稳定性(genome template stability, GTS)表示,计算公式为
GTS =(1-a/n)×100%,
其中:a为处理组幼苗SRAP多态性谱带数,即与对照组相比,处理组新出现的和消失的PCR谱带之和;n为对照组总谱带数[11-12].
2 结果与分析
2.1 大麦对铝胁迫的反应
在含0、10、20、50、100 μmol·L-1AlCl3的全营养液中处理两叶期的大麦幼苗,并在24 h、48 h和72 h后分别测量大麦幼苗根长,并计算相对根长.结果发现,20、50、100 μmol·L-1AlCl3处理下的大麦幼苗相继停止生长,10 μmol·L-1AlCl3培养下的大麦幼苗根部可以生长,但根部出现发黄变黑现象,生长缓慢.为保证后续研究中大麦幼苗根部能正常生长,故选择10 μmol·L-1AlCl3用于后续铝胁迫处理.
2.2 外源SNP对铝胁迫下大麦幼苗根长的影响
铝胁迫下Z17和GP两个品种大麦幼苗的根长基本短于Control组大麦幼苗的根长(图1-A),呈现出极显著差异,这证明铝胁迫会抑制大麦幼苗根的生长.然而,添加SNP能在一定程度上缓解铝对大麦幼苗根部的毒害.其中,当SNP浓度低于100 μmol·L-1时,其缓解作用随浓度的增加而提高;当SNP浓度高于100 μmol·L-1时,其缓解作用有所降低.当SNP浓度等于100 μmol·L-1时,Z17品种大麦幼苗的根长与Control已无显著差异,GP品种大麦幼苗根的生长却受到抑制.以上结果说明,合适浓度的SNP具有缓解铝毒害的作用,且这种作用具有品种特异性.
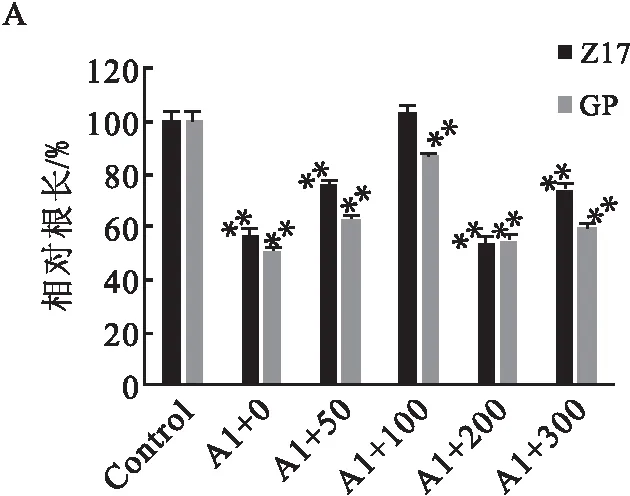
A:相对根长;B:SOD活性;C:POD活性;D:H2O2含量;E:MDA含量.差异显著性分析方法:单因素方差分析(*P<0.05, **P<0.01);误差棒:标准误差.图1 外源SNP对Al胁迫下Z17和GP幼苗不同生理指标的影响(n=5)Fig.1 Effects of exogenous SNP on different physiological indexes of Z17 and GP seedlings under Al stress(n=5)
2.3 外源SNP对铝胁迫下SOD和POD活性的影响
正常条件下,植物体内活性氧的产生和清除处于动态平衡中,但在逆境胁迫下,植物体内活性氧自由基产生的速度超出清除速度,导致活性氧的积累而使植物遭受伤害[13].SOD能将超氧自由基转化成H2O2,再由POD将H2O2分解成H2O.与Control相比,单独铝处理的大麦幼苗根部POD和SOD活性显著升高(图1-B和图1-C);而加入不同浓度的SNP后,活性有不同程度的降低,同样具有品种特异性.在SNP的作用下大麦幼苗根部的SOD活性下降,在GP品种中SOD活性下降与SNP的浓度无明显相关性,但Z17品种中SNP浓度大于50 μmol·L-1时与未加SNP时相比下降显著.总体上看,50 μmol·L-1SNP (Al+50)和100 μmol·L-1SNP (Al+100)对降低铝胁迫后的SOD和POD活性有明显作用.
2.4 外源SNP对铝胁迫下MDA和H2O2含量的影响
在逆境条件下植物细胞内会发生膜脂过氧化.MDA是膜脂过氧化的最终产物之一,对细胞有很强的毒性,会破坏生物膜的结构和功能[13],因此可通过MDA的含量衡量细胞脂膜过氧化程度.结果表明,铝胁迫下幼苗根系中的MDA和H2O2含量明显高于正常水平(图1-D和图1-E).除100 μmol·L-1SNP培养的大麦幼苗外,其余大多数幼苗根部H2O2含量与Control相比均有极显著增加.此外,0、50 μmol·L-1SNP培养的大麦幼苗根部MDA含量极显著增加.综上,0、50 μmol·L-1SNP处理会导致膜脂过氧化,从而显著提高大麦幼苗根部MDA含量和H2O2含量.
2.5 外源SNP对铝胁迫下基因组多态性的影响
铝会引起大麦根部SRAP谱带中条带数目增加、减少、变亮或变暗,而外源SNP可以改变条带的变化,使条带与Control组相似.不同浓度SNP处理的大麦幼苗根系中SRAP条带均有所改变,部分处理组条带变化较为明显(图2).GTS是检测DNA多态性变化的重要指标,结果显示GTS为31.5%~66.7%,SRAP多态性变化如表2所示.
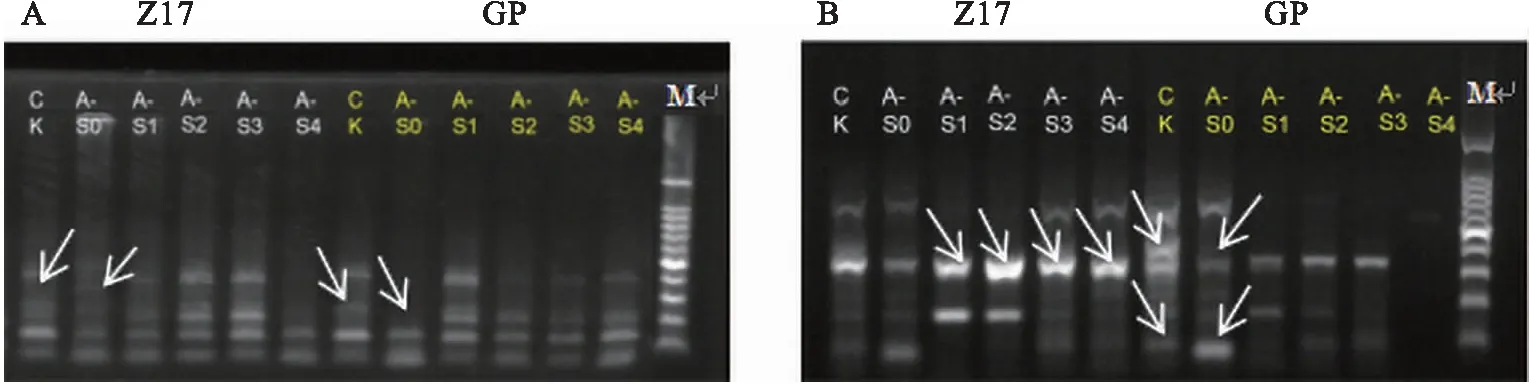
A:引物em1-me9;B:引物em8-me6.标准分子量为100 bp plus.

表2 外源SNP对铝胁迫下Z17和GP幼苗根部DNA稳定性(GTS, %)的影响Tab.2 Effects of exogenous NO on DNA stability (GTS, %) of Z17 and GP seedling roots under Al stress
在引物em1-me9和em8-me6中,铝处理导致GP对应的条带减少了2条(图2-A),而加入SNP后条带恢复为Control组对应的水平(图2-B).Z17经铝处理后不仅条带减少了1条,条带的亮度也下降;在SNP处理后条带数目增加、亮度增加.以上结果说明,GTS与SNP有一定的相关性.在一定范围内(0~100 μmol·L-1),添加的SNP浓度越高,对铝毒害幼苗的缓解作用越好.当SNP浓度超过100 μmol·L-1后,SNP对铝毒害的缓解能力随浓度的增加逐渐降低.在Z17幼苗中,Al+50 μmol·L-1处理组大麦幼苗根部基因组模板稳定性最高,GTS为53%;在GP幼苗中,Al+100 μmol·L-1处理组大麦幼苗根部基因组模板稳定性最高,GTS为67%(表2).
3 讨论
土壤酸化会导致土壤中铝离子浓度增加.铝离子胁迫能够通过增加活性氧的产生使植物细胞分子受到损伤,对植物产生毒害作用,影响植物生长.NO是一种可扩散的、具有氧化还原活性的小生物活性的气体信号分子,它可以参与植物非生物胁迫抗性机制.Singh等报道外源NO可以抑制水稻根系活性氧清除系统的活性,部分阻止砷胁迫下抗氧化活性的增加[14].截至目前,众多研究结果表明外源NO还能够缓解金属Cd、A1、Cu引起的氧化伤害,调控抗氧化酶活水平,为植物系统提供更好的活性氧清除能力.
本研究选取了Z17和GP品种的大麦,在预实验的基础上确定以10 μmol·L-1作为铝离子的胁迫浓度,在此浓度下加入0、50、100、200、300 μmol·L-1SNP,对大麦幼苗进行抗氧化酶活性、MDA含量、H2O2含量测定及SRAP图谱分析,并对所得数据进行统计处理,得出能缓解铝毒害大麦幼苗的SNP浓度.以上研究成果有利于解决酸性土壤中铝胁迫的问题,增加大麦等经济作物的种植面积.
研究发现铝胁迫可使大麦根的伸长受到抑制,这与Horst等[15]得出铝毒导致根伸长受到抑制的结论相同.铝胁迫还会使幼苗POD和SOD活性提高,H2O2和MDA含量增加,引发DNA损伤或损伤DNA修复系统.外源SNP处理可降低SOD、POD的活性,减少H2O2和MDA含量,减少铝胁迫对大麦幼苗修复系统的影响,降低铝胁迫对大麦幼苗DNA的损伤率,对铝毒害大麦具有缓解作用,保护大麦免受铝胁迫的伤害.在一定范围内,外源SNP浓度与缓解作用有着较好的相关性.目前研究成果表明,外源NO可明显改善铝对决明子[4]、水稻[16]、黑麦和小麦[17]根伸长的抑制,改变抗氧化酶活性,减少对细胞膜的损害,这也表明NO能够参与植物耐铝毒的调控过程.研究中,50、100 μmol·L-1SNP对铝毒害大麦幼苗缓解作用效果较明显,其中100 μmol·L-1SNP效果更为显著.然而,200、300 μmol·L-1SNP对铝毒害幼苗的缓解作用下降.这与外源NO的双重生理效应有关,即低浓度NO在防御反应中起保护作用,高浓度NO会对植物体产生严重伤害[18].Atienzar等研究表明,环境污染物会诱导生物体细胞内发生DNA损伤和突变,导致引物结合位点的核苷酸缺失或增加,最终影响基因图谱变化[11].在铝胁迫下,SRAP引物扩增得到的大麦幼苗根SRAP图谱表现为SRAP条带的增多、减少、变亮和变暗.SRAP条带在0、50、100、200、300 μmol·L-1SNP处理的幼苗根系中均有所改变,部分条带变化较为明显.以上结果说明大麦基因稳定性发生较大变化,基因组模板发生改变.与生理测定结果相符的是,50 μmol·L-1和100 μmol·L-1的SNP SRAP图谱与Control相似,GTS较高,即基因组模板稳定性较好,且部分条带亮度增加.这说明SNP对铝毒害大麦DNA损伤或修复系统有较好的缓解作用.
近年来研究发现,外源NO除缓解决明子[4]、红芸豆[19]和小麦[20]等植物受到的铝胁迫外,也可缓解镉胁迫[2]、氯化钠胁迫[21]、干旱胁迫[22]等对植株的毒害作用.本研究通过探究不同浓度的外源SNP对铝毒害大麦的缓解作用确定适宜浓度,为有效应对酸性土壤面积扩大对作物种植产生的不良影响,改善作物的生长环境和产量提供理论基础.
