无过渡金属参与光催化1,2-氨基醇的绿色合成
2021-03-05金鑫煜潘舒蕾胡凯霞王雅晨尉凯航郑梦蕾曾晓飞
金鑫煜,周 宇,潘舒蕾,胡凯霞,王雅晨,尉凯航,郑梦蕾,曾晓飞
(杭州师范大学材料与化学化工学院,浙江 杭州 311121)
1,2-氨基醇是一种重要的化学骨架,广泛地存在于众多具有生物和化学活性的天然产物[1]、药物中间体[2]及某些具有特殊功能的化学材料中,例如抗艾滋病药物奈非那韦(Nelfinavir)[3]、抗肿瘤药物Hapalosin[4]等.此外,氨基醇类化合物也可作为辅剂和配体[5-6],广泛应用于化工、材料、医药、合成等领域[7].因此研究温和、环保、高效的合成方法来制备氨基醇类化合物一直是化学领域的热点之一.
在氨基醇的传统制备中,最经典的方法是利用α-氨基酸还原制备β-氨基醇.由氨基酸经氢化锂铝等还原剂可直接还原得到氨基醇,但这往往需要使用大量的还原剂.而催化加氢还原法条件较为苛刻,需利用Ru、Rh、Re等贵金属催化剂或其二元复合金属催化剂等,在高温高压下才能合成1,2-氨基醇[8].此外,由氨基酸直接还原只能得到伯醇,无法获得含有仲醇以及叔醇等官能团的氨基醇类化合物.
在过去的10年中,可见光的光氧化还原催化策略已经发展成为一种强大的手段,其在碳-碳键或碳-杂键构建中的应用得到了快速的发展.直接光氧化还原催化实现1,2-氨基醇合成得到了化学家的关注.例如,2013年,Rono等[9]使用过渡金属Ir络合物和手性磷酸作为催化剂催化酮和腙的不对称还原偶联,通过协调的质子偶联电子转移,得到了高非对映和对映选择性的1,2-氨基醇衍生物.2018年,Ye等[10]利用双金属存在下的Lewis 酸和光协同催化,发展了一个操作简便、条件温和、底物适用范围较广、化学选择性和立体选择性优异的不对称自由基偶联反应,成功地实现了氨基醇的不对称合成.但这些反应通常需要使用贵金属催化剂,且反应时间较长,仍存在一定的局限性.因此,研究如何在非金属光催化剂的作用下高效简便地实现1,2-氨基醇类衍生物的合成,有着重要的科学意义和潜在的应用价值.
在前期研究[11-12]基础上,本研究设想利用一种合适的非金属光催化剂,通过光催化自由基偶联策略,从缩短反应时间、经济和环境友好的角度出发,实现1,2-氨基醇衍生物的绿色合成.本研究选用苯甲醛、N-苯基甘氨酸作为模板反应的原料,对光催化剂、溶剂、反应时间等条件进行筛选和优化,在得到最佳反应条件的基础上,对羰基化合物进行底物适用性的考察,制备了一系列含不同取代基的1,2-氨基醇类化合物.
1 实验部分
1.1 主要仪器及试剂
核磁共振仪(Bruker公司,500 MHz,TMS内标,CDCl3为溶剂),高分辨质谱仪(Agilent 5975),数字化熔点测定仪(SGWX-4A),TLC用硅胶板(厚度0.2 mm),柱层析用硅胶(200~300目).
洗脱剂为石油醚及乙酸乙酯,实验所需试剂及催化剂均为市售分析纯试剂,使用时无须进一步纯化处理.
1.2 实验方法
取洁净且干燥的10 mL试管,依次加入光催化剂4CzIPN(0.001 mmol)、N-苯基甘氨酸2a(0.2 mmol),醛类化合物1(0.1 mmol)、乙腈(溶剂,1 mL).将试管口用橡胶塞封闭,并缠绕上封口胶,使之形成一个密闭体系,并通过抽气泵对反应体系连续抽换气3次,使反应体系处于氩气氛状态.将反应混合物在蓝色LED灯(λmax=450~455 nm)照射下,于室温搅拌反应1 h.待反应完成后,用二氯甲烷(少量多次)将反应混合物转移至茄形瓶中,减压蒸干溶剂后用石油醚-乙酸乙酯为洗脱剂,300目柱层析硅胶为填料,柱层析分离提纯得到目标产物3.
2 结果与讨论
2.1 反应条件优化
以苯甲醛1a和N-苯基甘氨酸2a为模板反应(表1)进行研究.

表1 反应条件的优化Tab.1 Optimization of reaction conditions
首先对3种不同的非金属光敏剂进行探究(条目1-3),发现选用4CzIPN作为光催化剂时,得到18%的产率.随后,对反应溶剂进行筛选(条目4-6),发现当以乙腈作为反应溶剂时,产率有了非常明显的提高(87%).对光催化剂用量的考察(条目7-9)表明,当光催化剂4CzIPN的摩尔分数为0.5%时,产率有了较明显的降低(47%);摩尔分数增加至1.0%和1.5%时,产率相差不大;而再增加催化剂的摩尔分数会使最终产物中混有光催化剂,且不易分离.综合考虑光催化剂的成本和环境友好性,确定4CzIPN的摩尔分数为1.0%.同时,研究发现在反应原料n(1a)∶n(2a)为1∶2 (条目 10) 时,产率最高,故确定原料的摩尔比为1∶2.对反应时间的优化实验(条目11-12)显示,光照10 min时反应液的颜色仍呈亮黄色,反应只生成极少量的产物;当反应时间为60 min时,产率相对于反应时间为30 min时有了一定的提高,故最终预设反应时间为60 min.
2.2 底物的拓展
在确定最佳反应条件后,对一系列的苯甲醛衍生物(图1)进行适用性探究.各种取代的苯甲醛都能够在最优条件下顺利地生成目标产物,并能得到中等到好的收率.当苯环上连有给电子取代基如甲基(3b、3d、3e)、甲氧基(3g、3h、3i)、乙基(3c)、叔丁基(3f)时,产物收率都较高.若苯环上连有弱吸电子基团时(3j-3n),产物仍可得到良好到优异的产率(61%~98%).
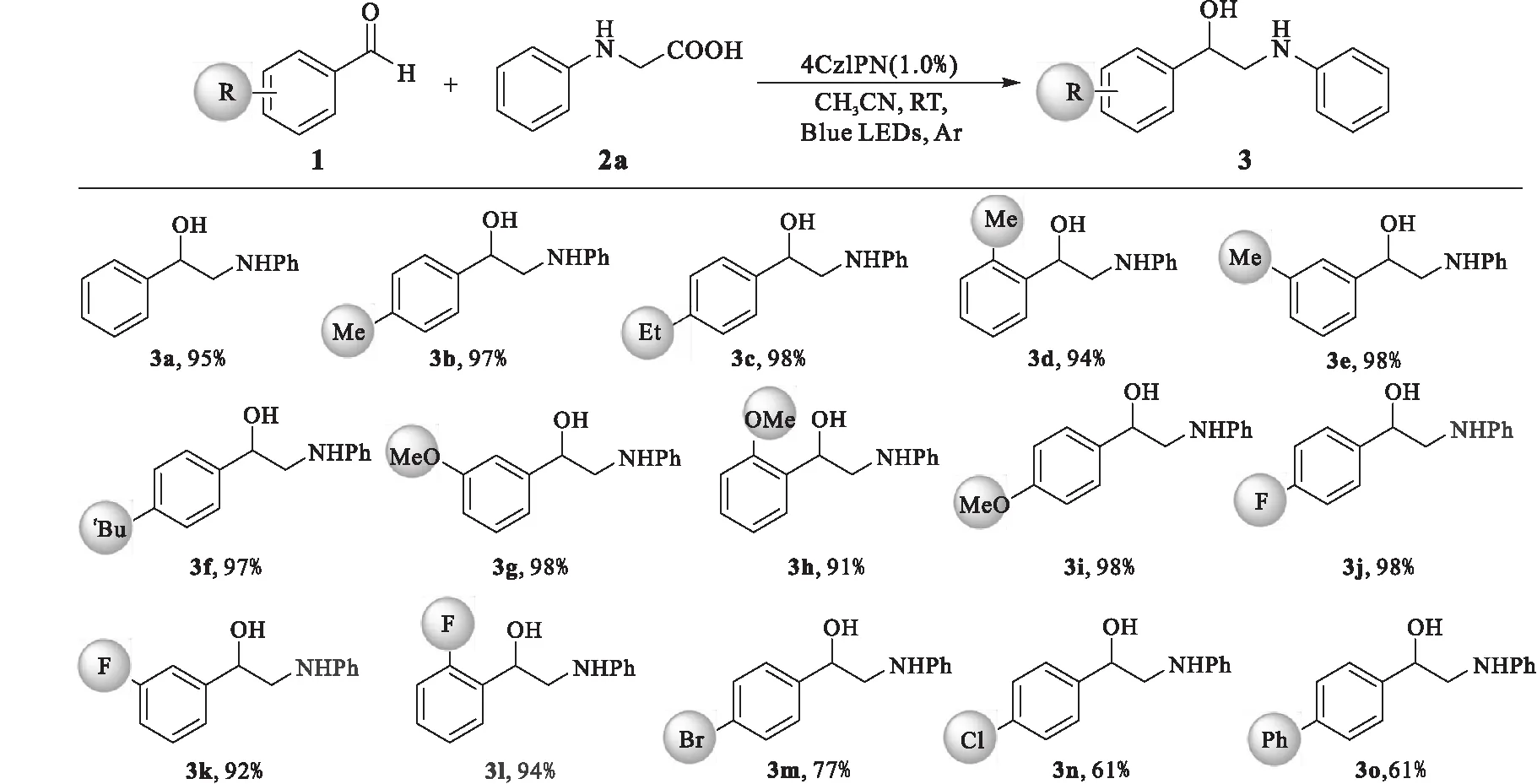
图1 底物拓展Fig.1 Substrate scope extention
此外,研究发现,除苯甲醛衍生物外,2-萘醛、2-噻吩甲醛、正戊醛和苯乙酮均能顺利地与N-苯基甘氨酸发生脱羧自由基偶联反应(图2),以良好产率得到相应的目标产物(3p—3s, 59%~79%),这进一步扩大了底物适用性范围.

图2 N-苯基甘氨酸与羰基化合物的自由基偶联反应Fig.2 Radical coupling of N-phenyl glycine with carbonyl compounds
为进一步理解反应过程,本研究对反应机理进行了探索,结果如图3所示.当向模板反应中加入3摩尔倍数的2,2,6,6-四甲基哌啶氧化物(TEMPO),反应被抑制,目标产物的产率显著降低(13%).另外,通过高分辨质谱仪对反应液进行检测,成功捕捉到2,2,6,6-四甲基哌啶-1-醇(4)、N1,N2-二苯基乙烷-1,2-二胺(5)和频哪醇衍生物(6)的分子离子峰,证明反应过程生成了α-氨基自由基中间体以及醛基自由基中间体.
根据机理探究实验结果及前人工作的报道,笔者推测反应是按如下机理(图4)进行的:在蓝光辐照下,4CzIPN光催化剂从基态跃迁到激发态.激发态[4CzIPN]*轻松氧化2a,通过消除二氧化碳生成α-氨基A.随后生成的[4CzIPN]-·进一步还原醛1a,得到自由基中间体B.最后,自由基中间体B与α-氨基自由基A发生偶联,得到所需的氨基醇3a.光催化剂4CzIPN转变为基态,完成催化循环.

图3 反应机理探究Fig.3 Mechanism exploration图4 推测的机理Fig.4 Proposed mechanism
2.3 产物结构分析
3a:黄色液体,收率95%.1H NMR (500 MHz,CDCl3) δ 7.36 (d,J=4.4 Hz,4H),7.30 (m, 1H),7.17(dd,J=8.4,7.5 Hz,2H),6.73 (t,J=7.3 Hz,1H),6.63 (d,J=7.7 Hz,2H),4.84 (dd,J=8.7,3.9 Hz,1H),3.36 (dd,J=13.1,3.9 Hz,1H),3.23 (dd,J=13.1,8.7 Hz,1H);13C NMR (125 MHz,CDCl3) δ 147.9,142.1,129.4,128.7,128.1,126.0,118.2,113.6,72.5,51.8; HRMS (ESI+) calcd for C14H16NO (M+H)+,m/z214.122 6,found 214.122 3.
3b:黄色液体,收率97%.1H NMR (500 MHz,CDCl3) δ 7.28~7.26 (m,2H),7.19~7.16 (m,4H),6.75~6.72 (m,1H),6.66~6.64 (m,2H),4.87~4.84 (m,1H),3.96 (s,1H),3.37 (dt,J=13.0,3.7 Hz,1H),3.29~3.24 (m,1H),2.56 (s,1H),2.36 (d,J=3.0 Hz,3H);13C NMR (125 MHz,CDCl3) δ 148.0,139.1,137.8,129.4,129.4,126.0,118.1,113.5,72.4,51.8,21.2; HRMS (ESI+) calcd for C15H18NO (M+H)+,m/z228.138 3,found 228.138 2.
3c:黄色液体,收率98%.1H NMR (500 MHz,CDCl3) δ 7.24~7.13 (m,6H),6.71 (t,J=7.3 Hz,1H),6.59 (d,J=8.3 Hz,2H),4.77 (dd,J=8.4,3.5 Hz,1H),3.43~3.28 (m,3H),3.19 (dd,J=12.4,8.8 Hz,1H),2.63 (q,J=7.6 Hz,2H),1.22 (t,J=7.6 Hz,3H);13C NMR (125 MHz,CDCl3) δ 148.0,144.2,139.5,129.4,128.2,126.1,118.1,113.6,72.4,51.8,28.7,15.7; HRMS (ESI+) calcd for C16H20NO (M+H)+,m/z242.153 9,found 242.153 8.
3d:黄色固体,收率:94%,m.p. 79.6~81.2 ℃.1H NMR (500 MHz,CDCl3) δ 7.54 (d,J=7.4 Hz,1H),7.28~7.16 (m,5H),6.75 (t,J=6.8 Hz,1H),6.68 (d,J=7.0 Hz,2H),5.15 (d,J=8.9 Hz,1H),4.02 (s,1H),3.41 (d,J=13.2 Hz,1H),3.27~3.16 (m,1H),2.37 (s,4H);13C NMR (125 MHz,CDCl3) δ 148.0,140.1,134.7,130.6,129.4,127.8,126.5,125.5,118.2,113.5,69.2,50.6,19.2; HRMS (ESI+) calcd for C15H18NO (M+H)+,m/z228.138 3,found 228.138 0.
3e:黄色液体,收率98%.1H NMR (500 MHz,CDCl3) δ 7.29~7.23 (m,1H),7.21~7.18 (m,4H),7.13 (d,J=7.2 Hz,1H),6.76~6.73 (m,1H),6.67 (dd,J=8.3,2.4 Hz,2H),4.87~4.86 (m,1H),4.03 (s,1H),3.40 (dt,J=13.1,3.6 Hz,1H),3.30~3.25 (m,1H),2.49 (s,1H),2.37 (d,J=2.9 Hz,3H);13C NMR (125 MHz,CDCl3) δ 148.0,142.0,138.4,129.4,128.8,128.6,126.6,123.0,118.1,113.5,72.5,51.8,21.5; HRMS (ESI+) calcd for C15H18NO (M+H)+,m/z228.138 3,found 228.138 7.
3f:黄色液体,收率97%.1H NMR (500 MHz,CDCl3) δ 7.37 (dd,J=8.2,2.1 Hz,2H),7.29~7.27 (m,2H),7.16 (t,J=6.7 Hz,2H),6.72 (t,J=6.2 Hz,1H),6.62 (d,J=7.0 Hz,2H),4.82 (dd,J=5.5,2.9 Hz,1H),3.66 (s,2H),3.36~3.33 (m,1H),3.26~3.23 (m,1H),1.31 (d,J=2.6 Hz,9H);13C NMR (125 MHz,CDCl3) δ 151.1,148.0,139.1,129.4,125.8,125.6,118.2,113.6,72.3,51.7,34.7,31.5; HRMS (ESI+) calcd for C18H24NO (M+H)+,m/z270.185 2,found 270.185 6.
3g:黄色液体,收率98%.1H NMR (500 MHz,CDCl3) δ 7.30 (dd,J=11.3,4.8 Hz,1H),7.18 (t,J=7.0 Hz,2H),6.96 (s,2H),6.85 (d,J=7.6 Hz,1H),6.74 (t,J=7.2 Hz,1H),6.66 (d,J=7.6 Hz,2H),4.87 (dd,J=7.9,3.0 Hz,1H),3.99 (s,1H),3.81 (s,3H),3.40 (dd,J=12.6,3.1 Hz,1H),3.27 (dd,J=12.4,9.3 Hz,1H),2.56 (s,1H);13C NMR (125 MHz,CDCl3) δ 160.0,147.9,143.8,129.7,129.4,118.2,118.2,113.5,113.4,111.5,72.4,55.3,51.8; HRMS (ESI+) calcd for C15H18NO2(M+H)+,m/z244.133 2,found 244.133 2.
3h:黄色液体,收率91%.1H NMR (500 MHz,CDCl3) δ 7.40 (dd,J=7.5,1.3 Hz,1H),7.27 (td,J=8.2,1.6 Hz,1H),7.17 (dd,J=8.4,7.5 Hz,2H),6.98 (t,J=7.4 Hz,1H),6.89 (d,J=8.2 Hz,1H),6.73~6.68 (m,3H),5.14 (dd,J=8.8,3.4 Hz,1H),4.14 (s,1H),3.85 (s,3H),3.49 (dd,J=13.0,3.6 Hz,1H),3.22 (dd,J=12.9,8.8 Hz,1H),2.92 (s,1H);13C NMR (125 MHz,CDCl3) δ 156.5,148.2,129.9,129.3,128.8,127.0,121.0,117.7,113.4,110.5,69.0,55.4,50.1; HRMS (ESI+) calcd for C15H18NO2(M+H)+,m/z244.133 2,found 244.133 8.
3i:黄色液体,收率98%.1H NMR (500 MHz,CDCl3) δ 7.30 (d,J=8.3 Hz,2H),7.18 (t,J=7.4 Hz,2H),6.89 (d,J=8.3 Hz,2H),6.73 (t,J=7.0 Hz,1H),6.64 (d,J=8.0 Hz,2H),4.83 (dd,J=8.2,3.5 Hz,1H),4.39~3.80 (m,4H),3.35 (dd,J=12.9,3.7 Hz,1H),3.26 (dd,J=12.8,8.7 Hz,1H),2.58 (s,1H);13C NMR (125 MHz,CDCl3) δ 159.4,148.0,134.2,129.4,127.2,118.1,114.1,113.5,72.1,55.4,51.7;HRMS (ESI+) calcd for C15H18NO2(M+H)+,m/z244.133 2,found 244.133 8.
3j:黄色液体,收率98%.1H NMR (500 MHz,CDCl3) δ 7.33~7.31 (m,2H),7.18 (t,J=7.3 Hz,2H),7.03 (t,J=8.6 Hz,2H),6.75 (t,J=7.3 Hz,1H),6.64 (d,J=8.3 Hz,2H),4.83 (dd,J=8.6,3.5 Hz,1H),3.33 (ddd,J=13.1,3.7,1.0 Hz,1H),3.21 (ddd,J=13.2,8.8,1.1 Hz,1H);13C NMR (125 MHz,CDCl3) δ 162.5 (d,J=244.5 Hz),147.8,137.8 (d,J=6.1 Hz),129.4,127.6 (d,J=8.1 Hz),118.3,115.5 (d,J=21.3 Hz),113.5,71.8,51.9;19F NMR (470 MHz,CDCl3) δ -114.3; HRMS (ESI+) calcd for C14H15FNO (M+H)+,m/z232.113 2,found 232.113 0.
3k:黄色液体,收率92%.1H NMR (500 MHz,CDCl3) δ 7.33~7.29 (m,1H),7.18 (t,J=7.8 Hz,2H),7.11 (t,J=9.9 Hz,2H),6.98 (td,J=8.5,2.3 Hz,1H),6.75 (t,J=7.3 Hz,1H),6.64 (d,J=8.1 Hz,2H),4.85 (dd,J=8.7,3.7 Hz,1H),3.37 (dd,J=13.3,3.7 Hz,1H),3.20 (dd,J=13.3,8.7 Hz,1H);13C NMR (125 MHz,CDCl3) δ 164.0 (d,J=245.0 Hz),147.7,144.7 (d,J=6.7 Hz),130.2 (d,J=8.1 Hz),129.5,121.5 (d,J=2.8 Hz),118.42,114.8 (d,J=21.1 Hz),113.58,112.9 (d,J=21.8 Hz),71.8 (d,J=1.5 Hz),51.78;19F NMR (470 MHz,CDCl3) δ -112.4; HRMS (ESI+) calcd for C14H15FNO (M+H)+,m/z232.113 2,found 232.113 2.
3l:黄色固体,收率94%,m.p. 83.2~83.8 ℃.1H NMR (500 MHz,CDCl3) δ 7.53 (t,J=7.3 Hz,1H),7.29~7.16 (m,4H),7.08~7.03 (m,1H),6.78~6.69 (m,3H),5.22~5.20 (m,1H),3.91 (s,1H),3.52~3.48 (m,1H),3.22~2.93 (m,2H);13C NMR (125 MHz,CDCl3) δ 159.8 (d,J=243.8 Hz),147.7,129.4,129.3 (d,J=8.1 Hz),129.0 (d,J=13.4 Hz),127.4 (d,J=4.2 Hz),124.5 (d,J=3.0 Hz),118.25,115.4 (d,J=21.5 Hz),113.5,66.6,50.6;19F NMR (470 MHz,CDCl3) δ -119.0; HRMS (ESI+) calcd for C14H15FNO (M+H)+,m/z232.113 2,found 232.113 3.
3m:黄色液体,收率77%.1H NMR (500 MHz,CDCl3) δ 7.47 (d,J=8.3 Hz,2H),7.23~7.17 (m,4H),6.75 (t,J=7.3 Hz,1H),6.63 (d,J=7.9 Hz,2H),4.80 (dd,J=8.7,3.7 Hz,1H),3.94 (s,1H),3.33 (dd,J=13.3,3.8 Hz,1H),3.18 (dd,J=13.3,8.7 Hz,1H),2.82 (s,1H);13C NMR (125 MHz,CDCl3) δ 147.7,141.0,131.8,129.5,127.7,121.8,118.4,113.6,71.8,51.8; HRMS (ESI+) calcd for C14H15BrNO (M+H)+,m/z292.033 2,found 292.033 3.
3n:黄色液体,收率61%.1H NMR (500 MHz,CDCl3) δ 7.34~7.29 (m,4H),7.18 (t,J=7.8 Hz,2H),6.75 (t,J=7.3 Hz,1H),6.64 (d,J=8.0 Hz,2H),4.84 (dd,J=8.6,3.8 Hz,1H),3.91 (s,1H),3.35 (dd,J=13.3,3.8 Hz,1H),3.21 (dd,J=13.2,8.7 Hz,1H),2.76 (s,1H);13C NMR (125 MHz,CDCl3) δ 147.7,140.5,133.7,129.4,128.8,127.3,118.4,113.5,71.8,51.8; HRMS (ESI+) calcd for C14H15ClNO (M+H)+,m/z248.083 7,found 248.083 7.
3o:白色固体,产率61%,m.p. 93.3~95.0 ℃.1H NMR (500 MHz,CDCl3) δ 7.58 (d,J=8.0 Hz,4H),7.43 (d,J=7.6 Hz,4H),7.34 (t,J=7.3 Hz,1H),7.18 (t,J=7.2 Hz,2H),6.75 (t,J=7.0 Hz,1H),6.66 (d,J=7.8 Hz,2H),4.90 (dd,J=8.1,3.0 Hz,1H),3.97 (s,1H),3.41 (dd,J=12.6,3.1 Hz,1H),3.29 (dd,J=12.1,8.7 Hz,1H),2.75 (s,1H);13C NMR (125 MHz,CDCl3) δ 147.9,141.1,141.0,140.8,129.5,128.9,127.5,127.4,127.2,126.4,118.3,113.6,72.3,51.8; HRMS (ESI+) calcd for C20H20NO (M+H)+,m/z290.153 9,found 290.153 7.
3p:白色固体,产率62%,m.p. 77.6~79.3 ℃.1H NMR (500 MHz,CDCl3) δ 7.84~7.81 (m,4H),7.49~7.47 (m,3H),7.19 (dd,J=8.5,7.4 Hz,2H),6.75 (t,J=7.3 Hz,1H),6.67 (d,J=7.7 Hz,2H),5.04 (dd,J=8.5,3.9 Hz,1H),3.47 (dd,J=13.2,4.0 Hz,1H),3.35 (dd,J=13.2,8.5 Hz,1H);13C NMR (125 MHz,CDCl3) δ 147.9,139.4,133.3,133.2,129.4,128.5,128.0,127.8,126.4,126.1,124.9,123.9,118.3,113.6,72.6,51.7; HRMS (ESI+) calcd for C18H18NO (M+H)+,m/z264.138 3,found 264.138 2.
3q:黄色液体,收率79%.1H NMR (500 MHz,CDCl3) δ 7.24 (dd,J=4.2,1.9 Hz,1H),7.18~7.15 (m,2H),6.97 (s,2H),6.73 (t,J=6.8 Hz,1H),6.62 (d,J=7.6 Hz,2H),5.07 (dd,J=7.9,4.0 Hz,1H),3.46~3.32 (m,4H);13C NMR (125 MHz,CDCl3) δ 147.7,145.7,129.4,126.9,125.1,124.3,118.3,113.6,68.6,51.7; HRMS (ESI+) calcd for C12H14NOS (M+H)+,m/z220.079 1,found 220.078 2.
3r:黄色液体,收率59%.1H NMR (500 MHz,CDCl3) δ 7.18 (dd,J=8.5,7.4 Hz,2H),6.73 (t,J=7.3 Hz,1H),6.66 (d,J=7.7 Hz,2H),3.86~3.81 (m,1H),3.27 (dd,J=12.9,3.2 Hz,1H),3.01 (dd,J=12.9,8.6 Hz,1H),1.56~1.46 (m,3H),1.41~1.33 (m,3H),0.93 (t,J=7.1 Hz,3H);13C NMR (125 MHz,CDCl3) δ 148.3,129.3,117.9,113.3,70.4,50.4,34.8,27.8,22.8,14.1; HRMS (ESI+) calcd for C12H19NO (M+H)+,m/z194.153 9,found 194.154 3.
3s: 黄色液体,收率69%.1H NMR (500 MHz,CDCl3) δ 7.50 (d,J=8.1 Hz,2H),7.39 (t,J=7.7 Hz,2H),7.29 (t,J=7.3 Hz,1H),7.16 (t,J=7.9 Hz,2H),6.73 (t,J=7.3 Hz,1H),6.64 (d,J=7.7 Hz,2H),3.49~3.43 (m,2H),2.68 (s,1H),1.61~1.59 (m,4H);13C NMR (125 MHz,CDCl3) δ 147.7,145.8,129.3,128.6,127.2,125.0,118.9,114.3,74.1,56.0,28.2; HRMS (ESI+) calcd for C15H17NO (M+H)+,m/z228.138 3,found 228.137 9.
3 结论
在室温光照下,以乙腈为溶剂,4CzIPN作为非金属光催化剂,成功地建立了苯甲醛及其衍生物与N-苯基甘氨酸的脱羧自由基偶联反应,提供了一个能够快速获得各种β-氨基醇的方法,为药物中间体等的合成提供了一种新思路.本反应通过光诱导的方式产生自由基,反应条件温和,操作简便,痕量的CO2为副产物,原子经济性高,且对苯甲醛衍生物适用范围广,符合绿色化学的发展概念.
