镉胁迫对海菜花种子萌发及幼苗初期生理生化的影响
2017-03-21陈祖拥范菲菲官小云
陈祖拥+范菲菲+官小云

摘要:通过营养液培养法,研究Cd2+对海菜花种子萌发及幼苗初期叶绿素含量、抗氧化酶活性及可溶性蛋白质含量的影响。结果表明,各浓度(0.1~2.0 mg/L)Cd2+处理抑制海菜花种子的萌发,但与对照无显著差异(P>0.05);海菜花种子的发芽势、发芽指数、活力指数整体随Cd2+处理浓度的增大而下降,当Cd2+处理浓度较高时,与对照差异显著(P<0.05)。Cd2+胁迫明显降低海菜花叶片中叶绿素a、叶绿素b、类胡萝卜素含量,且与对照差异显著(P<0.05)。随着Cd2+浓度增大,超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性蛋白质含量先升高后降低;过氧化氢酶(CAT)活性呈持续降低趋势,且与对照差异显著(P<0.05)。随Cd2+胁迫浓度增大,其对海菜花的毒害作用增强。
关键词:镉胁迫;海菜花;萌发;叶绿素;抗氧化酶系统;可溶性蛋白质;毒害
中图分类号: X522 文献标志码: A
文章编号:1002-1302(2016)11-0482-03
在云贵高原分布有我国特有的三级重点保护高原淡水植物海菜花(Ottelia acuminata var. acuminata),其对水质要求很高,对水生生态系统具有重要的生态指示作用。由于人类活动的增强,工业“三废”排放,农业化肥、农药等的大量使用和城市垃圾的肆意堆放,使生态系统中的重金属污染日益加剧[1],导致海菜花数量急剧减少,而重金属对海菜花种子发芽的毒害作用还鲜见报道。本研究选用毒性较强,且在贵州省具有较高土壤背景值[2]的Cd2+为代表,研究重金属Cd2+对海菜花种子萌发和幼苗生长初期生理生化的影响,以期初步揭示Cd2+对海菜花的生态毒理效应。
1 材料与方法
1.1 材料
供试海菜花种子采自贵州省贵阳市花溪区花溪水库下游花溪河段,挑选籽粒饱满、大小均匀的种子用于试验。CdCl2·2.5H2O 购自国药集团上海化学试剂公司,各分析纯、生化纯试剂都用超纯水配制。
1.2 试验设计
用CdCl2·2.5H2O(分析纯)和1/10浓度Hoagland营养液,分别配制0、0.1、0.2、0.5、1.0、2.0 mg/L Cd2+处理液,分别将等体积的该处理液置于铺有2层滤纸、直径9 cm的培养皿中,分别挑选饱满的海菜花种子各20粒平铺于滤纸上,盖好玻璃培养皿,置于温度(25±1) ℃、光照度2 000 lx、14 h/d、湿度80%的人工气候培养箱中进行萌发试验,每个处理3次重复。每天添加适量的超纯水补偿蒸发的水分,保持滤纸湿润但不淹水。以胚根露出种皮时记录为发芽种子[3],培养14 d后测定叶绿素、类胡萝卜素、可溶性蛋白质含量,同时测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性。
1.3 分析方法
1.3.1 发芽指标计算方法 发芽指标计算方法如下:
发芽率(GR)=14 d内正常发芽的种子数/供试种子数×100%;
发芽势(GP)=萌发前7 d发芽数之和/供试种子数×100%;
发芽指数(GI)=∑(Gt/Dt)。
式中:Gt为第t天的发芽数;Dt为相应发芽时间。
活力指数=GI×S。
式中:S为幼苗平均总长度[4]。
1.3.2 叶绿素、类胡萝卜素含量测定 取各处理幼苗,用80%丙酮溶液提取,用分光光度计测定提取液在665、649、470 nm处的吸光度[5]。
1.3.3 SOD、POD、CAT活性和可溶性蛋白质含量的测定 取各处理幼苗,加入少量0.1 mol/L磷酸缓冲液(pH值7.8),置冰浴研磨匀浆,4 ℃、12 000 r/min离心15 min,上清液用于酶活性和可溶性蛋白含量的测定。SOD活性的测定采用NBT光化还原法[5],POD活性的测定采用愈创木酚法[5],CAT活性的测定采用南京建成科技有限公司CAT试剂盒测定,可溶性蛋白质含量的测定采用考马斯亮蓝G-250法[6]。
1.4 数据处理与分析
用SPSS 13.0软件对试验数据进行统计分析,显著性水平设置为0.05水平;用Origin 2015软件绘制变化趋势图。
2 结果与分析
2.1 镉胁迫对海菜花种子发芽的影响
如表1所示,在试验浓度范围内,Cd2+胁迫对海菜花种子发芽率具有一定抑制作用,但与对照无显著差异(P>0.05);不同Cd2+胁迫下海菜花种子发芽势、发芽指数、活力指数的变化趋势类似,整体表现出随Cd2+处理浓度的增大呈下降趋势,当Cd2+处理浓度较高时,其发芽势、发芽指数、活力指数与对照差异显著(P<0.05)。
2.2 镉胁迫对海菜花幼苗生长的影响
从表2可知,随着Cd2+浓度增大,海菜花幼苗长度、根长逐渐减小,且与对照差异显著(P<0.05);当Cd2+浓度达到2.0 mg/L时,海菜花平均苗长仅为对照的7.4%,根的生长被完全抑制,没有明显的根系生成。Cd2+浓度≤0.5 mg/L时,Cd2+对幼苗叶片数无显著影响;当Cd2+浓度≥1.0 mg/L时,海菜花幼苗叶片数随Cd2+离子浓度增大而显著减少(P<0.05)。海菜花平均根数隨Cd2+浓度增大呈减少趋势,当Cd2+为0.1 mg/L时,海菜花平均根数与对照无显著差异;当Cd2+≥0.2 mg/L时,海菜花平均根数均与对照差异显著(P<0.05)。由此说明,随着Cd2+胁迫浓度增大,Cd2+对海菜花幼苗生长的抑制作用增强。
2.3 镉胁迫对海菜花光合色素含量的影响
叶绿素含量在很大程度上反映了植物的光合作用能力,叶绿素与光合速率、营养状况关系密切,逆境条件下,叶绿素含量是表征植物受伤害程度的指标之一。类胡萝卜素是植物细胞中重要的辅助色素,在光合作用过程中能够激发活性氧的清除,保护细胞器免受伤害[4]。如表3所示,在Cd2+浓度为0.1~2.0 mg/L时,海菜花幼苗中叶绿素a、叶绿素b、类胡萝卜素含量随Cd2+处理浓度增大而降低;当Cd2+浓度为 2.0 mg/L 时,叶绿素a、叶绿素b、类胡萝卜素含量分别仅为对照的1.7%、6.6%、2.7%,可见高浓度Cd2+显著抑制了叶绿素、类胡萝卜素的合成。
2.4 镉胁迫对海菜花幼苗中抗氧化酶系统的影响
SOD、POD、CAT等3种抗氧化酶活性与植物抵御外界胁迫能力密切相关。由表4可知,随着Cd2+浓度增大,海菜花幼苗中SOD活性整体表现出先升高后降低的趋势,Cd2+胁迫下的海菜花幼苗SOD活性高于对照(P<0.05)。当Cd2+浓度为0.5 mg/L时,SOD活性最大,为对照的8.78倍;当Cd2+浓度为2.0 mg/L时,SOD活性仍为对照的2.46倍。海菜花幼苗中POD活性变化规律与SOD相似,随着Cd2+浓度增大,POD活性也呈现先升高后降低的趋势,当Cd2+浓度为 0.5 mg/L 时,POD活性最大,为对照的2.29倍,与对照差异显著(P<0.05);随着Cd2+浓度的继续增大,POD活性开始下降,当Cd2+浓度为2.0 mg/L时,其活性与对照无显著差异。由此可见,SOD的耐受性比POD强。海菜花幼苗中CAT活性的变化规律与SOD、POD活性不同,随Cd2+浓度增大而逐渐降低,且均与对照差异显著(P<0.05)。当Cd2+浓度为2.0 mg/L时,海菜花幼苗的CAT活性被抑制了85.9%,由此可见,CAT对Cd2+胁迫的耐受性较差。
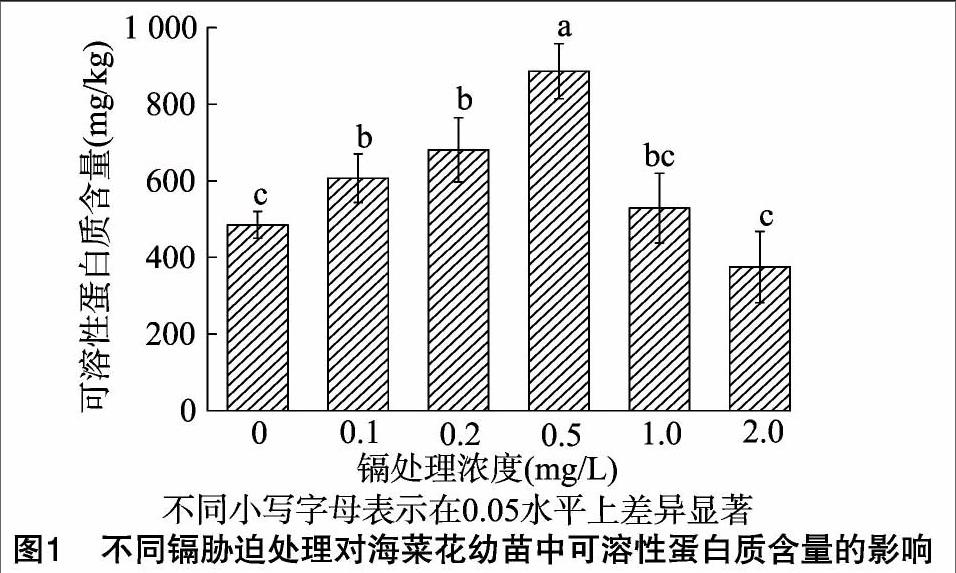
2.5 镉胁迫对海菜花幼苗中可溶性蛋白质含量的影响
植物体内的可溶性蛋白质主要是参与各种代谢的酶类,其含量是植物的重要生理指标之一。由图1可见,随着Cd2+处理浓度增大,海菜花幼苗中可溶性蛋白质含量表现出先升高后降低的趋势,在Cd2+处理浓度为0.5 mg/L时,海菜花幼苗中可溶性蛋白质含量最大,且与对照差异显著(P<0.05);随着Cd2+处理浓度的继续增大,可溶性蛋白质含量开始下降,当Cd2+处理浓度为2.0 mg/L时,可溶性蛋白质含量与对照无显著差异。由此表明,海菜花在受Cd2+胁迫时,体内能产生一些抗性蛋白抵御外界胁迫;但处于高浓度Cd2+胁迫时,这种抵御机制受到破坏,可溶性蛋白质含量降低。随着镉胁迫浓度增大,SOD、POD活性先升高后降低的变化趋势也证明了可溶性蛋白质含量的这种变化规律。
3 结论与讨论
本研究表明,各浓度Cd2+胁迫对海菜花种子的发芽率整体表现出抑制作用,这与Cd2+抑制紫羊茅[7]、白三叶[7]、亚麻[8]种子萌发的报道一致;而与低浓度Cd2+诱导、高浓度Cd2+抑制碱蓬[9]、黑麦草[10]等种子萌发的报道不同。种子萌发前期阶段主要利用种子自身储存的营养物质,外部污染物质须要通过种皮进入其内部才能参与萌发的前期过程。可能由于Cd2+在短期内较难通过海菜花种皮,所以对其发芽率抑制作用不显著,这说明海菜花种子种皮的自我防御能力较强。海菜花种子的发芽势、发芽指数、活力指数随着外源Cd2+浓度的增大呈逐渐降低趋势,在高浓度Cd2+处理时与对照差异显著,这与Cd2+对紫羊茅[7]、白三叶[7]、黑麦草[10]种子萌发试验结果一致。这说明高浓度Cd2+对海菜花种子萌发具有抑制作用,可能是高浓度Cd2+能部分通过种皮进入种子内部,抑制海菜花种子萌发。
植物幼苗生长和种子萌发过程中营养物质利用途径不同,因此幼苗生长过程的Cd2+胁迫与发芽阶段的Cd2+胁迫影响不同。Cd2+胁迫对海菜花幼苗的芽长、根长、叶片数、根数均有不同程度的影响,高浓度Cd2+胁迫对海菜花幼苗的芽长、根长、叶片数、根数有显著的抑制作用,这与Cd2+对早熟禾[7]、紫羊茅[7]、白三叶[7]、亚麻[8]、黑麦草[10]影响的相关研究结果一致。由于重金属对植物的伤害首先表现在对幼苗根部的伤害[11],所以Cd2+对根的抑制作用大于对芽的抑制作用。同时,由于胚根受到毒害,导致其对营养物质的吸收能力降低甚至消失,最终又影响芽的生长。另一方面,Cd2+可能使海菜花幼苗体内加速产生大量的活性氧,抑制各种酶活性,从而也影响到海菜花幼苗和根系的生长[12]。
重金属破坏叶绿体结构,使植物叶片叶绿素含量降低,降低光合强度,这是重金属对植物毒害的普遍现象[13]。本研究中,海菜花种子在受到Cd2+胁迫时,叶绿素a、叶绿素b、类胡萝卜素含量均下降,这与Cd2+胁迫对黑麦草[10]、烤烟[14]绿叶素的影响规律一致。其主要原因是镉抑制了叶绿素合成,降低海菜花幼苗中的叶绿素含量,减弱其光合作用,抑制其生长[10,13-14]。
SOD、POD、CAT是植物体内酶促防御系统的3个重要保护酶,它们发挥协同作用,消除活性氧,保护植物膜系统。本研究表明,随着Cd2+处理浓度的增大,SOD、POD活性都是先升后降,这与Cd2+对黑麦草[10],Cu2+对海菜花幼苗[15]叶片中SOD、POD酶活性的影响规律一致。由此表明,低浓度Cd2+对POD、SOD活性具有激活作用,随着Cd2+浓度逐渐增大,又转为抑制作用。CAT活性则随着Cd2+浓度增大而逐渐降低。由此可见,海菜花幼苗受Cd2+胁迫后抗氧化酶系统反馈机制不同,CAT、POD、SOD活性呈现不同的变化规律。陈国祥等认为,低浓度的重金属逆境胁迫会抑制植物根系对养分、水分的吸收,同时引发活性氧(ROS)积累,增强脂质过氧化作用,使得SOD、POD活性增强[16]。本研究中,在低浓度Cd2+胁迫下,海菜花为有效缓解Cd2+胁迫引起的氧化胁迫,及时清除ROS的积累,SOD、POD活性增强也充分证实了此观点。但随着Cd2+浓度的进一步增大,高濃度的Cd2+导致海菜花幼苗中活性氧等自由基的积累超过植物本身的耐受极限,转而开始抑制SOD、POD的活性。随着Cd2+浓度增大,CAT活性逐渐降低,这可能是海菜花种子CAT对Cd2+敏感,不能抵御外来污染物胁迫,这也可能是其耐受性较差的原因之一。
海菜花幼苗中的可溶性蛋白是植物细胞内未与膜系统特异结合的酶,其含量越高,说明其体内生理生化反应与代谢活性越旺盛,有利于植物抵御逆境胁迫[12]。本研究中,随着Cd2+浓度增大,可溶性蛋白质含量先升高后降低的变化趋势,与Cd2+对谷子幼苗[12]、Cu2+对海菜花幼苗[15]叶片中可溶性蛋白质的影响结果一致。究其原因,一方面可能是适量的Cd2+可以诱导合成一些新蛋白质,参与抗逆性生理活动,促进可溶性蛋白质含量的增加;另一方面,高浓度Cd2+也诱导了蛋白水解酶活性增强,加速了蛋白质水解[12],同时高浓度Cd2+胁迫导致海菜花抗氧化酶系统受损,抗性酶减少,从而导致可溶性蛋白质含量减少。
参考文献:
[1]王 磊,张 菲,王从彦,等. Cu、Cd污染背景下加拿大一枝黄花叶水提液对莴苣种子萌发和生长的生态毒理效应[J]. 生态毒理学报,2015,10(4):203-209.
[2]赵志鹏,邢 丹,刘鸿雁,等. 典型黄壤和石灰土对Cd的吸附解吸特性[J]. 贵州农业科学,2015,43(6):83-86.
[3]马海鸽,蒋 齐,王占军,等. 温度和光照对不同预处理野生甘草种子萌发和幼苗生长的影响[J]. 水土保持研究,2014,21(5):225-229,235.
[4]王秀英. 模擬酸雨对小麦种子萌发和幼苗生长的影响[J]. 水土保持研究,2014,21(6):265-270.
[5]李合生. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社,2000.
[6]张志良,瞿伟菁. 植物生理学实验指导[M]. 3版.台北:艺轩图书出版社,2009.
[7]韩宝贺,朱 宏,张艺馨. 镉对三种草坪草种子萌发与生长的影响[J]. 中国草地学报,2014,36(3):98-103.
[8]郭 媛,邱财生,龙松华,等. 镉胁迫对不同地区亚麻主栽品种种子萌发的影响[J]. 作物杂志,2015(4):146-151.
[9]王新新,吴 亮,朱生凤,等. 镉胁迫对碱蓬种子萌发及幼苗生长的影响[J]. 农业环境科学学报,2013,32(2):238-243.
[10]孙园园,张光兰,杨文杰,等. 镉胁迫对1年生黑麦草种子萌发及幼苗初期生理生化特性的影响[J]. 种子,2014,33(8):25-29.
[11]杨居荣,黄 翌. 植物对重金属的耐性机理[J]. 生态学杂志,1994,13(6):20-26.
[12]肖志华,张义贤,张喜文,等. 外源铅、铜胁迫对不同基因型谷子幼苗生理生态特性的影响[J]. 生态学报,2012,32(3):889-897.
[13]宇克莉,孟庆敏,邹金华. 镉对玉米幼苗生长、叶绿素含量及细胞超微结构的影响[J]. 华北农学报,2010,25(3):118-123.
[14]贺 远,王树声,刘海伟,等. 镉浓度对烤烟幼苗镉含量及生长和生理指标的影响[J]. 中国烟草科学,2014,35(2):37-42.
[15]朱 健,张志红,范菲菲,等. 铜胁迫对海菜花幼苗生理特征的影响[J]. 江苏农业学报,2015,31(4):883-886.
[16]陈国祥,施国新,何 兵,等. Hg、Cd对莼菜越冬芽光合膜光化学活性及多肽组分的影响[J]. 环境科学学报,1999,19(5):521-525.
