狼疮性肾炎伴血栓性微血管病1 例并文献复习
2021-03-05段旭东邱皓卢守燕
段旭东,邱皓,卢守燕
(1.西北民族大学医学院,甘肃 兰州730000;2.甘肃省人民医院肾病科,甘肃 兰州730000;3.甘肃省第二人民医院肾病科,甘肃 兰州 730000)
0 引言
系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)是一项累及全身多系统、器官的自身免疫性疾病。该病好发于女性,尤其育龄期(15 岁-40 岁)女性发病率最高,性别比最高可达11:1。肾脏是SLE 最易累及的器官,肾活检显示,肾脏受累率几乎为100%,其中有临床症状的患者约占45%-85%,称为狼疮性肾炎(Lupus nephritis, LN)[1]。血栓性微血管病(Thrombotic microangiopathy,TMA)是一类临床上少见,但能导致机体多个脏器功能障碍甚至危及生命的临床综合征。临床上LN 伴TMA 的患者较为罕见,故报道一例该病例,并结合文献复习进行讨论,以期提高临床医生对该病的认识。
1 病例资料
患者女,33 岁,因口渴、乏力、发现蛋白尿20 天于2020年1 月6 日收住甘肃省人民医院肾病科。患者入院前20 天因“感冒”于当地诊所输液、口服中药治疗后,自觉症状无明显缓解,偶有关节疼痛,无胸闷、气短,光过敏等不适。遂就诊与当地医院查:血肌酐102umol/L,白蛋白21g/L,尿蛋白++,给予对症治疗后,自觉症状未缓解。为进一步诊治,于2020年1 月来本院就诊。入院后查体:发量较少,双下肢轻度水肿,左足背部可见少量红色丘疹,突出于皮肤表面,压之不褪色,其余未见明显异常。既往史:有甲状腺功能减退病史。化验检查结果见下图。
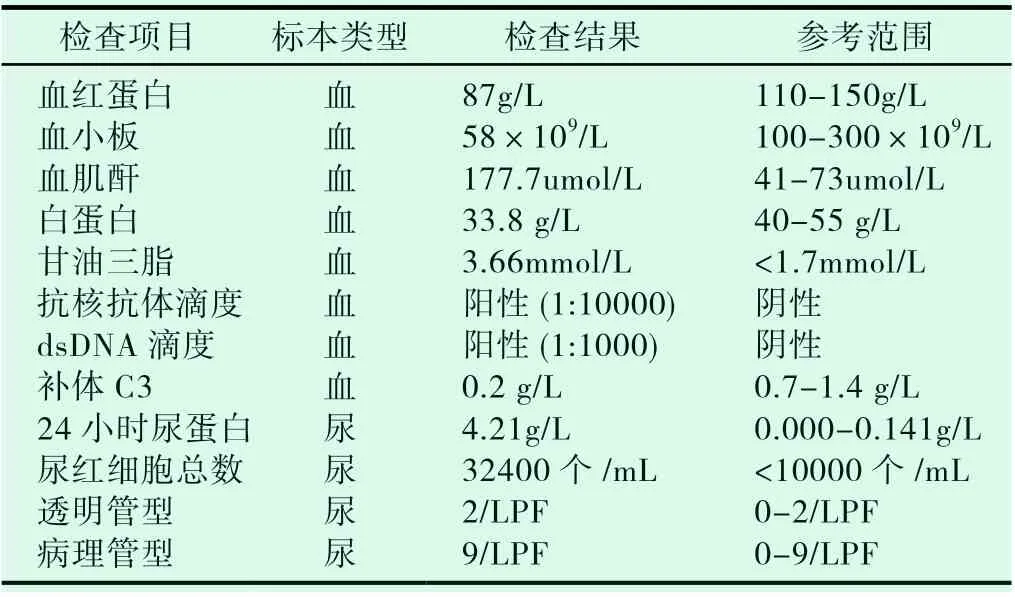
表1 实验室检查结果(我院)

表2 影像学检查结果(我院)

表3 组织活检结果(外院)
2 讨论
LN 的定义为根据美国风湿病学会(SLICC)标准诊断为SLE,伴有蛋白尿(> 500 mg / d),尿中是否存在红细胞或白细胞,以及肾脏活检。根据国际肾脏病学会和肾脏病理学会(ISN / RPS)2003狼疮性肾炎分类系统的分类提示LN[2]。肾脏TMA 被定义为小叶间动脉,小动脉和肾小球毛细血管病变,包括内皮细胞肿胀,内腔狭窄或闭塞,以及通过光学显微镜观察到血栓形成[3]。
LN 伴TMA 病因复杂,与免疫异常、细菌感染、药物等多因素相关。LN 中肾微血管病变的发病机理尚未完全了解。动物模型和人类狼疮实验的结果提示免疫复合物通过经典途径介导的补体激活在狼疮性肾炎组织损伤的发病机理中起关键作用[4,5]。多个研究[6-8]表明,在合并TMA 的狼疮肾炎患者中,有超过半数的患者都存在补体过度激活的证据。
补体调节因子H(CFH)是血清中浓度最高的补体调节蛋白之一,可以与内皮细胞结合并保护它们免受补体系统的攻击。当血清H 因子水平因异常(如机体产生针对补体调节蛋白的自身抗体)降低可能引起内皮细胞损伤,随后可引起血小板消耗,红细胞损伤和最终形成TMA[9]。
另外,人血管性血友病因子裂解蛋白酶(ADAMTS13)在TMA 的发病中起着也有着重要作用,主要参与血栓性血小板减少性紫癜(TTP)的发病过程。ADAMTS13 为vWF 的特异性水解酶,当ADAMTS13 合成、分泌或活性异常,使ADAMTS13裂解vWF 多聚体的能力降低,血管内皮受收到刺激时释放大量的UL-vWF 多聚体,在微血管内UL-vWF 多聚体可网罗血浆中的血小板而导致形成富含血小板的微血栓的形成[1]。
临床上主要表现为贫血,血小板减少,神经功能受损,发热,肾脏受累为主要表现[10],病理表现为:最常累及入球小动脉、小叶间动脉,也可累及血管极及附近的毛细血管袢。光镜:急性期,血管腔内、内皮下及中膜可见嗜复红的纤维素样物质聚集,伴内皮细胞肿胀、剥脱,有时出现红细胞碎片或溶解的红细胞,导致管腔狭窄或完全闭塞。慢性期,血管内膜黏液性水肿,伴或不伴洋葱皮样血管内膜纤维性增生。免疫荧光和电镜缺少免疫复合物的沉积[11]。
病理检查为诊断的金标准,辅以实验室及临床表现即可明确诊断。治疗:尚没有标准化狼疮性肾炎合并TMA 的治疗指南,目前的治疗方案主要是基于肾小球的病理。改善全球肾脏病预后组织(KDIGO)指南仅对涉及APS 肾病(APSN)和TTP 的TMA 病变提出建议,其中抗凝和血浆置换分别被建议[12]。靶向治疗主要是在可能的发病机制上实施。
血栓性血小板减少性紫癜(TTP)及补体调节蛋白基因突变引起的非典型溶血性尿毒症综合征(aHUS)治疗首选血浆置换。血浆置换可去除多种血浆杂质,如自身抗体、异常杂质和循环蛋白结合毒性物质。它还能够给药更高容量的血浆和替代缺乏或有缺陷的生物功能蛋白,如凝血因子和补体缺陷因子。Qiu-Yu Li 等人的回顾性研究中,主要分析了血浆置换术在LN 伴TMA 患者中的应用,与仅接受常规联合应用皮质类固醇和免疫抑制剂的患者(9 例临床匹配患者)相比,接受额外血浆置换的患者(9 例患者)的缓解率明显更高[13]。
考虑到补体系统在LN 血管损伤的发病机理中的重要作用,因此可能是潜在的治疗靶点。Eculizumab(依库珠单抗)是一种重组人源型单克隆抗体,可作为末端补体C5 抑制剂,从而防止膜攻击复合物产生和释放[14]。目前主要被批准用于治疗阵发性夜间血红蛋白尿(PNH),非典型溶血性尿毒症综合征(aHUS)[15]。一项对20 例接受依库珠单抗治疗的SLE 和/或APS 治疗的回顾性研究显示,20 例患者均有明显的血液学反应,而85%的患者具有明显的肾脏恢复。这提示,依库珠单抗可能是对于存在TMA 的SLE 和/或APS 且对当前免疫抑制疗法无效的患者的潜在替代疗法。
根据vWF-ADAMTS13 系统参与LN 肾微血管病变的发病机制,它也可能是潜在的治疗目标。Caplacizumab(卡普赛珠单抗)作为一种抗vWF 的免疫球蛋白片段,能够靶向作用于vWF 的A1结构域,防止其与血小板膜糖蛋白Ib(GPIb)的特异性结合[16],从而减少血小板黏附和消耗,防止TMA 的发生。一项研究显示,卡普赛珠单抗可以缩短血小板正常化时间,从而延缓TTP 的发生[17]。最近已在欧盟批准用于治疗成人获得性TTP(aTTP)[18]。
然而临床上考虑到疗效、价格、预后等综合因素后,目前血浆置换+甲强龙冲击+环磷酰胺任是LN 伴TMA 患者主要的治疗方案,而对于经过血浆置换效果不佳患者的治疗,使用Eculizumab、Caplacizumab 等分子靶向药是一种新的选择。
