iTRAQ 法分析孕期慢性应激子鼠脑海马组织中蛋白质组学变化
2021-03-05付有娟关素珍刘红娅陈小惠戚发秋刘志宏
付有娟, 关素珍, 赵 枫, 刘红娅, 陈小惠, 戚发秋, 刘志宏
(1.宁夏医科大学公共卫生与管理学院,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004)
孕妇在怀孕期间接触工作压力、家庭矛盾、经济窘迫等生活应激事件,这些事件更易使母亲产生焦虑、紧张、恐怖、抑郁情绪[1],而且对子代的情绪行为、认知功能和神经内分泌产生不良影响[2-3]。如果母体妊娠期长时间接触这种应激刺激,将导致子代注意力变弱,出现情绪和行为上的一系列问题[4]。脑海马是与学习记忆能力高度相关的大脑边缘系统[5],它具有控制情绪、免疫和生殖等多方面的生理功能[6]。目前孕期慢性应激致子代脑海马损伤相关疾病的研究大多就某一个蛋白或某一个信号通路,缺乏从整体角度对影响子代脑海马损伤机制的系统研究,除了目前已知的蛋白和信号通路,是否还有其他信号通路参与调控尚不清楚。本研究采用iTRAQ 蛋白质组学技术高通量、高效率地鉴定及筛选孕期慢性应激子鼠脑海马组织中差异蛋白的表达,并通过GO 功能注释和KEGG 富集分析差异蛋白信号通路的情况,初步探讨孕期慢性应激致子代脑海马组织损伤的多种可能作用机制。
1 材料与方法
1.1 实验动物
选择SPF 级未曾受孕的雌性SD 大鼠16 只,80~90 日龄,体质量(200±20)g;SPF 级雄性SD大鼠12 只,90~100 日龄,体质量(220±20)g。实验动物购自宁夏医科大学实验动物中心,合格证编号为SCXK(宁)2015-0001。
1.2 实验试剂与仪器
主要试剂:131I 皮质醇放射免疫试剂盒(北京北方生物技术研究所)、iTRAQ 8PLEX 试剂盒(AB Sciex)、三乙基碳酸氢铵缓冲液(triethylammonium bicarbonate buffer,TEAB,Sigma 公司)、Modified Trypsin 质谱级蛋白酶(PROMEGA 公司)。主要仪器:酶标仪softmax pro(Molecular Devices公司)、分析天平(Mettler Toledo 公司)、数显式稳压稳流电泳仪(上海天能科技有限公司)、超高效液相色谱仪(UPLC,Thermo Fisher Scientific 公司)、串联质谱仪(Thermo Fisher Scientific 公司)、Q-Exactive Plus 质谱仪(Thermo)。
1.3 方法
1.3.1 实验动物分组及模型建立 适应性饲养1周后,将雌鼠随机分为对照组和模型组,每组各8只,模型组单笼饲养,对照组每笼3 只饲养;雄鼠随机分为对照交配组4 只,模型交配组8 只,每笼3 只,均正常饲养。采用慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)建立孕期慢性应激大鼠模型[7]。应激方式包括24 h 拥挤环境(每笼8 只,笼具倾斜30°);24 h 食物剥夺;24 h 水剥夺;24 h 潮湿环境(湿度60%~70%);30 min 摇晃(1 次/s);1 h 温水游泳(31 ℃);束缚应激30 min;5 min 热应激(42 ℃);1 min 夹尾(距尾尖1 cm 处)。以上9 种应激方式随机分配到21 d 的应激实验中,1 周内安排不同的应激方式,对照组母鼠不进行干预,正常环境饲养。
在应激开始前1 天、第1、7、14、21 天,对母鼠进行内眦静脉采血,抗凝管收集后分离血浆,采用131I 皮质醇放射免疫试剂盒对血浆皮质醇含量进行测定,血浆皮质酮浓度=50×血浆皮质醇浓度[8]。在应激第3 天,模型组按雌雄1∶1 合笼,对照组按雌雄2∶1 合笼,合笼过程中应激刺激不间断。次日检查母鼠阴栓并观察阴道涂片,确认受孕后将雌雄分笼,返回原饲养环境。应激刺激结束后,待所有母鼠分娩,根据各组母鼠的分娩只数及性别比例,从不同窝别中随机抽取16 只子鼠(雌、雄各8 只),分为对照子鼠(prenatal control,PC)组与模型子鼠(prenatal stress,PS)组,雌雄分笼,每笼4 只,正常环境饲养。
1.3.2 大鼠海马组织标本采集 待子鼠出生后52 d 时,腹腔注射10%水合氯醛0.3 mL/100 g,麻醉后,在冰上剥离大脑,海马组织取出后用0.9%生理盐水冲洗,装于冻存管中,迅速放入液氮后转移至-80 ℃超低温冰箱保存。
1.3.3 大鼠海马组织蛋白制备 取海马组织至振荡管中,加入适量的蛋白裂解液(8M 尿素+1%SDS,含蛋白酶抑制剂),振荡3 次,每次180 s,冰上裂解30 min,4 ℃,16000×g 离心30 min,取上清,BCA 蛋白定量。
1.3.4 蛋白酶解与iTRAQ 标记 每组取100 μg蛋白样品,充分裂解,先加100 mM TEAB,再加10 mM 三(2-羧乙基)膦(TECP),37 ℃下反应60 min 后加入40 mM 碘乙酰胺室温下避光反应40 min。加入预冷的丙酮,-20 ℃沉淀4 h 后,10000×g 离心20 min,取沉淀,加入100μL100mM TEAB 充分溶解样品,按照 酶∶蛋 白=1 ∶50 加 入胰蛋白酶(Trypsin),37 ℃酶解过夜。胰蛋白酶消化后,用0.5 M TEAB 复溶肽段,iTRAQ 试剂中加入异丙醇,离心,每100 μg 多肽加入一管iTRAQ试剂,室温孵育2 h 后加入50 μL 超纯水,室温30 min。根据iTRAQ 标记试剂盒标记样品,PC 组标记为113,PS 组标记为115,将每组中等量标记产物混合装于同一管中,真空浓缩仪抽干。
1.3.5 肽段组分离 用UPLC上样缓冲液复溶后的多肽样品,用反相C18 柱进行高pH 液相分离。缓冲液A 相为2%乙腈(氨水调至pH10),缓冲液B相为80%乙腈(氨水调至pH10),214 nm 波长进行检测,200 μL·min-1流速。UPLC 洗脱梯度:0~17 min,0%~3.8%缓冲液B,17~34 min,3.8%~24%缓冲液B,34~37 min,24%~30%缓冲液B,37~38 min,30%~43%缓冲液B,38~39 min,43%~100%缓冲液B,39~47 min,100%~0%缓冲液B。根据峰型和时间将收取的20 个馏分合并成10个馏分,进行第二维分析。
1.3.6 肽段液相串联质谱鉴定 使用C18 反相色谱柱(75 μm×25 cm,Thermo,USA)与溶剂A(2%乙腈、0.1%甲酸)、溶剂B(80%乙腈、0.1%甲酸)进行EASY-nLC 液相梯度洗脱:0~4 min,0~5%溶剂B,4~66 min,5%~23%溶剂B,66~80 min,23%~29%溶剂B,80~89 min,29%~38%溶剂B,89~91 min,38%~48%溶剂B,91~105 min,48%~100%溶剂B,105~120 min,100%~0%溶剂B。流速为300 nL·min-1。MS 扫描范围(m/z)350~1300,采集模式DDA,选择母离子中信号最强的20个(TOP20)进行二级碎裂,动态排除时间18 s。
1.3.7 蛋白质鉴定与定量 使用Thermo Xcalibur 4.0(Thermo,USA)软件进行串联质谱数据采集,采用Proteome Discoverer TM Software 2.2在NCBI 和UniProt 数据库中进行蛋白的搜索与鉴定,用113、115 试剂报告离子的峰面积积分进行相对定量分析,以113 为对照子鼠组,按照115∶113 的比值,选取样品中同一个蛋白的表达差异的倍数(fold change,FC)和统计学参数P 值作为参考标准进行两组间差异蛋白的筛选,默认上调蛋白FC>1.2,下调蛋白FC<0.83,P<0.05为差异有统计学意义。
1.3.8 生物信息学分析 利用GO 数据库将Uniprot 数据库分析鉴定出的差异蛋白,按照其亚细胞定位的细胞组分(cellular component,CC)、分子功能(molecular function,MF)及生物过程(biological process,BP)三个方面进行功能注释,采用KEGG 数据库进行信号转导通路分析,利用String 数据库绘制差异蛋白进行蛋白互作网络分析,分析蛋白之间的相互作用。
1.4 统计学方法
利用SPSS 23.0 统计软件对母鼠血浆皮质酮含量进行分析,正态分布用均数±标准差(±s)进行统计描述,采用重复测量资料方差分析进行分析,检验水准α 取0.05,双侧检验。采用Goatools 软件对差异蛋白集中的蛋白进行KEGG 富集分析,使用Fisher 确切概率法。为控制计算假阳性,默认选用BH(benjamini and hochberg)对P 值进行校正。
2 结果
2.1 孕期慢性应激母鼠血浆皮质酮含量变化
组间比较发现:模型组和对照组母鼠血浆皮质酮含量差异有统计学意义(F=7.717,P<0.05),说明慢性应激对母鼠血浆皮质酮含量有影响;组内比较发现:时间因素对皮质酮水平的影响有统计学意义(F=6.076,P<0.05),由图1 可知,母鼠皮质酮水平随应激时间的延长而变化,在应激第7、14 天,模型组皮质酮水平高于同期对照组(P均<0.05),说明母鼠处于应激状态。
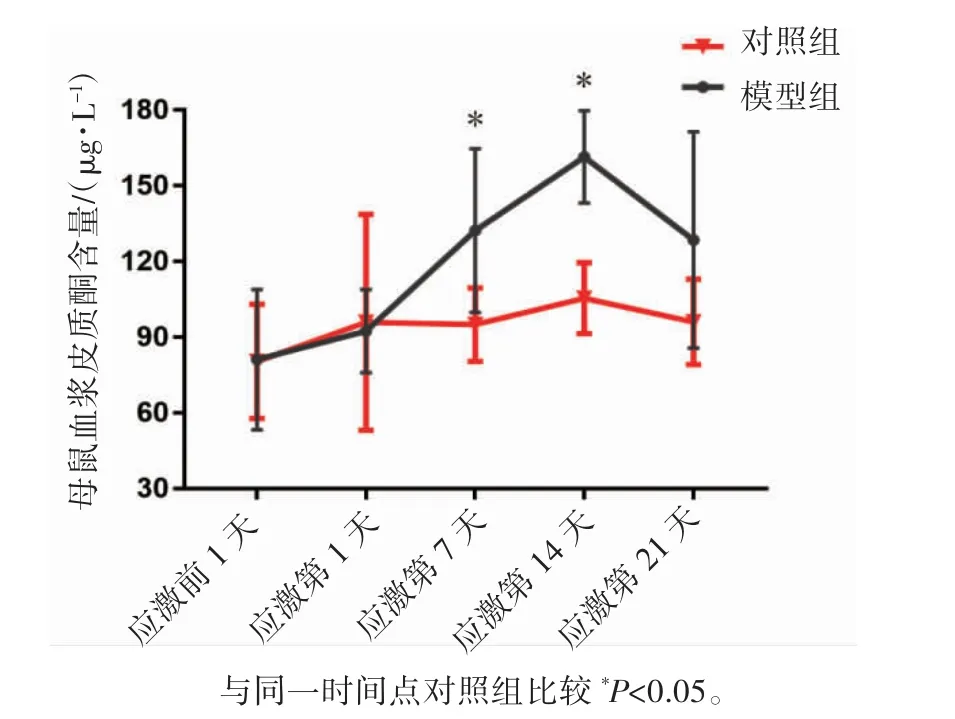
图1 孕期慢性应激对母鼠血浆皮质酮含量的影响
2.2 孕期慢性应激子鼠海马组织的差异蛋白质鉴定
质谱分析结果显示:模型子鼠组和对照子鼠组共筛选和鉴定出5065 个蛋白,差异蛋白有26 个(P<0.05),其中上调蛋白19 个,下调蛋白7 个,见表1。差异蛋白火山图与表达模式聚类图均显示这些差异蛋白在两组中的表达差异有统计学意义,见图2A、2B。

表1 孕期慢性应激子鼠脑海马组织差异蛋白分析结果
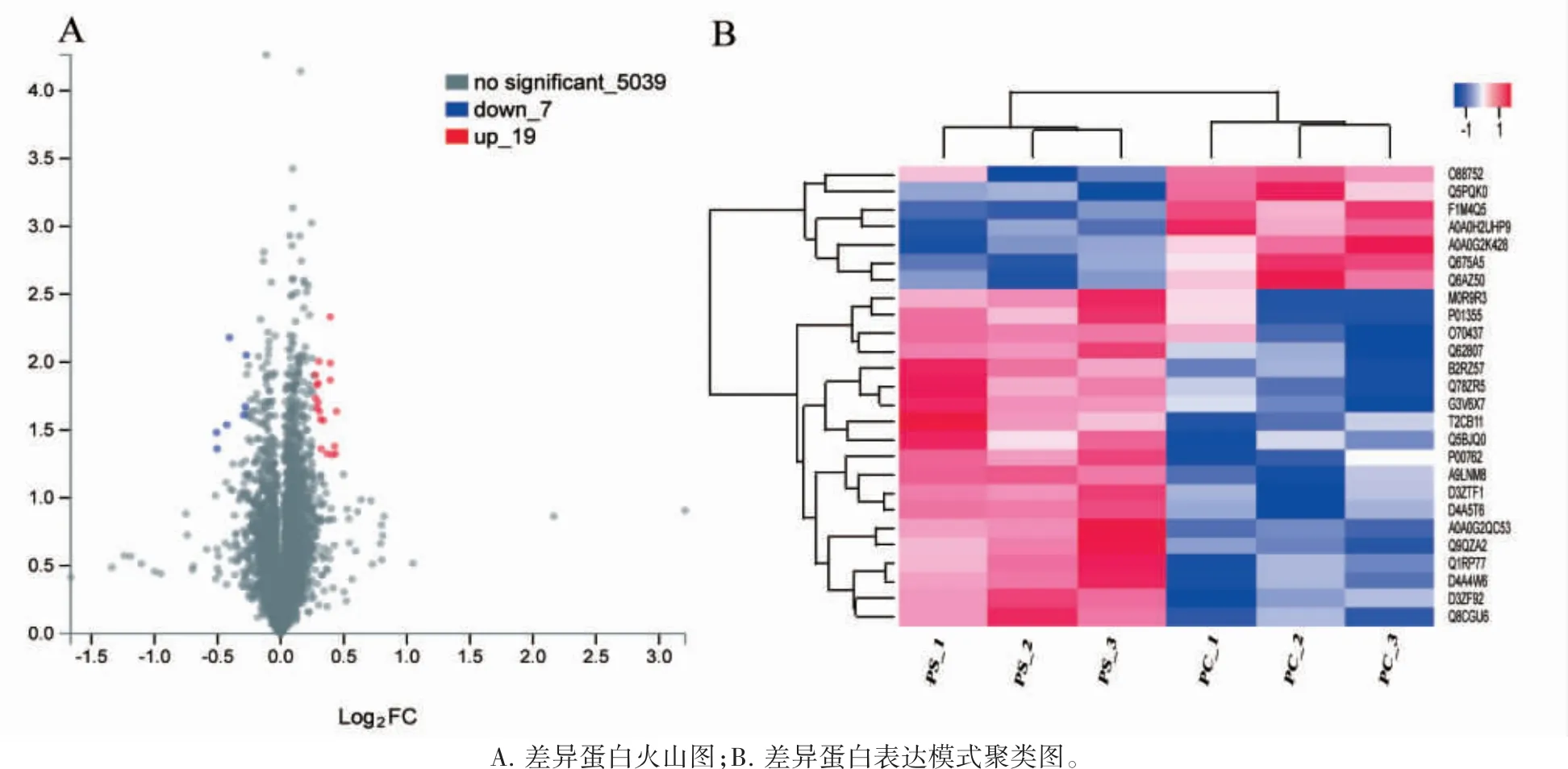
图2 孕期慢性应激子鼠脑海马组织的差异蛋白鉴定
2.3 孕期慢性应激子鼠脑海马组织差异蛋白GO 功能注释
差异蛋白GO 功能注释结果显示:GO Term丰度前30 个结果。BP 主要涉及单有机体过程、细胞过程和生物调节等23 个方面;差异蛋白的CC 涉及14 个方面,主要包括细胞、细胞部分和细胞器等;所涉及的MF 主要有结合、催化活性和分子功能调节等9 个方面,见图3。
2.4 孕期慢性应激子鼠脑海马组织差异蛋白KEGG 富集分析结果
PS 与PC 的差异蛋白KEGG 富集分析结果显示:共富集到57 条通路,其中显著富集的信号通路有8 条(P<0.05),见表2。
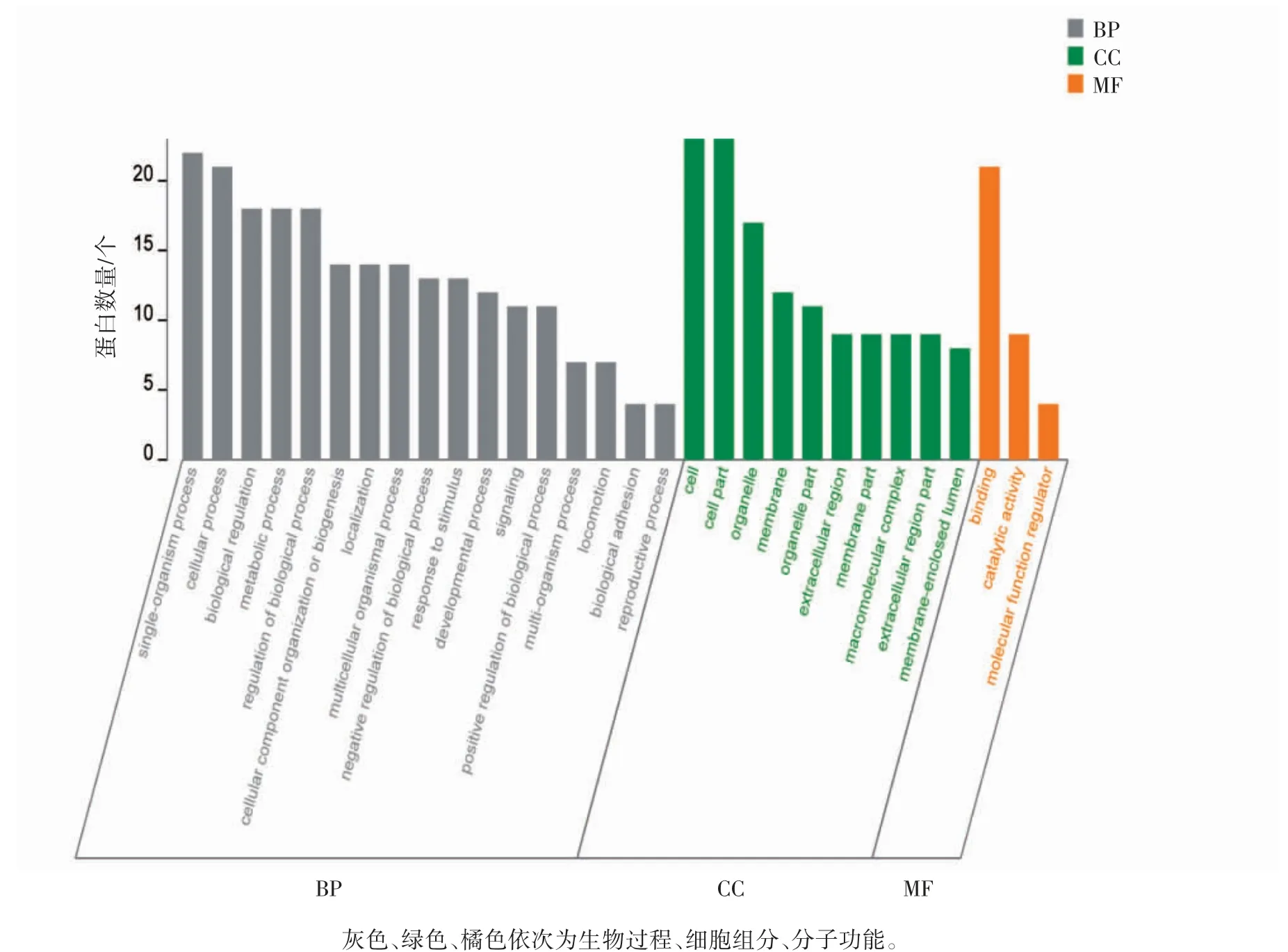
图3 孕期慢性应激子鼠脑海马组织差异蛋白GO 功能注释统计图

表2 孕期慢性应激子鼠脑海马组织差异蛋白KEGG 富集分析结果
2.5 孕期慢性应激子鼠脑海马组织差异蛋白互作网络分析结果
将26 个差异蛋白新建蛋白集,利用String数据库绘制差异蛋白功能互作网络图。其中String可识别的差异蛋白为18 个,主要包括INSR、MRPL18、PRSS1、PKG、CCK 等。α2A-AR、突触小泡蛋白17、ε1 球蛋白等8 个差异蛋白未能识别,见图4。

图4 孕期慢性应激子鼠脑海马组织差异蛋白互作网络图
3 讨论
本研究采用CUMS 建立孕期慢性应激模型,升高的血浆皮质酮含量作为啮齿类动物受到应激刺激的主要标志[9]。本实验研究结果显示:慢性应激第7、14 天,模型组母鼠血浆皮质酮水平高于对照组,提示孕期慢性应激模型建立成功,进一步展开对子鼠的研究。
通过iTRAQ 技术分析PS 和PC 脑海马组织差异蛋白,上调蛋白19 个,下调蛋白7 个,这些差异蛋白涉及23 种BP、14 种CC 和9 种MF。BP主要涉及单有机体过程、细胞过程、生物调节、代谢过程等;CC 涉及细胞、细胞器、细胞膜及细胞外区等;MF 主要有结合、催化活性、分子功能调节和信号传导功能等。
哺乳动物大脑的发育过程依赖于遗传因素、环境因素和表观遗传之间的相互作用。胚胎期是大脑发育的关键时期,研究发现妊娠期母源性应激对胎儿脑海马发育的影响最明显[10],机体通过重塑其结构和功能进而对子代的认知、行为和健康产生一系列长期乃至永久的影响。研究发现:孕期母体应激可诱导子代大脑回路产生长期的分子变化,如影响子代的多巴胺回路,增加成年子代发生神经精神疾病的风险[4];孕期母体应激可致使子代下丘脑-垂体-肾上腺轴在易损期发生持久性或永久性改变,引起成年子代的认知功能障碍[11];孕期慢性应激还会使N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)抑制mTOR 激活致使子鼠抑郁,甚至引起CA3 区神经元损伤[12];在慢性应激母鼠的后代中,出现神经发育迟缓、行为及大脑标记物水平的改变[13]。总之,母鼠孕期慢性应激对子代脑海马发育的影响,主要表现为体内多种生物大分子的改变,本研究分析发现子代脑海马的变化主要涉及神经活性配体-受体相互作用、cGMPPKG 信号通路、胰腺分泌等信号通路。
孕期慢性应激子代脑海马组织中有3 个差异蛋白参与了神经活性配体-受体相互作用通路,包括α2A-AR、CCK、PRSS1,均为上调差异蛋白。孕期慢性应激可引起子代焦虑、抑郁样行为及认知功能下降,可能与多种神经递质及受体有关。神经活性配体-受体相互作用信号通路涉及几乎所有细胞质膜和细胞内外信号通路相关的受体及配体[14]。α2A-AR 是前额叶皮层中表达最丰富的肾上腺素能受体亚型[15],其生理作用主要是反馈性抑制突触前去甲肾上腺素释放、降压、镇痛、镇静和催眠[16]。研究表明:α2A-AR 作为下丘脑-垂体-肾上腺(hypothalamus pituitary adrenal,HPA)轴中重要成员,在脑海马中表达上调与抑郁患者自杀风险的增加高度相关[17]。CCK 是一类具有广泛生物活性的脑肠肽,通过神经内分泌系统以多种方式作用,最后向中枢神经系统发出信号,引起机体作出反应[18]。CCK 作为胃肠道激素之一,以促进胰酶分泌与胆囊收缩为主要功能,在神经系统中也有广泛分布[19]。Reich 等[20]在研究中发现,慢性应激可导致雄性大鼠体内CCK分泌异常,同时研究发现CCK 能促进周围神经元损伤后的修复过程,主要通过外源性CCK 介导调节神经生长因子[21]。孕期应激会增加妊娠期间母体的胰腺炎、高脂血症、子痫前期等疾病风险,进而使子代免疫功能降低[22]。此外差异蛋白CCK 和PRSS1 还参与了胰腺分泌的过程。除上述差异蛋白和信号通路外,cGMP-PKG 信号通路在子代脑海马发育过程中也发挥了重要作用,3个上调差异蛋白参与了该信号通路的调节,分别是PKG、INSR 和α2A-AR。Ölmestig 等[23]研究发现cGMP-PKG 信号通路参与神经发生和细胞增殖等过程。因此,推测该信号通路也参与了孕期慢性应激子代脑海马的发育过程,涉及的具体作用机制需要进一步研究。
String 数据库对蛋白互作网络分析发现,这些差异蛋白位于多条信号通路的节点上,这些节点上的差异蛋白与所鉴定到的信号通路基本一致。母体孕期慢性应激对子代脑海马发育的不良影响是多种蛋白质分子基于不同生物学途径共同作用的结果。本研究基于iTRAQ 技术,从信号通路、蛋白质功能和蛋白互作网络关系等多个层次来挖掘孕期慢性应激引起的子代海马发育损伤的相关蛋白,其中CCK 和PRSS1、INSR、α2A-AR 可能是孕期慢性应激引起子代海马发育损伤过程的重要靶点,将在后续研究中通过动物实验加以验证。
