慢性牙周炎合并肝硬化患者口腔微生物群失调对疾病严重程度的影响
2021-03-05孙欣彤康芳芳
孙欣彤,康芳芳
(首都医科大学附属北京佑安医院五官中心口腔科,北京 100069 )
牙周炎(periodontitis,PD)是一种常见的慢性炎症性疾病,主要由菌斑微生物引起,可导致易感宿主牙周组织被破坏,临床症状多为牙槽骨、牙周韧带和牙骨质等牙支持组织受损[1-3]。全世界约有7.43亿人罹患牙周炎,其更是全球最常见的六大疾病之一[4]。目前,随着我国人口老龄化的不断发展,牙周炎的发生率呈不断上升的趋势。此外,肝硬化是一种常见的慢性进行性肝病,诱因为一种或多种致病因素长期或反复作用而导致的肝脏弥漫性损伤[5],常导致肝细胞弥漫性变性、坏死、再生结节、纤维组织增生等,并可进展为肝纤维化,最终发展为肝癌[6-7]。了解影响肝硬化发生及发展的高危因素,积极治疗肝纤维化,逆转或延缓其发展,对于提高患者的生活质量,改善病情预后具有重要意义。肝硬化患者普遍存在微炎症状态,炎症是肝脏中任何危险因素存在的主要结果,并可导致肝纤维化和肝再生,是诱发肝癌的重要原因[8]。牙周炎患者口腔中存在的细菌会加重机体炎症反应,激活免疫防御体系并导致免疫损伤,进一步促进了肝硬化的发生及发展[9-10]。本研究拟探讨慢性牙周炎合并肝硬化患者口腔微生物群失调对疾病严重程度的影响,旨在识别新的危险因素和潜在的治疗靶点,对预防和治疗肝硬化提供一定的依据。
1 资料与方法
1.1 一般资料
选取2018年6月至2020年6月首都医科大学附属北京佑安医院收治的慢性牙周炎患者120例为研究对象。所有患者经牙周组织检查均确诊为牙周炎。纳入标准:(1)所有患者经牙周组织检查均确诊为牙周炎;(2)年龄18~65岁;(3)牙周炎分级为轻-中度;(4)体重指数 18~24 kg/m2;(5)近3个月内未接受过药物治疗。排除标准:(1)严重高血压、冠心病、糖尿病等系统性疾病者;(2)合并精神疾病者;(3)合并感染类疾病者;(4)严重的电解质紊乱者;(5)合并恶性肿瘤者。另选同期在首都医科大学附属北京佑安医院体检的50名健康志愿者为对照组(C组,n=50),无牙周病史。牙周炎患者依据是否合并肝硬化分为周炎合并肝硬化组(A组,n=65)和牙周炎组(B组,n=55)。三组患者的性别、年龄、体质指数等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
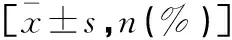
表1 各组一般资料比较
1.2 方法
治疗前,所有入组对象于清晨使用清水漱口,使用消毒球在取菌区蘸干,局部隔湿后于牙周袋、冠周盲袋处插入消毒纸尖,30 s 后将消毒纸尖放置于1 mL厌氧转送液中进行检测,记录各组牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌以及双歧杆菌的菌落数。同时采集各组空腹静脉血5 mL,以3 000 rpm的转速离心10 min,留血清待测。采用Model 550全自动多功能酶标仪(美国BIO-RAD公司),通过酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测肠道屏障指标血清二胺氧化酶(diamine oxidase,DAO)、内毒素(endotoxin,ET)和D-乳酸(D-lactic acid,D-lac)水平,所用试剂盒购置美国BIOTANG公司,采用Re LIA SSJ-2免疫分析仪(广州万腾电子科技有限公司提供)检测血清降钙素原(procalcitonin,PCT)水平,试剂盒也选用同公司生产配套的试剂盒。采用Model550全自动多功能酶标仪(美国BIO-RAD公司),通过ELISA检测血清炎症因子白细胞介素6(interleukin-6,IL-6)、IL-8及α肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平,所用试剂盒购置美国BIOTANG公司。采用日立-7180全自动生化分析仪检测各组肝功能指标血清天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平。
1.3 统计学分析
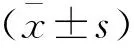
2 结果
2.1 各组口腔微生物群菌落数比较
A组牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌菌落数多于B组和C组(P<0.05),但双歧杆菌菌落数低于B组和C组(P<0.05);B组产牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌菌落数多于C组(P<0.05),但双歧杆菌菌落数低于C组(P<0.05)。见表2。
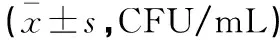
表2 各组口腔微生物群菌落数比较
2.2 各组肠道屏障功能比较
A组DAO、PCT、ET及D-lac水平均高于B组和C组(P<0.05),B组DAO、PCT、ET及D-lac水平均高于C组,差异有统计学意义(P<0.05)。见表3。
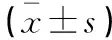
表3 各组肠道屏障功能比较
2.3 各组炎症因子水平比较
A组IL-8、IL-6和TNF-α水平均高于B组和C组(P<0.05),B组IL-8、IL-6和TNF-α水平均高于C组(P<0.05)。见表4。
表4 各组炎症因子水平比较
2.4 各组肝功能指标比较
A组ALP、ALT和AST水平均高于B组和C组(P<0.05),B组ALP、ALT和AST水平均高于C组(P<0.05),差异有统计学意义。见表5。
表5 各组肝功能指标比较
2.5 口腔菌群与肠道屏障、炎症因子和肝功能的相关性分析
Pearson相关性分析表明,牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌与DAO、PCT、ET、D-lac、IL-8、IL-6、TNF-α、ALP、ALT和AST水平呈正相关(P<0.05),双歧杆菌与DAO、PCT、ET、D-lac、IL-8、IL-6、TNF-α、ALP、ALT和AST水平呈负相关(P<0.05)。见表6。
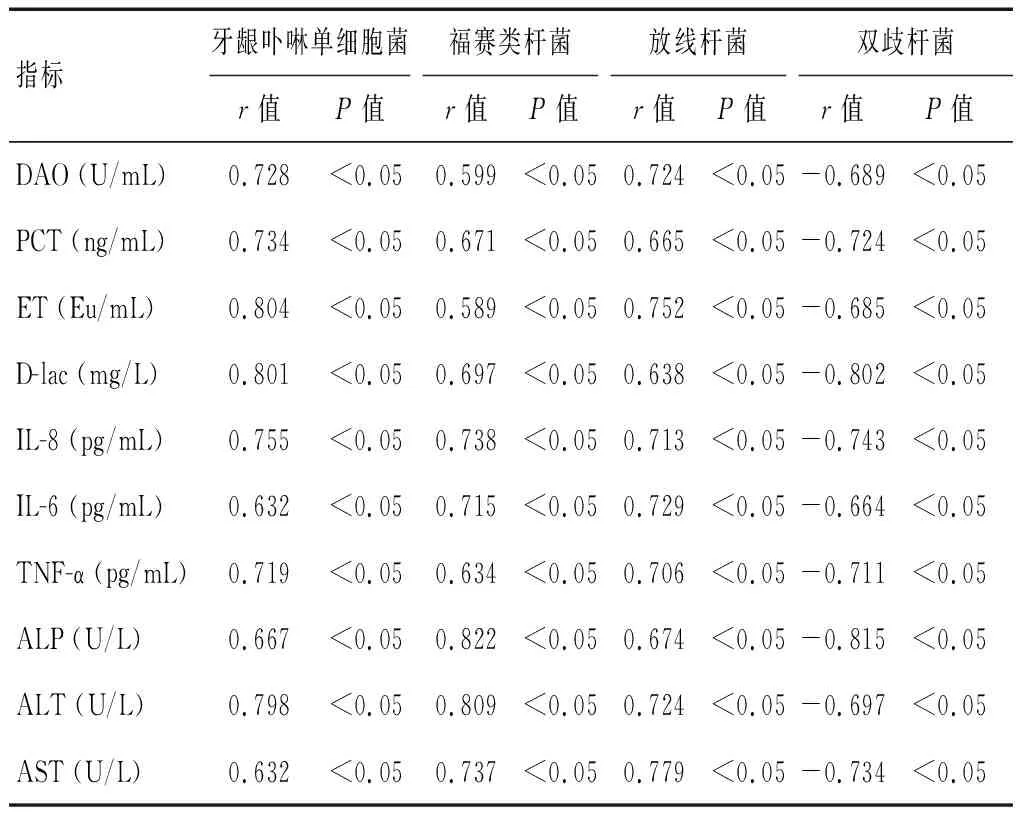
表6 口腔菌群与肠道屏障、炎症因子和肝功能的相关性分析
3 讨论
牙周炎的发病机制较为复杂,其中牙齿生物膜中的微生物被认为参与了牙周炎的发病机制,特别是龈下细菌在其发生和发展过程中起着重要的作用[11-12]。近年来,牙齿龈下细菌的组成、牙周健康与疾病之间的变化情况分析显示,牙周炎患者牙齿的健康部位(探测深度≤3 mm)与患病部位的微生物群存在显著差异[13],慢性牙周炎患者口腔微生态失调,且与机体的免疫、激素或结缔组织代谢损伤有关,增加类风湿性关节炎、肺部感染、慢性肾病等疾病的发生率[14]。肝硬化是一种常见的慢性进行性肝病,由一种或多种病因引起,如病毒、酒精、寄生虫、自身免疫反应、长期药物损伤或反复作用形成弥漫性肝损伤[15]。目前,肠道菌群在肠肝中发挥的作用及其与肝硬化的相关性已较为明确[16]。然而,口腔菌群失调与肝硬化的发生及发展的研究仍相对较少。了解口腔微生物在肝硬化发病机制中的具体作用,对制定更好的预防和寻求新的治疗策略具有重要的意义。
口腔是胃肠道的入口门户,定植在口腔中的微生物组成了一个复杂的生态系统,其功能对机体代谢至关重要,并影响健康情况和疾病的发生率[17]。口腔细菌的免疫反应及炎症信号的激活不仅依赖于遗传因素,也依赖于表观遗传机制,牙龈炎和牙周炎参与了恶化炎症基因的额外调节[18]。肝硬化患者通常表现出大量的口腔问题,如口干、瘀斑、念珠菌感染等[19]。口腔微生物失调促进了肝硬化的发生及发展[20]。此外,另有研究[21]表明,肝硬化的发生同样加重口腔菌群的失调,进一步恶化病情。Ren等[22]指出,牙周炎的诱因是多种厌氧菌混合感染,其中牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌作为口腔中重要的致病菌,在参与牙周炎炎症反应中扮演着重要的作用,与本研究一致。口腔与肠道的微生物动力学一致,口腔菌群的改变会导致肠道菌群失调,从而引起肠道疾病,而疾病的发生则又会进一步破坏菌落的平衡。因此,慢性牙周炎合并肝硬化患者的口腔微生态失调更为严重。
口-肠-肝轴是口腔菌群促进肝硬化发生及发展的重要途径之一。肠道微生物失调,肠道屏障受损,细菌移位可导致全身性炎症反应,促进肝硬化的进展[23]。而口腔微生物可通过移位入侵肠道,并通过受损的肠道屏障,干扰肠道微生物促进肝硬化的进展。Qin等[24]研究发现,在肝硬化患者的肠道微生物中含有大量来源于口腔的细菌,如链球菌、韦荣球菌、具核梭杆菌等。肝病患者中牙龈卟啉单胞菌的检出频率更是高于非肝病受试者,并且通过颈静脉注射牙龈卟啉单胞菌可加速小鼠肝纤维化和脂肪变性[25]。肝纤维化进展与抗牙龈卟啉单胞菌菌毛Ⅳ型牙龈卟啉单胞菌的抗体滴度之间显著相关[26]。此外,放线杆菌感染可通过干扰肠道菌群和葡萄糖代谢来影响非酒精性脂肪肝病的发生发展[27]。另有研究[28]表明,口腔致病菌入侵肠道后,可导致肠道菌群失调,血清内的毒素水平上升,肠道屏障受到破坏,肝脏功能更是受到干扰。一项大样本横断面研究[29]显示,牙周炎患者血清ALT和AST水平明显高于健康人,这与本文的结果相似。通过对慢性牙周炎患者抗炎治疗,口腔保健等,可有效改善肝病患者血清ALT 及AST 水平,减少肝损伤[30]。另外,口腔微生态失调程度与机体炎症反应、肠道屏障及肝功能具有密切的联系,但具体机制仍需进一步探讨。
综上所述,慢性牙周炎合并肝硬化患者口腔微生物失调更为严重,且与炎症反应、肠道屏障及肝功能密切相关。恢复肠屏障功能,防止细菌易位,对于抑制肝硬化的进展,改善患者的预后可能具有重要意义。
