水孔蛋白-5在机械通气致急性肺损伤大鼠肺组织中的表达研究*
2021-03-04陈美羽赵毓静张新日
陈美羽,赵毓静,张新日
(山西医科大学第一医院 呼吸与危重症学科,山西 太原030001)
慢性阻塞性肺疾病、哮喘、呼吸衰竭等疾病是呼吸系统常见病,临床通过机械通气进行呼吸支持治疗,维持患者血氧饱和度。但机械通气时间过长,通气量过大,可出现机械通气相关性肺损伤,对肺组织造成二次打击,严重时可导致急性肺损伤(acute lung injury, ALI)或急性呼吸窘迫综合征发生。ALI 主要病理生理特征是弥漫性肺泡水肿和肺泡液清除率下降,肺泡上皮细胞损伤和肺毛细血管内皮细胞通透性升高,肺泡腔内富集含蛋白和炎症细胞因子的水肿液,破坏肺泡细胞表面气液交换屏障的平衡,导致急性呼吸窘迫综合征发生[1-2]。
水孔蛋白-5(Aquaporin-5, AQP-5)位于Ⅰ型肺泡上皮细胞,是调节水分子转运的功能性蛋白,生理状态下可协助清除肺泡腔内多余水分,保持肺泡腔干燥环境[3]。但AQP-5 在ALI 过程中对水肿液清除作用的机制仍不明确。多项研究显示[4-7],不同类型损伤因素致ALI 条件下,AQP-5 表达趋势不稳定。本研究通过大潮气量机械通气快速复制大鼠ALI 模型[8],观察在不同的机械通气时间下,AQP-5 在肺组织中表达的变化,探讨其在机械通气致ALI 中的作用。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠30只,体重270~320 g,均由山西医科大学实验动物中心提供,实验动物生产许可证号[SCXK(晋)2015-0001]。
1.2 主要试剂与仪器
兔抗鼠AQP-5 一抗(武汉博士德生物公司,编号:BA2205),SABC 免疫组织化学染色试剂盒[即用型SABC-POD(兔IgG),武汉博士德生物公司,编号:SA1022],RWD407 型小动物呼吸机(深圳瑞沃德公司)。
1.3 方法
将30 只大鼠按照不同的机械通气时间,完全随机分为对照组、0.5 h 组、1.0 h 组、1.5 h 组和2.0 h组,每组6只。适应性饲养1 周,实验前12 h 禁食,自由饮水。大鼠称重并记录,用于计算麻醉剂量和肺系数。水合氯醛(40 mg/kg)腹腔注射麻醉大鼠后,仰卧位置于小动物实验台上,颈前剪毛备皮消毒,沿颈部正中纵向切开约1.5 cm,逐层钝性分离皮肤及皮下肌肉组织,暴露气管。
对照组大鼠行气管切开,保持气道通畅,自由呼吸室内空气(吸氧浓度21%),不给予机械通气。2 h 后行常规胸、腹部消毒,逐层打开腹腔并暴露腹主动脉,迅速放血处死,处置方法符合动物伦理学标准。快速打开胸腔,钝性分离组织取出肺脏,立即置于预冷的生理盐水中漂洗2、3 次,用无菌纱布吸干肺表面水分。留取肺大体标本,用于观察肺组织大体形态损伤程度;取右肺称湿重,用于计算肺系数,评估肺组织水肿程度;取左肺于4%多聚甲醛溶液中固定24 h 后进行HE 染色和免疫组织化学染色,光镜下观察肺组织损伤程度和检测各组肺组织中AQP-5 的表达。
0.5 h 组、1.0 h 组、1.5 h 组和2.0 h 组大鼠行气管切开后连接小动物呼吸机,呼吸室内空气(吸氧浓度21%),分别给予机械通气0.5 h、1.0 h、1.5 h 和2.0 h,4组呼吸机参数设置一致:VT=30 ml/kg,I∶E为1∶1,PEEP为0 cmH2O,RR为60次/min。4 组大鼠机械通气结束后立即处死留取标本,处置方法同对照组大鼠。
1.4 观察指标
1.4.1 HE 和免疫组织化学各组大鼠肺组织经过多聚甲醛固定,酒精梯度脱水,二甲苯透明石蜡包埋冷却,制成4 μm 厚切片,过夜烤片。HE 染色:二甲苯、酒精梯度进行组织脱蜡,苏木精-伊红染色,酒精、二甲苯梯度脱水,风干后树胶封片,光镜下观察各组肺组织损伤程度。免疫组织化学:组织脱蜡,枸橼酸盐高压抗原热修复,5%BSA封闭液封闭,孵育兔抗鼠AQP-5 一抗(1∶100)37℃1 h,SABC 免疫组织化学染色试剂盒二抗孵育,DAB 显色,苏木精复染,封片,光镜下观察并评估各组肺组织中AQP-5 的表达。
1.4.2 肺系数通过肺系数显示肺组织水肿损伤程度。分别称量机械通气前大鼠体重和右肺组织重量,计算肺系数:肺湿重(g)/体重(kg)×100%,肺系数越大表示肺水肿程度越严重。
1.4.3 AQP-5 免疫组织化学染色结果判定方法采用染色强度评分和AQP-5 阳性细胞占比评分[9]判定AQP-5 染色结果。每组取6 张切片,每张切片随机选择3 个视野,以肺泡上皮细胞顶膜出现棕黄色颗粒为阳性细胞。首先按照染色强度评分:棕褐色为3 分,棕黄色为2 分,浅黄色为1 分,无色为0 分;再按阳性细胞占视野内细胞的百分比评分:>75% 为4 分,75%~>50% 为3 分,50%~>10%为2分,≤10%为1分,阴性为0分。评分越高表示肺组织中AQP-5表达越多。
1.5 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较采用LSD-t检验,相关分析用Spearman法,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织大体标本
对照组大鼠肺组织大体标本体积正常,表面光滑,色泽粉嫩,质软(见图1A);与对照组比较,0.5 h组、1.0 h 组、1.5 h 组和2.0 h 组大鼠肺组织体积增大,肺叶边缘外翻,有弥漫性出血,质韧(见图1B~E 中箭头所示)。表明机械通气时间的延长对肺组织大体形态改变有影响。
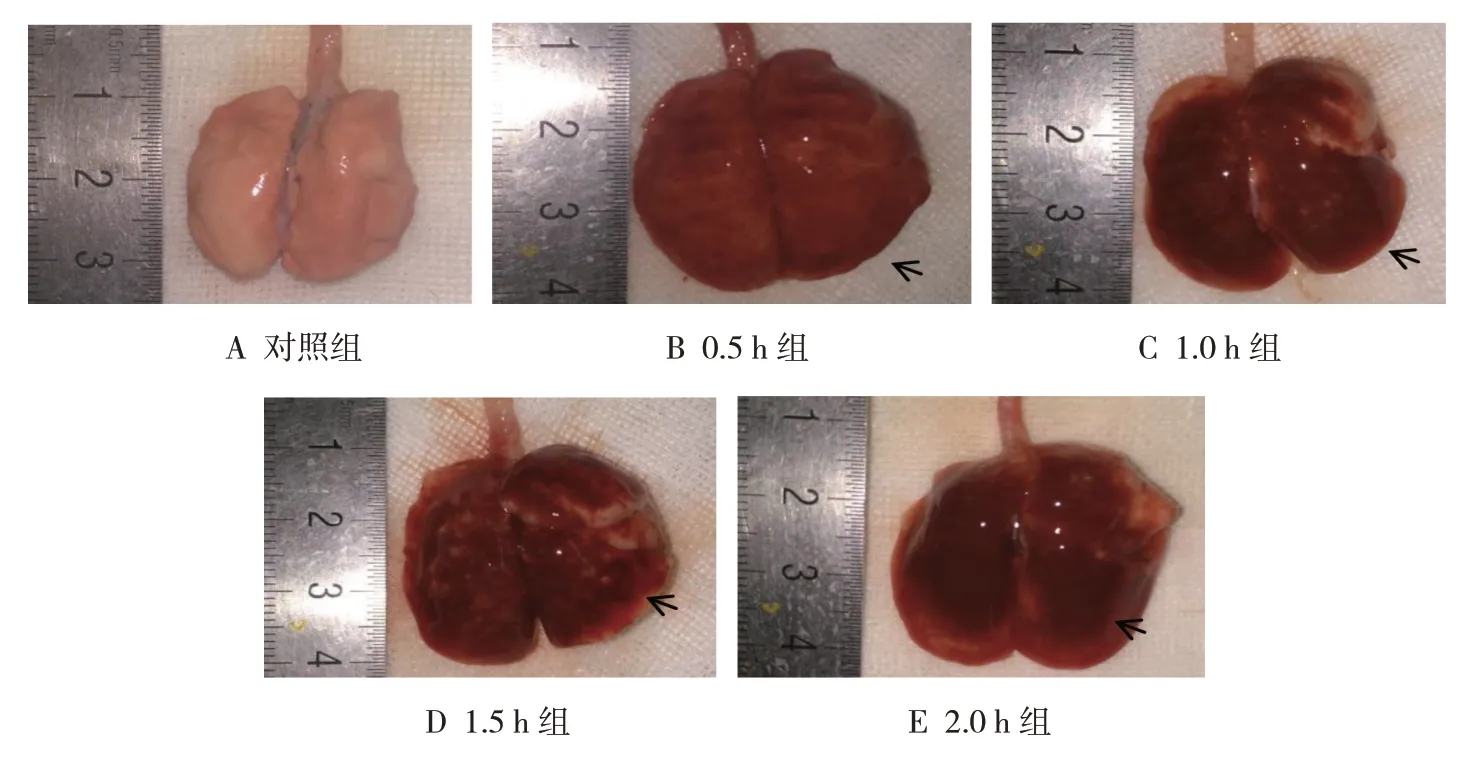
图1 各组大鼠肺组织大体标本
2.2 各组大鼠肺系数比较
各组大鼠肺系数比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,1.0 h 组和1.5 h组大鼠肺系数差异无统计学意义(P>0.05);其余各组大鼠肺系数组间两两比较,差异有统计学意义(P<0.05)。见表1。
2.3 各组大鼠肺组织HE染色结果
对照组大鼠肺泡腔大小正常,形态规整,肺泡壁完整、无炎症细胞浸润,肺间质无水肿(见图2A);与对照组比较,0.5 h组、1.0 h组、1.5 h组和2.0 h组大鼠肺泡壁可见不同程度破裂、肺大泡形成,肺泡腔内有红细胞及粉红色水肿液渗出,肺间质水肿、炎症细胞浸润(见图2B~E 中箭头所示),为典型ALI 病理形态学特征,表明机械通气致大鼠ALI 模型复制成功。
2.4 各组大鼠肺组织免疫组织化学染色结果
对照组大鼠肺组织染色均匀一致、呈棕褐色(见图3A);与对照组比较,0.5 h 组、1.0 h 组、1.5 h 组和2.0 h 组大鼠肺组织染色不均匀,呈现棕黄色、浅黄色,AQP-5 表达逐渐减少甚至无(见图3B~E 中箭头所示)。表明机械通气时间对肺组织中AQP-5 表达有显著影响。
表1 各组大鼠肺系数比较 (n=6,±s)
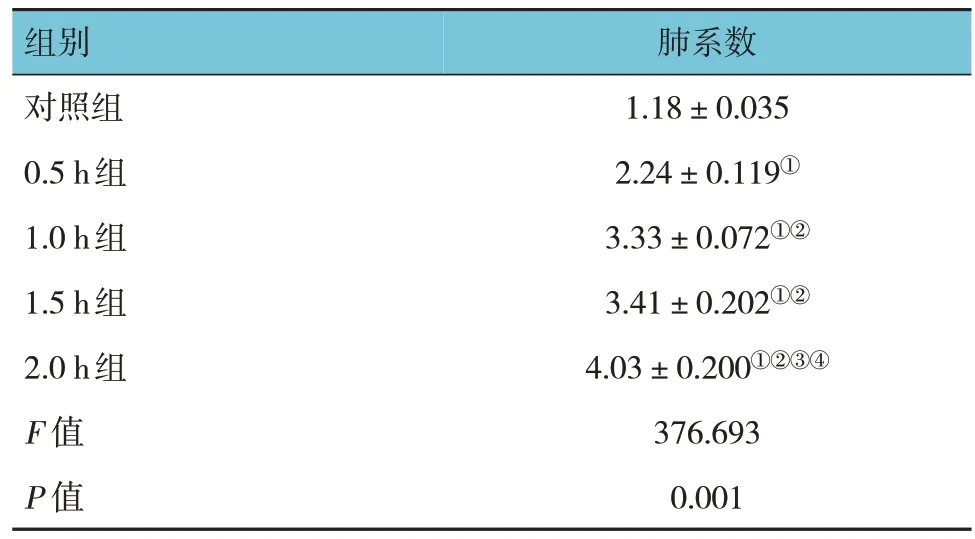
表1 各组大鼠肺系数比较 (n=6,±s)
注:①与对照组比较,P <0.05;②与0.5 h组比较,P <0.05;③与1.0 h组比较,P <0.05;④与1.5 h组比较,P <0.05。
肺系数组别1.18±0.035 2.24±0.119①3.33±0.072①②3.41±0.202①②4.03±0.200①②③④376.693 0.001对照组0.5 h组1.0 h组1.5 h组2.0 h组F 值P 值

图2 各组大鼠肺组织病理切片HE染色图 (×100)

图3 各组大鼠肺组织病理切片免疫组织化学染色图 (×100)
2.5 各组大鼠肺组织AQP-5 免疫组织化学染色强度评分与阳性细胞占比评分比较
各组大鼠肺组织AQP-5 免疫组织化学染色强度评分和AQP-5 阳性细胞占比评分比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,1.0 h 组和1.5 h 组AQP-5 染色强度评分和AQP-5阳性细胞占比评分比较,差异无统计学意义(P>0.05);其余各组AQP-5 染色强度评分和AQP-5 阳性细胞占比评分两两比较,差异有统计学意义(P<0.05)。见表2。
2.6 肺系数与AQP-5 免疫组织化学染色强度评分和阳性细胞占比评分的相关性
肺系数与AQP-5 免疫组织化学染色强度评分呈负相关(rs=-0.925,P=0.001);肺系数与免疫组织化学AQP-5 染色阳性细胞占比评分之间呈负相关(rs=-0.951,P=0.001)。
表2 各组大鼠肺组织免疫组织化学AQP-5染色评分比较(n=6,±s)

表2 各组大鼠肺组织免疫组织化学AQP-5染色评分比较(n=6,±s)
注:①与对照组比较,P <0.05;②与0.5 h组比较,P <0.05;③与1.0 h组比较,P <0.05;④与1.5 h组比较,P <0.05。
组别染色强度评分阳性细胞占比评分对照组0.5 h组1.0 h组2.50±0.13①1.40±0.26①②3.60±0.18①2.40±0.16①②1.5 h组2.0 h组F 值P 值2.80±0.11 1.30±0.18①②0.40±0.22①②③④207.522 0.001 3.80±0.13 2.20±0.19①②0.70±0.27①②③④216.311 0.001
3 讨论
水孔蛋白家族被发现以来,已有13 种AQPs 亚型,特异性分布于人体各器官组织中[10]。AQPs 的分子量约28 kD,是一种含有胞质N-始端和C-末端的跨膜通道蛋白,由H1~H6 6 个跨膜片段组成,两两间相互靠近,共形成A~E 5 个“环区”。B 区和E 区反向平行接近形成“沙漏模型”,即疏水孔。中心孔开关的活性由门控或细胞膜中AQPs 的丰度来调节,这种缩窄性空间构型决定了水孔的渗透选择性[11]。
在肺组织中,AQP-5 表达于Ⅰ型肺泡上皮细胞顶膜近换气侧,水分子的转移依赖跨肺泡上皮和肺微血管内皮细胞的渗透梯度完成[3,11]。MA[5]发现敲除AQP-5基因,肺泡透水性较生理状态下可降低10倍,表明AQP-5 介导肺泡上皮细胞的水分子跨膜转运机制。刘洋等[6]发现在不同潮气量机械通气中,大潮气量组肺组织中AQP-5 表达量下调,可能与肺水肿发生机制有关。可见,AQP-5 的表达与急性肺水肿互为因果,相互促进。PIRES-NETO等[7]研究结果显示,AQP-5 的表达量在不同病因致急性呼吸衰竭患者的肺组织中均增加,认为AQP-5 对肺损伤的反应可能随时间波动,并与肺损伤的强度和类型有关。本研究采用大潮气量机械通气诱导大鼠ALI,研究结果显示,与对照组大鼠相比,随着通气时间延长,各机械通气组肺组织体积逐渐增大,光镜下可见肺泡壁破裂、肺泡腔及肺间质内水肿液渗出、炎症细胞浸润等细胞形态学的损伤程度逐渐加重,肺系数逐渐升高,提示肺水肿程度逐渐增加;而AQP-5 在肺组织中的表达逐渐减少。相关性分析结果显示,肺系数与肺组织AQP-5免疫组织化学染色评分呈负相关。
FABREGAT 等[12]发现在低潮气量机械通气大鼠肺组织中,AQP-5表达随着暴露时间的延长而增加,肺水肿程度逐渐减轻,认为AQP-5 对肺组织有保护作用。在本研究中值得关注的是,1.0 h 组和1.5 h 组肺系数结果比较,差异无统计学意义,可以反映出在持续机械通气过程中,肺水肿加重程度呈现短暂的缓慢趋势。结合免疫组织化学结果,1.0 h 组和1.5 h 组AQP-5 染色强度评分比较,差异无统计学意义,AQP-5 在1.0 h 组和1.5 h 组肺泡上皮细胞膜的表达仅占对照组肺组织细胞的50%左右,这部分肺组织中的AQP-5 可能对肺泡水肿液清除存在代偿机制,减缓肺水肿的进一步发生。但这种代偿机制并非持续作用,随着通气时间延续到2 h,肺泡上皮细胞及血管内皮完整性破坏严重,AQP-5 表达下降,AQP-5 对水通量的调节超过正常转运限度,对肺水清除出现失代偿。由此可见,AQP-5 参与机械通气致肺水肿的发生、发展,对肺泡水肿液的及时清除和吸收起到关键作用。
综上所述,随着机械通气时间延长,肺水肿程度逐渐加重,肺组织中AQP-5 表达逐渐减少,表明AQP-5参与机械通气致肺水肿的发生、发展。
