重组白细胞介素-35对支气管哮喘模型小鼠T淋巴细胞亚群及细胞因子的影响*
2021-03-04胡显惠李辉唐晨曦苏云娟经廷森
胡显惠,李辉,唐晨曦,苏云娟,经廷森
(重庆市綦江区人民医院,重庆401420)
支气管哮喘(bronchial asthma, BA)是一种常见的与免疫功能紊乱相关的慢性肺部疾病,临床症状主要为反复发作的喘息、胸闷、咳嗽和气促等,严重影响患者的身体健康和生活质量。支气管哮喘是由嗜酸性粒细胞、T 淋巴细胞、肥大细胞、中性粒细胞等多种炎症细胞和细胞组分参与的慢性气道炎症疾病[1]。哮喘的发病是遗传因素和环境因素综合作用的结果,传统观点认为Th1/Th2细胞功能失衡在哮喘的发生、发展中有重要作用,但尚不足以解释哮喘发病的全部机制[2]。近年来Th17 细胞和Treg 细胞的被发现及其在炎症中的作用进一步完善了支气管哮喘发病的免疫学机制[3]。白细胞介素(Interleukin, IL) -35 (IL-35) 是由Treg 细胞分泌的抗炎症细胞因子,在维持T 细胞稳态中有重要作用[4]。本研究旨在研究重组IL-35(rIL-35)对支气管哮喘模型小鼠T 淋巴细胞亚群及细胞因子的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 实验动物和细胞
SPF 级雄性BALB/c 小鼠100 只,7 周龄,体重19~22 g,购自北京维通利华有限公司[实验动物生产许可证号:SCXK(京)2016-0003],于24~26℃、相对湿度50%~60%、通风良好的SPF 级屏障室内饲养,期间自由进食及饮水。中华仓鼠卵巢细胞(CHO 细胞)购自ATCC 细胞库,采用DMEM 高糖培养基(含10%PBS、1%青链霉素)在5%二氧化碳、37℃的培养箱中培养。
1.2 试剂
佛波酯(PMA)、离子霉素(ionomycin)、布雷非德菌素(BFA)、卵白蛋白(OVA)和乙酰甲胆碱均购自美国Sigma公司,淋巴细胞分离液购自北京索莱宝科技有限公司,抗小鼠CD4-FITC 抗体购自艾美捷科技有限公司,抗小鼠CD25-PE 抗体购自美国Pepro Tech 公司,抗小鼠白细胞介素-17(IL-17)、Foxp3-APC、PE-anti-IgG1 抗体购自英国Abcam 公司,小鼠白细胞介素-2(IL-2)、γ干扰素(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-22(IL-22)、白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)酶联免疫检测试剂盒、BCA 蛋白定量试剂盒购自广州碧云天生物技术有限公司,Th1、Th2、Th17和Foxp3专用固定液,Th1、Th2、Th17 和Treg细胞专用破膜剂,购自美国Ebioscience公司。
1.3 rIL-35蛋白表达与纯化的检测
根据美国国立生物技术信息中心(NCBI)小鼠rIL-35 的核苷酸序列,采用双酶切构建PcDNA5-rIL-35-HIS 真核表达载体,采用Lipofectamine 2000将质粒转染至对数生长期的CHO 细胞中。转染48 h后加入1 μg/ml 的嘌呤霉素进行筛选,14 d 后可见单克隆群落形成,挑取生长状态良好的进行扩大培养。收集未转染细胞和过表达rIL-35 细胞培养基上清液,采用镍柱亲和层析纯化rIL-35 蛋白,超滤浓缩,BCA 蛋白定量试剂盒检测rIL-35 蛋白浓度。取适量蛋白稀释后SDS-PAGE 电泳,考马斯亮蓝染色、脱色,检测rIL-35蛋白纯度。
1.4 复制支气管哮喘小鼠模型
100只小鼠采用随机数字表法分为对照组、哮喘组、rIL-35低剂量组、rIL-35中剂量组和rIL-35高剂量组,每组20 只。分别在第1 天和第7 天向哮喘组和rIL-35 各剂量组小鼠腹腔注射OVA 致敏液(含100 μg OVA 和2.25 mg 氢氧化铝)0.2 ml/只,哮喘组和rIL-35 各剂量组小鼠第14 天开始雾化吸入5%OVA,30 min/次,1 次/d,连续雾化7 d 以诱发哮喘。对照组小鼠则以生理盐水代替OVA 致敏液。rIL-35各剂量组小鼠在激发后的第7 天开始腹腔注射不同剂量的rIL-35(低剂量组3 μg/只、中剂量组10 μg/只和高剂量30 μg/只)[5],1 次/d,连续5 d。对照组和哮喘组小鼠则以等量生理盐水替代rIL-35 进行注射。
1.5 气道反应性检测
每组随机选择小鼠4只,于末次雾化24 h后,麻醉,剥离暴露气管,行气管插管。静脉留置针插入颈外静脉后放入测试仪中,检测肺阻力(lung resistance,RL)和肺顺应性(dynamiccompliance,Cdyn)。将小鼠固定于体描箱内的操作台上,连接呼吸机,设定呼吸比为15∶10,潮气量5 ml/kg,呼吸频率90 次/min。曲线平稳后,每组3 只小鼠分别注射0.05 mg/kg、0.10 mg/kg和0.20 mg/kg的乙酰甲胆碱,另1只小鼠注射等量生理盐水(0.9%,0.1 ml/kg)。每次注射后连续采集记录5 min。
1.6 支气管肺泡灌洗液(BALF)的获取及处理
rIL-35 注射14 d 后,干冰安乐处死所有小鼠,呈仰卧位固定于自制小动物手术台,打开胸腔进行气管插管,结扎左侧主支气管,采用3 ml 预冷PBS行支气管肺泡灌洗3 次,收集BALF,将BALF 5 000 r/min 离心5 min,取上清液,置入-80℃冰箱冷冻保存备用。采用离心涂片机对回收的BALF 进行细胞收集,HE 染色,光学显微镜下计数和分类炎症细胞。
1.7 流式细胞仪检测T淋巴细胞亚群
rIL-35注射14 d后,采用淋巴细胞分离液(Ficoll)密度梯度离心法提取BALF中单个核细胞(PBMC)。采用RPMI 1640完全培养基重悬PBMC并调整细胞浓度至1.5×106个/ml,加入终浓度为25 ng/L的PMA、1 mg/ml的ionomycin、3 mg/ml的BFA,以1 ml/孔接种于24孔板,培养箱中继续培养5 h。重悬PBMC 于流式管,PBS洗涤2次,5 000 r/min离心5 min,弃上清液。加入5 ml 抗CD4-FITC 抗体(Treg 细胞检测管需同时加入5 ml 抗CD25-PE 抗体),室温避光孵育20 min。PBS洗涤2 次,离心弃上清。加入200 μl Th1、Th2、Th17和Foxp3 专用固定液,室温避光孵育20 min。PBS洗2 次,5 000 r/min 离心5 min。加入200 μl Th1、Th2、Th17 和Treg 细胞专用破膜剂,室温避光孵育20 min。PBS 洗涤2 次,每种细胞的对照管加入5 ml抗PE-anti-IgG1同型对照抗体,实验管分别加入5 ml抗γ-IFN-PE、IL-4-PE、IL-17 和Foxp3-APC 抗体,室温避光孵育20 min。PBS洗涤3次,加入500 ml PBS重悬细胞,采用流式细胞仪进行检测。使用Cell Quest软件分析T淋巴细胞亚群水平。
1.8 细胞因子水平检测
采用酶联免疫吸附实验(ELISA)检测小鼠BALF中IgE、IL-2、IFN-γ、IL-4、IL-5、IL-17、IL-22、IL-10和TGF-β 水平,操作严格按相关试剂盒说明书进行。
1.9 统计学方法
数据分析采用SPSS 21.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或析因设计的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠一般状态比较
对照组小鼠未见明显异常。哮喘组小鼠致敏后活动减少,雾化激发时出现不同程度的咳嗽、呼吸急促、烦躁不安、抓耳挠腮、腹部抽搐及大小便失禁等症状。rIL-35 低剂量组、rIL-35 中剂量组、rIL-35 高剂量组小鼠雾化激发时上述症状减轻。
2.2 各组小鼠气道反应性比较
各组小鼠激发时RL和Cdyn比较,经析因设计的方差分析,不同组激发时RL和Cdyn比较,差异有统计学意义(F=986.310和31.160,均P=0.000)。不同剂量乙酰甲胆碱激发时RL和Cdyn比较,差异有统计学意义(F=2 765.867和207.625,均P=0.000)。乙酰甲胆碱与rIL-35 存在交互作用,随着乙酰甲胆碱剂量增大,rIL-35剂量减小,激发时RL越大(F=202.320,P=0.000),Cdyn越小(F=5.623,P=0.000)。见表1、2。
表1 各组小鼠激发时RL变化 (cmH2O/ml·s,±s)

表1 各组小鼠激发时RL变化 (cmH2O/ml·s,±s)
组别对照组乙酰甲胆碱/(mg/kg)生理盐水/(ml/kg)1.23±0.10 0.10 2.01±0.24 0.05 1.76±0.21 0.20 2.59±0.33哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组1.17±0.11 1.24±0.11 1.19±0.09 1.26±0.14 8.51±0.66 7.33±0.80 5.77±0.58 4.14±0.39 4.36±0.35 3.73±0.35 3.08±0.29 2.57±0.24 11.90±1.05 9.42±1.03 7.64±0.77 5.08±0.49
表2 各组小鼠激发时Cdyn变化 (ml/cmH2O,±s)
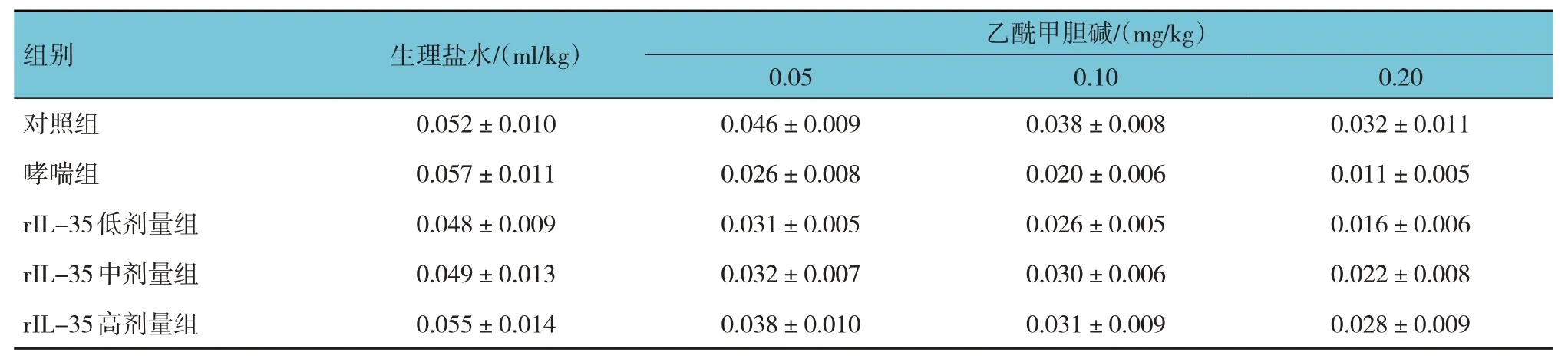
表2 各组小鼠激发时Cdyn变化 (ml/cmH2O,±s)
组别对照组乙酰甲胆碱/(mg/kg)生理盐水/(ml/kg)0.052±0.010 0.10 0.038±0.008 0.05 0.046±0.009 0.20 0.032±0.011哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组0.057±0.011 0.048±0.009 0.049±0.013 0.055±0.014 0.020±0.006 0.026±0.005 0.030±0.006 0.031±0.009 0.026±0.008 0.031±0.005 0.032±0.007 0.038±0.010 0.011±0.005 0.016±0.006 0.022±0.008 0.028±0.009
2.3 各组小鼠BALF中细胞计数和分类
各组小鼠BALF 中细胞总数、淋巴细胞、中性粒细胞和嗜酸性粒细胞等炎症细胞数量的比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较,与对照组比较,哮喘组小鼠BALF 中的细胞总数、淋巴细胞、中性粒细胞和嗜酸性粒细胞的数量均增加(P<0.05);与哮喘组小鼠比较,rIL-35 低剂量组、rIL-35 中剂量组、rIL-35 高剂量组小鼠BALF 中的细胞总数、淋巴细胞、中性粒细胞和嗜酸性粒细胞的数量均减少(P<0.05),均呈随rIL-35 蛋白剂量增加而减少的趋势。见表3。
2.4 各组小鼠BALF中T淋巴细胞亚群的变化
各组小鼠BALF 中Th2、Th17、Th1、Treg、Th1/Th2、Th17/Treg 的比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较,与对照组比较,哮喘组小鼠BALF 中Th2、Th17、Th17/Treg 水平升高,Th1、Treg、Th1/Th2 水平降低(P<0.05);与哮喘组比较,rIL-35 低剂量组、rIL-35 中剂量组、rIL-35 高剂量组小鼠BALF中Th2、Th17、Th17/Treg 水平降低(P<0.05),均呈随rIL-35 剂量增加而降低的趋势,Th1、Treg、Th1/Th2 水平升高(P<0.05),均呈随rIL-35 剂量增加而升高的趋势。见表4。
2.5 各组小鼠BALF 中IgE、IL-2、IFN-γ、IL-4 和IL-5水平比较
各组小鼠BALF 中IgE、IL-2、IFN-γ、IL-4 和IL-5 水平比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较,与对照组比较,哮喘组小鼠BALF 中IL-2、IFN-γ 水平降低,而IgE、IL-4 和IL-5 水平升高(P<0.05);与哮喘组比较,rIL-35低剂量组、rIL-35中剂量组、rIL-35高剂量组小鼠BALF 中IL-2、IFN-γ 水平升高(P<0.05),且呈随rIL-35 剂量增加而升高的趋势,IgE、IL-4 和IL-5 水平降低(P<0.05),均呈随rIL-35 蛋白剂量增加而降低趋势。见表5。
表3 各组小鼠BALF中细胞计数比较 (±s)
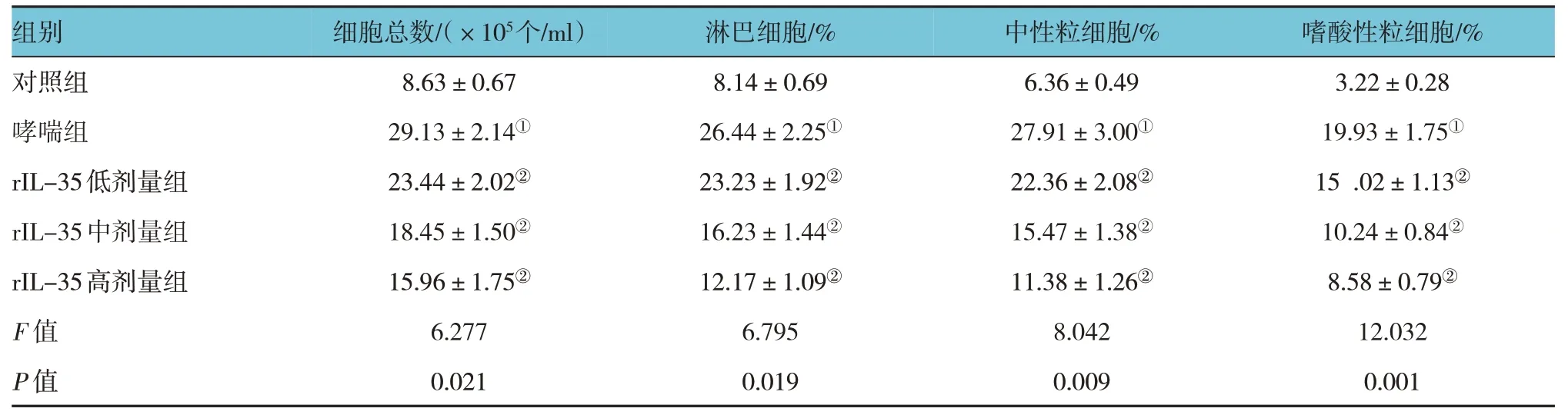
表3 各组小鼠BALF中细胞计数比较 (±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别细胞总数/(×105个/ml)嗜酸性粒细胞/%淋巴细胞/%中性粒细胞/%对照组哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组F 值P 值8.63±0.67 29.13±2.14①23.44±2.02②18.45±1.50②15.96±1.75②6.277 0.021 3.22±0.28 19.93±1.75①15 .02±1.13②10.24±0.84②8.58±0.79②12.032 0.001 8.14±0.69 26.44±2.25①23.23±1.92②16.23±1.44②12.17±1.09②6.795 0.019 6.36±0.49 27.91±3.00①22.36±2.08②15.47±1.38②11.38±1.26②8.042 0.009
表4 各组小鼠BALF中T淋巴细胞亚群比较 (±s)

表4 各组小鼠BALF中T淋巴细胞亚群比较 (±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别Th17/Treg Th1/%Th2/%Th17/%Treg/%Th1/Th2对照组哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组F 值P 值0.32±0.06 1.52±0.12①1.10±0.10②0.83±0.12②0.66±0.09②7.833 0.017 20.60±2.01 11.57±1.33①14.05±1.22②17.01±1.39②17.53±1.41②2.268 0.040 2.25±0.21 5.71±0.48①4.95±0.42②4.13±0.39②3.50±0.33②3.526 0.034 2.51±0.20 5.97±0.46①4.91±0.36②4.11±0.34②3.37±0.30②4.804 0.029 7.83±0.62 3.92±0.33①4.42±0.37②5.04±0.49②5.56±0.50②2.850 0.037 9.18±1.10 2.19±0.30①3.65±0.33②4.59±0.42②5.89±0.57②5.776 0.022
表5 各组小鼠BALF中IgE、IL-2、IFN-γ、IL-4和IL-5水平比较 (pg/ml,±s)

表5 各组小鼠BALF中IgE、IL-2、IFN-γ、IL-4和IL-5水平比较 (pg/ml,±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别IL-5 IgE IL-2 IFN-γ IL-4对照组哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组F 值P 值30.13±2.89 203.41±22.30①130.15±11.44②99.41±7.75②75.58±7.92②15.728 0.000 5.05±0.43 19.14±1.51①14.36±1.21②12.87±1.13②9.04±0.78②6.275 0.020 95.50±10.03 28.80±3.14①43.45±4.09②61.94±7.29②73.14±7.03②7.027 0.017 150.17±16.25 40.93±3.77①84.16±9.02②107.28±9.64②119.77±11.73②8.219 0.010 57.47±6.11 222.23±24.31①147.51±12.05②100.79±9.58②91.29±8.88②9.002 0.005
2.6 各组小鼠BALF 中IL-17、IL-22、IL-10 和TGF-β水平比较
各组小鼠BALF 中IL-17、IL-22、IL-10 和TGF-β 水平比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较,与对照组比较,哮喘组小鼠BALF 中IL-17、IL-22 水平升高,而IL-10 和TGF-β 水平降低(P<0.05);与哮喘组比较,rIL-35低剂量组、rIL-35中剂量组、rIL-35高剂量组小鼠BALF中IL-17、IL-22水平降低(P<0.05),且呈随rIL-35 剂量增加而降低趋势,IL-10 和TGF-β水平升高(P<0.05),且呈随rIL-35 剂量增加而升高趋势。见表6。
表6 各组小鼠BALF中IL-17、IL-22、IL-10和TGF-β水平比较 (pg/ml,±s)

表6 各组小鼠BALF中IL-17、IL-22、IL-10和TGF-β水平比较 (pg/ml,±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别TGF-β IL-17 IL-22 IL-10对照组哮喘组rIL-35低剂量组rIL-35中剂量组rIL-35高剂量组F 值P 值62.91±5.77 27.04±2.55①38.82±3.93②49.48±5.03②53.77±5.21②4.164 0.029 10.59±1.12 52.88±5.65①39.76±3.54②30.03±3.01②22.21±2.14②10.327 0.002 15.82±1.47 60.17±6.10①48.61±4.29②39.95±3.56②30.06±3.37②7.165 0.016 8.93±0.72 3.31±0.29①6.19±0.59②6.76±0.58②7.82±0.64②5.003 0.024
3 讨论
T 淋巴细胞在支气管哮喘的发病过程中起着重要作用。研究显示,肥大细胞是哮喘发生的始动效应细胞,而由T 淋巴细胞分泌的细胞因子导致的炎症直接启动哮喘的发病[5]。T 辅助淋巴细胞(CD4+)包含Th1、Th2、Th17 和Treg 4 类不同的细胞亚群。传统研究认为由CD4+分化的Th1/Th2 细胞比例失衡是导致支气管哮喘气道炎症的基础[6]。Th2 细胞优势已被证实是变应性哮喘形成与进展的关键机制,哮喘发作时Th2 细胞免疫功能亢奋,Th1 细胞免疫反应下降[7]。近年来Th17/Treg 细胞平衡在变态反应性疾病中的免疫调节功能逐渐引起注意。研究显示,Th17 细胞可介导支气管哮喘患者体内炎症的发展,并破坏机体免疫平衡,Treg 细胞的功能受到抑制,Th17/Treg 细胞比例升高[8]。
rIL-35 是IL-12 家族的新成员,是由EB 病毒诱导基因3 和IL-12 的p35 亚基组成的异源二聚体[9]。与其家族中的其他成员不同,rIL-35 主要发挥免疫抑制的功能,在炎症疾病和肿瘤的调节中发挥重要作用[10]。已有研究表明,LI-35 可抑制Th17 细胞的增殖分化,增强Treg 细胞的免疫抑制功能,从而抑制机体的过度免疫反应[11]。此外,VIGNALI 等[12]研究显示,IL-35 还可通过抑制IL-4 和GATA3 的表达阻碍Th2 细胞的分化,并可调节Th1 和Th2 细胞向Treg 细胞转化。综合上述研究结论,推测LI-35可能在Th1/Th2 和Th17/Treg 细胞平衡的调节中发挥着关键作用,有望为支气管哮喘等变态免疫性疾病的免疫调节和治疗提供新的思路。
本研究通过向支气管哮喘模型小鼠注射rIL-35蛋白,探究rIL-35 对哮喘模型小鼠T 淋巴细胞亚群及其分泌的细胞因子的影响。结果显示,哮喘模型小鼠BALF 中的细胞总数、淋巴细胞、中性粒细胞和嗜酸性粒细胞等炎症细胞的数量增加,表明小鼠肺组织内出现严重的炎症反应,小鼠模型复制成功。经注射rIL-35 后,小鼠BALF 中的细胞总数、淋巴细胞、中性粒细胞和嗜酸性粒细胞数量降低,并呈rIL-35 剂量依赖性降低趋势,提示给予rIL-35 可抑制哮喘小鼠的气道炎症反应。
Th1 和Th2 由共同的前体细胞Th0 分化而来,Th1 细胞通过分泌IL-2、IFN-γ、IL-12 等细胞因子介导细胞的免疫反应和迟发型超敏反应[13]。Th2 细胞分泌的IL-4、IL-6、IL-10 等细胞因子可激活抗原特异的B 细胞产生抗体,增强机体体液免疫[14]。Th17 作为一种效应性CD4+T 细胞,主要通过分泌IL-17、IL-21、IL-22 等多种炎症因子参与自身免疫性疾病、感染性疾病等多种疾病的免疫调节过程,在机体免疫中主要起促炎作用[15]。Treg 细胞主要通过分泌IL-10 和TGF-β 介导免疫抑制,可以负反馈调节T 细胞活化引起的免疫反应,具有维持自身免疫耐受的功能[16]。正常情况下,Th1/Th2 和Th17/Treg 细胞相互拮抗,共同维持机体免疫的平衡状态[17-18]。
为进一步分析rIL-35 抑制哮喘模型小鼠气道炎症的机制,本研究检测各组小鼠BALF 中Th1、Th2、Th17 和Treg 细胞亚群的水平,结果显示,哮喘组小鼠Th2 细胞、Th17 细胞、Th17/Treg 细胞比例较对照组小鼠增加,而Th1 细胞、Treg 细胞、Th1/Th2 细胞比例降低,与哮喘组比较,rIL-35 各剂量组小鼠Th2 细胞、Th17 细胞、Th17/Treg 细胞比例降低,且呈rIL-35 剂量增加而降低的趋势,Th1 细胞、Treg 细胞、Th1/Th2 细胞比例增加,且呈rIL-35 剂量增加而呈升高的趋势,表明rIL-35 可改善哮喘模型小鼠体内Th1/Th2 和Th17/Treg 细胞失衡。小鼠BALF中细胞因子的ELISA 检测结果显示,与对照组比较,哮喘组小鼠IL-2、IFN-γ、IL-10 和TGF-β 的水平降低,IgE、IL-4、IL-5、IL-17 和IL-22 水平升高,与哮喘组比较,rIL-35 各剂量组小鼠BALF 中IL-2、IFN-γ、IL-10 和TGF-β 的水平升高,且呈rIL-35 剂量增加而升高趋势,IgE、IL-4、IL-5、IL-17 和IL-22 水平降低,且呈rIL-35 剂量增加而降低趋势,表明rIL-35 可能通过促进抗炎细胞因子的释放、抑制促炎细胞因子的分泌、调控Th1/Th2 和Th17/Treg 细胞的分化改善支气管哮喘炎症反应的发展,增强肺部和呼吸道的免疫耐受,但具体信号通路有待后续深入研究。
综上所述,rIL-35 可有效调节支气管哮喘模型小鼠体内Th1/Th2 和Th17/Treg 细胞的免疫失衡,缓解哮喘气道炎症反应的发生,有望为支气管哮喘的临床治疗提供新的靶点。
