基于两种棘球蚴绦虫感染的小鼠肝组织病灶早期钙化比较
2021-03-03高风亦邢稚坤谭小武俞晓凡杨海成赵雪源廖原陈雪玲吴向未
高风亦,邢稚坤,谭小武,俞晓凡,杨海成,赵雪源,廖原,陈雪玲,吴向未*
(1 石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832008;2 石河子大学医学院免疫学教研室,新疆 石河子 832008)
棘球蚴病是由寄生于人和动物体内的棘球蚴引起的人畜共患病,俗称“棘球蚴病”[1]。我国包虫病类型主要可以分为泡型包虫病和囊型包虫病二种,分别由多房棘球绦虫(泡状棘球蚴)和细粒棘球绦虫(细粒棘球蚴)寄生于人体内部器官所致[2]。棘球蚴病感染人体后可寄生于人体各个脏器,以肝、肺为主,其他脑、肾、骨等脏器也有寄生。该病在我国的分布区域以西部牧区为主,新疆是高发地区之一,主要与放牧时接触羊、犬有关,患病人数居全球首位,是我西部农牧区群众致病负担的主要原因之一[3]。针对该疾病的发病机制,既往研究发现,泡状棘球蚴病灶外周无完整纤维包膜,呈类似于恶性肿瘤的浸润性生长;细粒棘球蚴病灶外周存在有纤维包膜,主要通过压迫周围组织、器官,从而引起组织细胞萎缩、坏死[4]。目前临床诊断包虫病以CT等影像学研究为主,结果提示疾病进展中,棘球蚴组织病灶周围伴有大量的钙化,钙化反映了包虫病的病理转归[5]。钙化作为一种与肉芽肿反应相关的慢性病理现象,是机体针对自身的一种保护[6]。目前我国针对肝棘球蚴病的治疗首选根治性手术治疗,但泡状棘球蚴有类癌样转移,一旦发生较大范围扩散,手术效果较差[7-8]。以往对包虫病钙化的研究大多集中在一种包虫病上,且研究对象往往处于病变中晚期。通过比较两种包虫病不同时期的钙化情况,可以明确其发病机制,进一步阐明两种包虫病早期疾病进展的差异,为临床诊断和治疗提供依据。
1 材料与方法
1.1 实验设计
分别用等量的两种不同棘球蚴原头节种植于哺乳动物肝脏,构建肝棘球蚴病感染模型,模拟寄生虫体内感染过程,比较不同类型棘球蚴病变病灶的钙化情况。
1.2 材料
1.2.1 实验动物
60只雌性C57BL/6 N小鼠购于北京维通利华实验动物技术有限公司,6~8周龄,体质量(16±2)g,动物质量合格证号:SCXK(京)2016-0006;20只子午沙鼠购于新疆维吾尔自治区疾控中心,雌性,8-12周龄,体质量(32±2)g,动物质量合格证号:SCXK(新) 2016-002;囊型肝包虫病羊肝购于新疆沙湾县屠宰场。
1.2.2 实验试剂
DMEM/L(美国GIBCO公司);RPMI-1640(美国GIBCO公司);苏木素染色液(北京九州柏林生物科技公司);伊红染液、茜素红钙盐染色液(北京索莱宝);兔多克隆抗体BMP-2(美国Abcam公司,ab14933);兔二步法试剂盒、DAB显色试剂盒(北京中杉金桥生物公司,PV-6001,ZLI-9018);粘附载玻片(江苏世泰实验器材公司)。
1.3 实验方法
1.3.1 棘球蚴原头节的提取
泡状棘球绦虫原头节:将约200 μL泡状棘球绦虫原头节悬液(约2 000个头节,实验室预留种鼠中提取泡球蚴原头节)腹腔注射至健康子午沙鼠体内,将确定感染泡状棘球蚴病5个月后的子午沙鼠作为获取泡状棘球绦虫原头节的种鼠,颈椎脱臼法处死小鼠并提取泡球蚴组织,将提取组织置于无菌盘中,将PBS漂洗3次,依次剪碎、研磨组织,过滤获得泡球蚴原头节,PBS漂洗20次,0.4%台酚蓝染色后显微镜下鉴定活力,若成活率达95%以上,分装到5 mL无菌试管内,并加入3 mL含10%胎牛血清的DMEM/L培养基培养,以备造模。
细粒棘球绦虫原头节:取囊型肝包虫病羊肝,当日清洗,消毒羊肝表面,无菌条件下50 mL注射器抽取包虫囊液,用PBS反复漂洗10次,提取细粒棘球蚴原头节并收集于无菌培养瓶中;随机抽取100 mL原头蚴,经0.4%台酚蓝染色后显微镜下鉴定原头节的活性,成活率达98%以上使用;分装到5 mL无菌试管内,并加入3 mLRPMI-1640培养基培养,以备造模。
1.3.2 棘球蚴原头节感染C57BL/6 N小鼠肝组织
将60只健康的6~8周龄C57BL/6 N小鼠随机分为2组,分别命名为泡状棘球蚴(alveolaris echinococcus,AE)组和细粒棘球蚴(cystic echinococcosis,CE)组,每组30只,每只小鼠称重后编号记录,配制戊巴比妥钠麻醉剂(浓度4%),按0.1 mL/100 g计算每只小鼠的麻醉剂量并记录,提前4~8 h禁食水;所有小鼠腹部用碘伏消毒后,用1 mL洁净注射器按每只小鼠麻醉剂量抽取水合氯醛,腹腔注射后将小鼠分组放置于预置鼠笼片刻,用皮镊刺激小鼠皮肤,观察麻醉效果,若麻醉效果欠佳,追加100 μL戊巴比妥钠;将麻醉后小鼠置于洁净工作台上,仰卧位固定四肢,再次碘伏消毒腹部手术区(剑突下2×2 cm范围)3遍,用无菌眼科剪剪开腹部皮层与肌层,切口大小约1~2 cm,暴露肝脏,用1 mL注射器抽取浓缩后棘球蚴原头节,用针头轻轻挑起肝脏被膜,缓慢注射棘球蚴原头节,被膜下见一约3×3 mm白色液泡,提示注射成功;使用4-0手术缝合线单纯间断缝合切口,再次消毒切口后放入相应鼠笼中饲养,每3日喂食喂水,每周更换垫料1次[9]。
1.3.3 相应时间点提取小鼠肝组织并甲醛固定
根据前期预实验结果,按上述方法构建棘球蚴小鼠肝脏感染模型,感染周期至180 d后,由于小鼠肝脏被棘球蚴大量侵袭,小鼠出现因肝衰竭导致的死亡,死亡率超过50%,故观察周期终点设为180天。故按注射后30、90、180 d时间点,排除因麻醉猝死、急性肝衰竭、剧烈过敏反应等其它培养期内不可抗拒因素导致的实验小鼠死亡,每个时间点随机选择5只小鼠提取肝组织;将小鼠置于洁净工作台上,采用急性大失血法(鼠眼眶动脉剪破)放血后颈椎脱臼法处死;将已处死小鼠仰卧位固定于洁净工作台上,用无菌眼科剪刀沿造模时手术路径剪开腹部皮层与肌层,切口约1~2 cm,充分暴露肝脏,可见注射棘球蚴原头节处肝叶有囊泡形黄色病灶,用组织剪游离肝周围结缔组织后充分暴露肝脏并提起后,沿第一肝门处小心剪断门静脉、肝动脉及胆总管,将组织置于10 mL EP管内并标记;用4%中性福尔马林固定液将肝组织固定,以备石蜡块制备。
1.3.4 肝组织石蜡包埋及制片
每个时间点取出5个小鼠肝组织,福尔马林固定24 h的肝组织,修剪成大小约1 cm×0.5 cm×0.1 cm的方形组织块;将组织块置于1/2石蜡+1/2二甲苯的混合物中,40 ℃恒温箱过夜;次日提升恒温箱温度至60 ℃,换纯蜡3次,每次1~2 h,将盛有组织的石蜡模具置于45 ℃~60 ℃烫板上,倒入材料并摆好,轻轻置于冷水盆中,待石蜡全部凝固后取出晾干;将包埋好的石蜡块修块后固定于切片机上切片,切片厚度5 μm,将切片在漂片机中展开,并将切片捞于粘附载玻片上,编号,65 ℃干烤1 h,将制作好的石蜡切片收入储片盒中,备后续染色用。
1.3.5 组织切片H-E染色
按编号选择时间点30、90、180 d小鼠肝组织切片,置于切片架上,60 ℃干燥箱烤片2 h,待石蜡融化后将切片按二甲苯-无水乙醇-95%乙醇-85%乙醇-75%乙醇的梯度酒精脱蜡,其中二甲苯脱蜡5分钟,乙醇2~3 min;将脱蜡后切片用去离子水快速泡洗1遍,放入苏木精染液中染色5 min后,酸水及氨水中分色各数秒钟,流水冲洗1 h后入去离子水片刻,再入75%与95%乙醇中脱水各10 min后,酒精伊红染色液染色2~3 min;染色后切片按梯度酒精透明,中性树胶盖玻片封固,贴好标签。
1.3.6 组织切片茜素红染色
按编号选择时间点30、90、180 d小鼠肝组织切片,置于切片架上,60 ℃干燥箱烤片2 h,待石蜡充分融化后将切片按二甲苯-无水乙醇-95%乙醇-85%乙醇-75%乙醇的梯度酒精脱蜡,其中二甲苯脱蜡5 min,乙醇2~3 min;将脱蜡后切片用去离子水快速泡洗一遍后竖立放置,彻底风干;切片用茜素红染液滴染20 min,双蒸水冲洗3次;常规脱水透明,中性树胶封固,贴好标签。
1.3.7 组织切片免疫组化染色
按编号选择时间点30、90、180 d小鼠肝组织切片,置于切片架上,60 ℃干燥箱烤片2 h,待石蜡融化后将切片按二甲苯-无水乙醇-95%乙醇-85%乙醇-75%乙醇的梯度酒精脱蜡,其中二甲苯脱蜡5 min,乙醇2~3 min;切片竖立放入EDTA裂解液中,高压锅内高压5 min(温度121 ℃)抗原修复后,切片置于凉水槽中室温晾干,自来水洗3遍后,胰酶消化3 min;1%PBS缓冲液洗涤3遍(每遍5 min),甩干,擦水,油笔画圈,滴加适量内源性过氧化物酶阻断剂,室温孵育10 min后,1%PBS缓冲液冲洗5 min×3次,加50 μL BMP-2兔多克隆抗体,4 ℃冰箱过夜;第二天37 ℃温箱复温30 min后,1%PBS缓冲液洗涤5 min×3次,滴加100 μL增强酶标山羊抗兔IgG聚合物,室温孵育1 h,1%PBS缓冲液冲洗5 min×3次;加入数滴新鲜配制的1∶100DAB显色液,室温孵育5~8 min,自来水终止显色;苏木素染色3~5 min,盐酸酒精分化3 s,自来水冲洗5 min×3次,梯度酒精1 min晾干后,中性树胶封片,贴好标签。
1.3.8收集遴选组织切片后显微镜观察并半定量检测钙化程度
两种棘球蚴共遴选150张组织切片,每组75张,每个时间点25张,分别使用倒置显微镜观察染色后组织切片,并拍摄图像,将茜素红染色切片图像用ImageJ v1.8.0软件进行处理,将茜素红染色结果中的钙化区域提取后计算面积并统计数值,半定量检测钙化程度,用Excel表格统计检测结果。
1.4 统计学分析
使用SPSS 20.0软件进行统计分析,计量资料以均数±标准差表示,所有实验结果重复3次。以P≤0.05为差异有统计学意义。各实验组数据符合正态分布、方差齐时,实验组间比较(细粒棘球蚴组与泡状棘球蚴组)用两独立样本t检验。实验组内(3个时间节点的组织钙化程度)的比较用方差分析。若各实验组数据不符合正态分布、方差齐时,采用非参数Tamhane’s T2(M)检验。
2 结果
2.1 两组棘球蚴感染肝组织的H-E染色结果
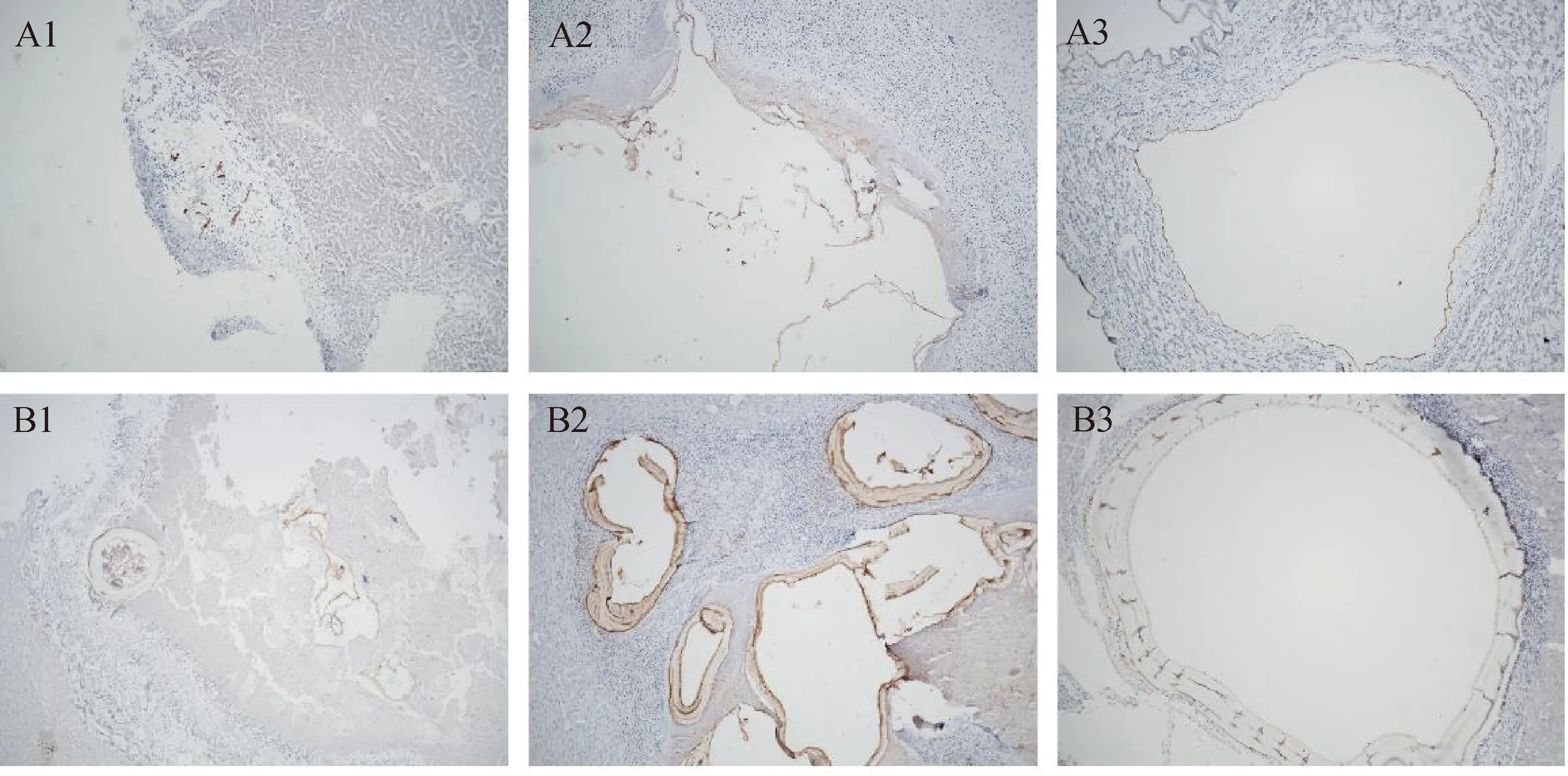
通过将两种棘球蚴感染的肝组织切片进行H-E染色比较,结果表明:在30、90、180 d 3个时间点,alveolaris echinococcus(AE,泡状棘球蚴)组和cystic echinococcosis(CE,细粒棘球蚴)组组织切片在显微镜下均可见到棘球蚴感染肝组织后产生的囊泡样病灶,病灶周围有明显的组织炎性带,病灶内残余原头节数量随时间增加而逐渐减少,至180 d时完全消失;病灶的大小随着时间增加而增大。其中,AE组病灶囊壁欠规整且不连续,CE组病灶囊壁较AE组更规则且相对完整(图1)。这说明棘球蚴感染肝组织后形成了较典型的包虫感染病灶,有形成钙化的条件。

A组为泡状棘球蚴肝组织;B组为细粒棘球蚴肝组织,1、2、3分别代表棘球蚴感染30、90、180 d时间点(100×)图1 两种棘球蚴肝组织不同时间点H-E染色
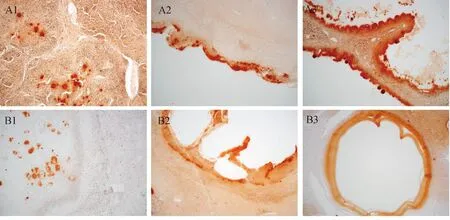
A组为泡状棘球蚴肝组织;B组为细粒棘球蚴肝组织,1、2、3分别代表棘球蚴感染30、90、180 d时间点(100×)图2 两种棘球蚴组织不同时间点BMP-2免疫组化染色高表达区域
2.2 反映钙化程度的BMP-2在棘球蚴病灶囊壁的表达情况
反映钙化程度的BMP-2在棘球蚴病灶囊壁的表达情况,见图2。
BMP-2是参与钙化形成的重要因子,通过将两种棘球蚴感染的肝组织切片进行针对BMP-2的免疫染色,结果表明:在30、90、180 d 3个时间点,AE组和CE组的囊泡样病灶内均可见连续或不连续的褐色沉积物,提示BMP-2的高表达。其中,30 d肝组织病灶内的褐色沉积主要为分布于囊内的残余包虫;90 d和180 d肝组织病灶内的的褐色沉积主要分布于囊壁上(图2)。这说明,棘球蚴感染一定时间后的肝组织病灶有钙化,且钙化主要分布于病灶囊壁。
2.3 茜素红染色结果
通过将两种棘球蚴感染的肝组织切片进行茜素红染色,结果提示:在30、90、180 d 3个时间点,AE组和CE组的肝组织病灶均可见到橘红色颗粒样沉积。其中,30 d组织病灶中的沉积颗粒集中在病灶囊内,囊壁无明显橘红色沉积,90 d和180 d组织病灶中,橘红色沉积呈线状分布于囊壁上,囊内无明显沉积颗粒;AE组病灶囊壁上的钙盐沉积呈颗粒堆积状凸入囊内,囊壁形态不规则、不连续,CE组病灶囊壁上的钙盐沉积呈半透明条带状,囊壁形态规则、连续(图3)。
这说明,棘球蚴感染一定时间后的肝组织病灶有钙化且两种棘球蚴肝病灶的钙盐沉积方式不同。
A组为泡状棘球蚴肝组织;B组为细粒棘球蚴肝组织,1、2、3分别代表棘球蚴感染30、90、180 d时间点(100×)图3 两种棘球蚴不同时间点肝组织茜素红染色
2.4 针对茜素红染色和免疫组化染色结果进行半定量检测和统计学分析
为进一步比较两种棘球蚴肝组织病灶钙化程度的不同,使用ImageJ v1.8.0软件和SPSS 20.0分别统计和分析钙化面积,结果显示:在30、90、180 d 3个时间点,两种棘球蚴肝组织病灶的整体钙化程度均随时间增加而增大,其中,在30、90、180 d 3个时间点,AE组的钙化面积均小于CE组(P<0.05)(图4)。这说明,在棘球蚴原头节感染肝组织的整个周期内,棘球蚴感染的肝组织病灶钙化程度随时间增加而增大,其中,细粒棘球蚴感染的肝组织病灶钙化程度较泡状棘球蚴感染的肝组织病灶钙化程度高。

图4 根据两种染色半定量检测结果的差异性比较
3 讨论
肝包虫作为一种寄生虫疾病,其病灶特点与其他寄生虫病类似,病理过程可简单分为增殖、纤维化、钙化三个阶段[10]。彭心宇等[11]的研究表明,肝包虫病灶有内、外两层,因这两层均是肉芽肿反应引起的纤维囊样病变,内层是虫体在进入肝组织后引起其周围组织发生局部肉芽肿反应后不断生长的虫体导致该肉芽肿组织随之受压、膨大并逐渐增厚形成,而外层则是由于内层纤维囊壁膨胀挤压囊周Glisson系统和肝静脉系统,导致局部肝组织营养不良性坏死,导致组织纤维化,形成的另一层纤维囊壁,两者形成机制不同。而机体为了限制包虫囊性病灶的进一步扩大,使病灶周围出现营养不良性钙化,属于病理性异位钙盐沉积,是一种机体的自我保护反应。当完整的钙化囊壁形成,病变局限于钙化囊壁内而无法发展,提示病变自愈[12]。两种棘球蚴在机体中侵袭方式的不同使两者的钙化出现差异进而产生不同的病理转归[13]。本实验中,通过观察组织切片化学染色结果,发现炎性肉芽肿反应演变的钙化主要集中于内囊壁,而外周有明显的挤压坏死的肝细胞,这进一步验证了肝棘球蚴病的病变机制。
近年来,针对肝泡状棘球蚴病和肝细粒棘球蚴病等病灶钙化特点的研究以针对某一种棘球蚴病的影像学研究为主[14]。这类研究的对象往往为病程较长患者,病灶性质趋于稳定,无法观察该疾病早期病变的病灶特点,且影像学检查相较于组织学,虽然在临床诊断上有方便、快捷的特点,但对于病灶的病理特点和病灶的组织学细节无法直接观察,不易获得周期完整的病理演变进程[15-16]。因此,基于本课题组既往研究,作者以哺乳动物体内实验模拟两种棘球蚴感染肝组织后,较为完整的观察两种肝棘球蚴病早期病变过程中病灶的钙化特点及差异。主要通过按30 d、90 d、180 d 3个时间点分别进行病变肝组织化学染色,并选择骨形态发生蛋白-2(BMP-2)作为免疫组化染色对象,以明确钙化的分布情况及程度。BMP-2是一种骨诱导性生长因子,于1965年首次发现,是迄今为止已知的最强的骨诱导因子之一[17-18]。既往研究表明包虫病囊肿囊壁细胞具有成骨潜能,BMP-2促进囊壁细胞的矿化和成骨成熟[19],且BMP-2已被证实具有参与和调控间充质干细胞成骨分化和骨组织形成的能力[20-21]。通过对组织切片进行免疫组化染色,寻找BMP-2高表达的区域,结果发现BMP-2在内囊壁高表达,验证了肝棘球蚴病灶的钙化主要在内囊壁,同时也说明肝棘球蚴病内层病灶以炎性肉芽肿性炎症为主要病变表现;两种棘球蚴感染病灶的大小和钙化程度均随着时间增加而增大,细粒棘球蚴囊壁钙化灶呈单一蛋壳样或条带状,主要集中分布于包虫的内层囊壁,而泡状棘球蚴囊壁钙化灶为侵袭性多发病灶,呈点状或团块状,无法形成完整的钙化囊壁,且实验过程的前中期细粒棘球蚴感染病灶的钙化程度较泡状棘球蚴感染病灶钙化程度高,这说明相较于泡状棘球蚴,细粒棘球蚴相对完整的病灶形态更易形成大量钙化,以尽快达到机体自我保护状态。
本实验旨在研究两种肝棘球蚴病变早期病灶的钙化特点及差异,实验周期为0~180 d,因实验过程中发现泡状棘球蚴病灶钙化程度的增加并非线性增长,故选择30、90、180 d 3个钙化程度最明显的节点进行整体统计分析,相应时间节点之间的具体病理变化未做进一步研究,且模型培养180 d后因小鼠肝脏机械性损伤导致的死亡率较高,无法进行后续观察研究,故观察周期局限为180 d。
综上所述,在小鼠肝棘球蚴病病变早期,两种棘球蚴感染的肝组织病灶均可形成囊壁钙化,主要为内囊钙化,肝细粒棘球蚴病灶钙化程度较肝泡状棘球蚴病灶钙化程度更高,更易形成完整的钙化囊壁以达成稳定病灶,这种差异也间接反映了两种棘球蚴在体内侵袭方式和转归的不同。通过观察比较两种肝棘球蚴感染病灶早期的各阶段变化差异,发现病变过程中的钙化特点,为后续该种疾病针对钙化的相关组织学研究提供研究基础,也可以为两种肝棘球蚴病的早期临床诊疗方式提供更多组织学依据和借鉴意义。
