一种具有光热/pH双响应纳米载药体系的制备及性能初探*
2021-03-03杨建英陈燕宏李新春
杨建英,陈燕宏,杨 帆,李新春
(广西医科大学药学院药物分析教研室,南宁 530021)
恶性肿瘤对人类健康构成严重威胁,是病死率最高的疾病之一[1-4]。目前,化疗是对抗恶性肿瘤的主要手段,但单个化疗药物通常存在抑瘤效果不足或毒副作用大等缺点,难以达到有效治疗目的[5-8]。设计一种响应性功能载体实现抗癌药物的高效运输和协同抑瘤是一种行之有效的手段[9-11]。
硫化铜(CuS)纳米粒是一种常见的半导体材料[12-14],可以有效吸收808 nm 近红外光辐射而产生热能,达到对肿瘤细胞的热杀伤作用[15-16],是一种极具前途的药物载体材料。聚多巴胺(polydopamine,PDA)是一种生物兼容性良好的仿生材料,其具有独特的化学结构,能与含有氨基、亚胺、羟基及邻苯二酚官能团的化合物发生反应,从而赋予PDA 分子灵活的二次修饰能力[17-22]。聚丙烯酸(polyacrylic acid,PAA)富含羧基,具有pH 响应性,在碱性条件下羧基发生解离带上负电荷[23-24],从而可以通过静电作用与带正电荷的药物分子结合。重要的是,在肿瘤微酸环境下,PAA 的羧酸负离子与氢离子结合,从而将带正电的药物分子解离,实现药物分子在肿瘤细胞内的定点释放[25-26]。基于此,本文开发了一种具有光热/pH 双响应的纳米载药体系,在CuS 纳米粒表面通过自聚合反应包裹上PDA,进一步地,通过迈克尔加成法在其表面修饰PAA,得到CuS-PDA-PAA,为构建集光热效应和pH 响应于一体的抗肿瘤纳米药物提供一定的研究基础。
1 材料与方法
1.1 主要试剂
盐酸多巴胺(DA,货号:L1810071)、三羟甲基氨基甲烷盐酸盐(Tris-HCl,货号:H1404090)、氢氧化钠(NaOH,货号:E1907037)均购自阿拉丁试剂上海有限公司;CuS 纳米粉末和PAA 为广西医科大学药学院实验室自制。
1.2 实验仪器
冷冻干燥机(北京博医康实验仪器有限公司);十万分之一电子分析天平(美国梅特勒-多利多仪器上海有限公司);高速离心机(上海湘仪离心机仪器有限公司);超纯水机(成都越纯科技有限公司);Zetasizer Nano 纳米粒度电位仪(英国马尔文仪器有限公司);超声波清洗机(昆山市超声仪器有限公
司);紫外-可见分光光度计(日本岛津仪器有限公司);X-射线光电子能谱仪(XPS)(赛默飞世尔科技有限公司);傅里叶变换红外光谱仪(FT-IR)(赛默飞世尔科技有限公司);透射电子显微镜(TEM)(日本电子株式会社);磁力搅拌器(艾卡广州仪器设备有限公司)。
1.3 纳米载体制备条件优化
1.3.1 CuS浓度和超声时间对于粒径的影响 称取适量CuS 纳米粉,分散于一定体积水中,使其浓度分别为12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL,超声处理10 min 后,得到CuS 分散液。在确定最优浓度后,配制该浓度的CuS 水溶液,分别超声处理5 min、10 min、15 min、30 min、45 min、60 min,得到相应的CuS分散液。
1.3.2 DA浓度和聚合时间对于CuS-PDA粒径的影响 称取CuS 纳米粉适量,置于30 mL 浓度为0.01 mol/L的Tris缓冲液(pH=8.5)中,配制成最优浓度并超声分散均匀。另称取DA 适量,溶于1 mL 水中,转移至上述CuS 分散液中,使DA 终浓度分别为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL 和80 μg/mL,于室温条件下搅拌反应8 h,反应结束后于12 000 r/min 离心10 min,弃去上清,下层沉淀用水反复洗涤3 次,用水重新分散,得到CuS-PDA 分散液。确定最优浓度后,按上述操作,于室温条件下,考察DA 聚合时间(分别为2 h、4 h、6 h、8 h、10 h)对产物粒径的影响。
1.3.3 PAA 浓度和反应时间对于CuS-PDA-PAA 粒径的影响 取上述制备的CuS-PDA 分散液适量,用浓度为0.01 mol/L 的Tris 缓冲液(pH=8.5)稀释成30 mL。另称取PAA固体适量,溶于1mL水,于搅拌条件下将PAA 水溶液逐滴加入上述CuS-PDA 分散液中,使PAA 终浓度分别为10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL 和160 μg/mL,室温条件下搅拌8 h,通过迈克尔加成反应得到CuS-PDA-PAA 纳米复合物。反应结束后于12 000 r/min离心10 min,弃去上清,下层沉淀用水反复洗涤3 次,用水重新分散,得到CuS-PDA-PAA 分散液。确定最优浓度后,按上述操作,考察反应时间(分别为2 h、4 h、6 h、8 h、10 h)对CuS-PDA-PAA 纳米复合物粒径的影响。
1.3.4 粒径分布及Zeta 电位 采用纳米粒度电位仪测定CuS、CuS-PDA 和CuS-PDA-PAA 的粒度分布及电位。
1.3.5 纳米载体稳定性考察将制备得到的CuSPDA-PAA 纳米载体分散液超声处理30 min,待其分散均匀后,分别取200 μL分散液于6只小瓶中,分别于4℃及25℃条件下,保存21 d,考察其在水、PBS(10 mmol/L,pH=7.4)和DMEM培养基中的稳定性。
2 结果
2.1 纳米载体表征分析
本实验采用各种光谱和电镜技术对纳米载体进行了表征和验证。如图1A所示,CuS纳米粒在紫外-可见光区域并无特征性吸收峰[27]。CuS 修饰上PDA及PAA后,紫外-可见光谱无明显变化[28]。
如图1B所示,在CuS-PDA中,可以观察到PDA的特征峰,如1 618 cm-1和1 485 cm-1为苯环上C=C伸缩振动峰,2 927 cm-1为C-H 伸缩振动峰,3 439 cm-1处的宽峰代表-OH 的伸缩振动峰,表明PDA 成功修饰到CuS 表面。进一步地,当形成CuS-PDAPAA 复合物后,可以观察到PAA 的特征吸收峰。由于修饰了PAA 后引入了羧基官能团,相关峰的归属为:1 550 cm-1是C-O 的伸缩振动峰,1 712 cm-1是羰基C=O 的伸缩振动峰,2 594 cm-1为C-H 伸缩振动,3 476 cm-1为羟基-OH 伸缩振动峰,表明PAA 键合在PDA 分子上。采用XPS 谱对所制备的CuS-PDAPAA 纳米载体进行元素表征,如图1C 所示,可以观察到很强的C1s 峰和O1s 峰,以及较弱的S2p 峰(结合能163 eV),而Cu2p(结合能933 eV)则基本融于背景信号,这是由于形成了典型的核—壳结构,而CuS 纳米粒被包裹其中(即为“核”),Cu 原子内层电子激发信号被严重削弱。通过TEM 观察CuS-PDAPAA 纳米载体呈球形,中间分布有黑色的CuS 纳米颗粒,平均粒径约200 nm(图1D)。

图1 载体表征图谱
2.2 不同浓度及超声时间对CuS粒径的影响
通过激光粒度仪检测不同浓度下CuS 的粒径,从图2A 中可以发现,当CuS 浓度为100 μg/mL 条件下时粒径仅为(144.70±10.97)nm,在该浓度下,CuS的粒径满足纳米制剂的要求,同时又能达到肿瘤治疗的光热效应。在最优浓度条件下,考察超声时间对CuS 粒径的影响,从图2B 中可以观察到,随着超声时间的增加,粒径呈现递减的趋势,当超声时间为15 min 时,粒径仅为(121.30±6.15)nm,分散系数为0.174±0.012,并且当时间超过15 min 后,粒径减小的程度有趋于平缓,故选择超声时间为15 min,该条件下粒径符合纳米载体制备要求,同时能为后续的载体修饰留有足够的空间。
2.3 DA 浓度及反应时间对CuS-PDA 的粒径的影响
为了优化CuS-PDA 载体的粒径大小,分别考察不同浓度DA 及聚合时间对于CuS-PDA 粒径的影响。从图2C 中可见,当DA 浓度逐渐增大时,CuSPDA 粒径呈现递增趋势。从图中可以发现,当DA浓度为20 μg/mL 时,CuS-PDA 粒径仅为(195.7±15.80)nm,在该浓度下制备的载体不仅具有纳米级结构,并且具备良好的光热效应。明确DA 最佳浓度后,考察聚合时间对于CuS-PDA 粒径的影响,从图2D 中可以观察到,随着聚合时间的增加,粒径逐渐增大,当聚合时间为4 h 时,载体粒径为(212.50±7.81)nm,分散系数为0.121±0.013,该粒径符合纳米载药体系的制备要求。
2.4 PAA 浓度及反应时间对CuS-PDA-PAA 的粒径的影响
确定CuS-PDA 最佳制备条件后,考察PAA 浓度及反应时间对于CuS-PDA-PAA 粒径的影响。结果见图2E,随着PAA 浓度的增加,载体粒径逐渐增大,当PAA 浓度为80 μg/mL 时,可以观察到纳米粒径逐渐趋于平稳,粒径为(271.60±8.15)nm。明确PAA 最佳浓度后,考察反应时间对于粒径的影响,结果如图2F,从图中可以观察到,随着反应时间的增加,粒径呈现递增趋势,为了确保所制备的纳米载体符合要求,并具有良好的治疗效果,本实验采用反应时间为6 h,此时的粒径为(253.90±4.76)nm,分散系数为0.128±0.009,该反应条件下可以制备出粒径合适的纳米载体。
2.5 粒径分布及Zeta电位分析
在上述最优制备条件下,通过激光粒度仪检测各载体的粒径及Zeta 电位。结果如图3 所示,随着各载体的逐级修饰,纳米载体粒径和电位发生了明显的变化,粒径逐渐增大,电位绝对值也逐渐增大,可以证明各载体之间成功连接。同时也可以观察到三种载体材料均带负电荷,电位绝对值随着功能分子的逐步修饰而逐渐变大(图3B),可以证明CuS-PDA-PAA的成功制备。
2.6 纳米载体稳定性考察
从图3B可以观察到,本实验制备的纳米载体具有强电负性,绝对值较高,可以推测出该载体具有良好的稳定性。如图4 所示,在4 ℃条件下,CuSPDA-PAA 在水中分散性良好,在5 d 内均未发现聚沉,在10 d 内仅出现部分沉淀;CuS-PDA-PAA 在PBS 中分散良好,在考察的21 d 中分散液未出现聚沉及变质现象;分散液于DMEM 培养基中保存时,在第10 天仅出现少量聚沉,于培养基中性质稳定。在25 ℃条件下,CuS-PDA-PAA 在水中分散性良好,在5 d 内均未发现聚沉,在10 d 内出现少量沉淀;CuS-PDA-PAA 在PBS 中分散良好,可以观察到在10 d 时出现沉淀,稳定性良好;当CuS-PDA-PAA 载体于DMEM 中保存,10 d 内出现部分沉淀,均呈现出良好的稳定性。综上结果分析说明该载体在PBS溶液中4 ℃条件下分散性良好,至少能稳定储存大于21 d。

图2 优化纳米材料的制备条件
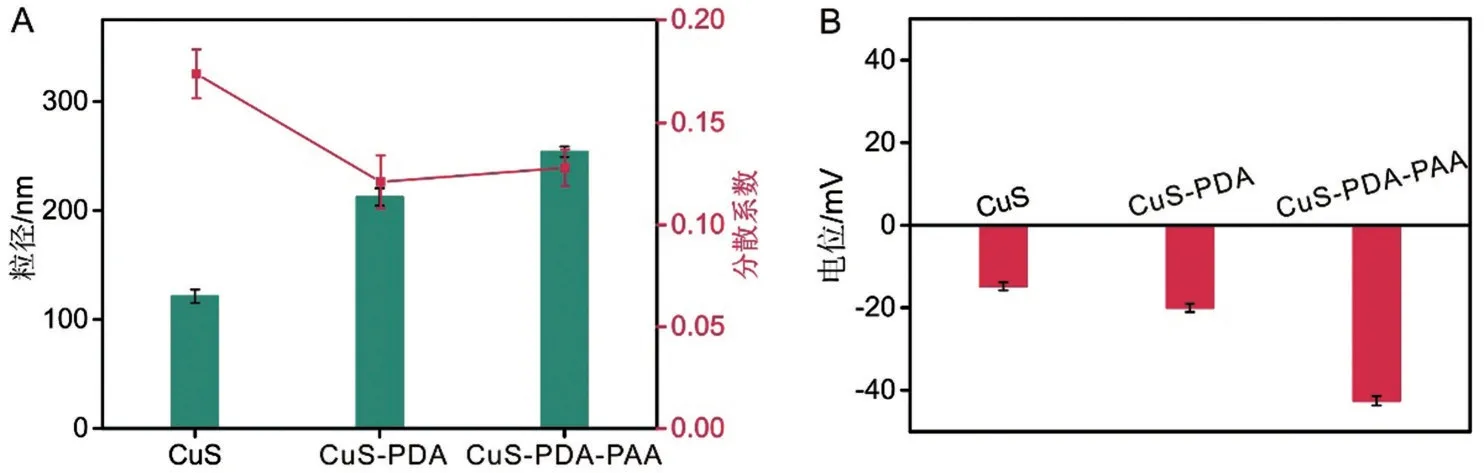
图3 载体的粒径和Zeta电位

图4 载体在不同介质中的稳定性考察
3 讨论
抗肿瘤纳米药物是近年来的研究热点,这是因为纳米药物制剂能够增加药物体内循环时间、可控释放以及靶向输运,使纳米药物被肿瘤细胞有效地摄取,从而提高治疗效果。目前常用的纳米载体材料包括金属及氧化物纳米颗粒(如金纳米粒、氧化铁等)、无机非金属纳米材料如二氧化硅、生物高分子材料如壳聚糖、明胶、PAA 等,以及生物大分子颗粒(如脂质体、蛋白质等),这些纳米材料可以通过功能化的修饰形成多模式的治疗策略(如光热、光动力学、化学动力学等),在多种治疗模式中,光热治疗是一种效果比较显著的方法。其中,光热治疗联合化疗可以在一定程度上减少化疗药物的用量从而降低药物的毒副作用;另一方面,可以抑制肿瘤细胞对化疗药物的耐药性,最终实现协同抗肿瘤作用。目前报道的光热纳米材料有MoS2、石墨烯、金属纳米粒、CuS等。
纳米载体的粒径是影响纳米药物性能的关键因素之一。粒径过大,难以被肿瘤细胞内吞;粒径太小,则容易被正常的防御细胞(如单核巨噬细胞)清除。其中,分散系数是衡量纳米载体粒径均匀度的重要指标,分散系数范围在0~1;数值越小,表明粒子尺寸分布宽度越窄。一般认为分散系数小于0.2时,该载体具有良好的分散度。
载体材料分散稳定性的另一个重要指标是Zeta电位,直接影响材料在体内的循环时间以及肿瘤细胞的摄取速率等。Zeta 电位为负值时,可以增加纳米载体在体内的循环时间,并且数值越大,纳米载体越稳定。考虑到本研究制备的纳米载体是多步组装和修饰获得的,因此对每一步中间载体材料进行考察和优化。
本实验制备了一种稳定的具有光热/pH 双响应的核—壳结构纳米载药体系(CuS-PDA-PAA)。采用UV-vis、FT-IR、XPS 和TEM 等手段进行表征,可以证明各载体被成功制备。本实验通过考察载体制备条件,得到最佳制备条件为:CuS 的浓度为100 μg/mL,超声时间为15 min;DA 的浓度为20 μg/mL,反应时间为4 h;PAA 的用量为80 μg/mL,反应时间为6 h,最终得到粒径为(253.90±4.76)nm,分散系数为0.128±0.009的载药体系。首先,该载体带有负电荷,可以通过静电吸附作用与带正电荷的抗肿瘤药物(如阿霉素)结合,从而达到装载药物的效应,并且其电位绝对值较大,可以装载大量的碱性抗肿瘤药物,从而提高治疗效果。其次,该载体中的CuS和PDA 均具有光热效应,两种光热材料的联合,可以增加光热治疗效应。最后,PAA 具有良好的pH响应性,在肿瘤微酸环境下,可以将抗肿瘤药物释放,而在正常的组织器官中几乎不释放,从而实现药物的控制释放和精准治疗,减少抗肿瘤药物的不良反应和毒副作用。从稳定性实验可以看出,该载体在4 ℃条件下,可以稳定保存至少21 d,稳定性能良好,为构建集光热效应和pH 响应于一体的抗肿瘤纳米载药复合体系药物提供一定的研究基础。
