苏尼特羊宰后成熟过程中肌原纤维蛋白特性与肉品质的变化分析
2021-03-02李文博罗玉龙郭月英赵丽华
李文博,罗玉龙,郭月英,刘 畅,窦 露,赵丽华,苏 琳,靳 烨
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
宰后成熟过程是肌肉向肉转化的必经过程,有利于改善肉品质,已有许多研究表明,成熟后的肉味道鲜美、柔嫩多汁,具有良好的食用品质[1]。而肌原纤维蛋白作为细胞骨架蛋白,在成熟过程中的作用不可忽略。动物屠宰后,以钙蛋白酶为主的细胞内源酶体系被激活,诱使肌原纤维蛋白发生降解,难以维持肌原纤维结构稳定,导致其Z盘崩塌,不可逆强结合横桥被破坏,进而改善了嫩度和保水性,同时影响肉其他品质[2]。Li Guixia等研究发现羊肉宰后嫩度的改善是肌原纤维蛋白水解导致的,某些蛋白降解条带的出现或消失都与剪切力和保水性密切相关[3]。Farouk等发现动物宰后肌原纤维蛋白的水解不仅会直接影响肉品质,还可以影响蛋白功能特性,例如提高溶解度、实现肉品质的改善[4]。Choe等也提出宰后肌原纤维蛋白功能特性的改变对改善肉品质和加工性能有很大作用[5]。基于此,为了深入探究宰后成熟过程中肉品质变化的原因并为改善肉品质提供理论参考,非常有必要对肌原纤维蛋白降解与功能特性改变对肉品质的影响进行深入且全面的研究。
苏尼特羊是内蒙古草原上的优良品种,研究表明苏尼特羊比小尾寒羊具有较好的色泽和嫩度[6]。在苏尼特羊股二头肌中,肌纤维密度与嫩度呈正相关性,IIB型肌纤维数量比例越大,极限pH值越低,推断其宰后成熟速率较快[7]。由此,本实验选取苏尼特羊股二头肌作为研究材料,对其进行成熟3 d的处理,旨在丰富与苏尼特羊宰后成熟相关的研究,并通过肉品质、肌原纤维功能特性和降解情况来确定其合适的成熟时间,为实际生产提供理论依据与技术支持。
1 材料与方法
1.1 材料与试剂
乌拉特中旗牧草饲喂的6 月龄苏尼特羊6 只(公母各半)。
氯化钾、氯化镁、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、磷酸氢二钾、溴酚蓝、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、碘化钾、叠氮化钠(均为分析纯) 国药集团化学试剂有限公司;Triton X-100、5×蛋白上样缓冲液、磷酸盐缓冲液干粉北京酷来博科技有限公司;双缩脲测定蛋白浓度试剂盒、BCA蛋白浓度试剂盒、SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)制胶试剂盒 北京索莱宝科技有限公司;蛋白质Marker(11~245 kDa) 北京天根生化科技有限公司。
1.2 仪器与设备
HH-4水浴锅 上海福玛实验设备有限公司;TC-P2A全自动色差计 上海生物化学实验仪器公司;C-LM3B肌肉嫩度仪 上海精密科学仪器有限公司;pH-STAR胴体pH计 德国Matthaus公司;5810-R低温台式离心机德国Eppendorf公司;TA.XTC-18质构仪 上海保圣科技有限公司;VICTOR X3酶标仪 美国PE公司;电泳仪、垂直电泳槽、凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 样品采集
动物屠宰后,立即放入风速3 m/s、相对湿度75%、温度4 ℃的冷却库中吊挂3 d,分别在宰后0、1、2、3 d取股二头肌50 g,用于测定肉品质,取20 g置于-20 ℃用于测定蛋白功能特性;取1 g置于-80 ℃冷藏,用于测定肌原纤维小片化指数(myofibril fragmentation index,MFI)和进行SDS-PAGE。
1.3.2 宰后成熟过程中肉品质的测定
1.3.2.1 pH值的测定
使用胴体pH计测定宰后肌肉pH值变化并记录,重复3~5 次。
1.3.2.2 剪切力的测定
取适量肉样置于75 ℃水浴锅中,蒸煮45 min,结束后待冷却至室温,沿肌纤维方向切成3 cm×1 cm×1 cm的肉条,用肌肉嫩度仪测定其剪切力,重复4~6 次,单位为N。
1.3.2.3 蒸煮损失率的测定
取20 g 肉样称质量,记为m1/g,在75 ℃水浴锅中密封煮至中心温度为70 ℃,并保持20 min后取出,待冷却至室温,擦干水分称质量,记为m2/g。按式(1)计算蒸煮损失率。
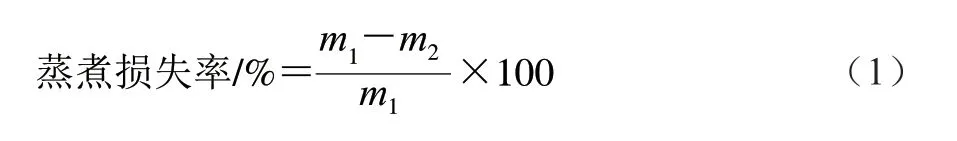
1.3.2.4 色泽的测定
全自动色差计以D65为光源,经标准白板校准后,测定宰后肌肉色差,L*值表示亮度;a*值表示红度;b*值表示黄度,重复3 次。
1.3.3 肌原纤维蛋白功能特性的测定
参考牛克兰[8]的方法测定肌原纤维蛋白功能特性,整个实验重复3 次。
1.3.3.1 肌原纤维蛋白的提取
选择-20 ℃保存的肉样,解冻后称取3 g,加入10 倍体积的缓冲液A(氯化钾0.1 mol/L、氯化镁0.002 mol/L、E G TA 0.0 0 2 m o l/L、磷酸氢二钾0.0 2 m o l/L,pH 6.8),冰浴匀浆后于2 000×g、4 ℃下离心15 min后取沉淀,然后先用8 倍体积的缓冲液B(氯化钾0.1 mol/L、氯化镁0.002 mol/L、EGTA 0.002 mol/L、磷酸氢二钾0.02 mol/L、Triton X-100体积分数10%,pH 6.8)洗2 次,再用0.1 mol/L氯化钾溶液洗两次,得到的沉淀即为肌原纤维蛋白,并用双缩脲法测定蛋白质量浓度。
1.3.3.2 水合特性的测定
溶解度:将上述肌原纤维蛋白质量浓度用磷酸盐缓冲液C(氯化钠0.6 mol/L、磷酸氢二钠0.05 mol/L,pH 6.25)调至5 mg/mL,取适量置于离心管中,在5 500 r/min、4 ℃条件下离心15 min,随后测定上清液蛋白质量浓度,溶解度按公式(2)计算。

疏水性:用磷酸盐缓冲液C将肌原纤维蛋白质量浓度调至1 mg/mL,取2 mL于离心管中,空白为磷酸盐缓冲液C,加入80 μL溴酚蓝溶液(1 mg/mL),漩涡振荡10 min后于4 000×g、4 ℃条件下离心15 min,取上清液稀释10 倍,于595 nm波长处测定光密度值,疏水性以溴酚蓝结合量表示,按公式(3)计算。
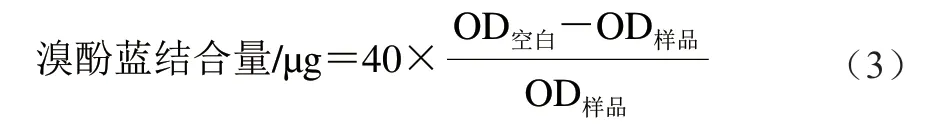
1.3.3.3 凝胶特性的测定
凝胶的制备:用缓冲液C将肌原纤维蛋白质量浓度调至40 mg/mL,分散均匀并置于10 mL离心管中,放入25 ℃水浴锅中,以1 ℃/min的速率升温至70 ℃,保持20 min后,取出迅速冷却至室温,置于4 ℃冰箱12 h,待用。
凝胶保水性测定:取出制好的凝胶于室温下稳定30 min,称质量并记为m1/g,随后在5 000 r/min、4 ℃条件下离心15 min,称取凝胶质量并记为m2/g,凝胶保水性按公式(4)计算。
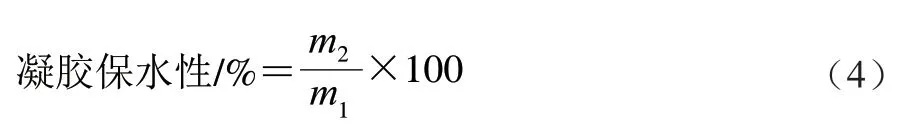
凝胶硬度测定:取出凝胶样品,室温下稳定30 min,用质构仪测定凝胶硬度,单位为g,测定条件:探头类型P5、测前速率1 mm/s、测中速率0.5 mm/s、测后速率0.5 mm/s。
1.3.3.4 乳化特性的测定
用磷酸盐缓冲液C将上述肌原纤维蛋白质量浓度调至1 mg/mL,分散均匀后取20 mL蛋白溶液和5 mL大豆油混合,于10 000 r/min下匀浆1 min,结束后立即从距管底1 cm处取50 μL乳浊液,加到5 mL SDS溶液(0.1 g/100 mL)中,振荡均匀,静置10 min,于500 nm波长处测定吸光度,记为A1。将上述乳浊液静置10 min后从相同位置取50 μL,加入到5 mL SDS溶液中,并按按上述操作测定吸光度,记为A2,空白为上述SDS溶液。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按公式(5)、(6)计算。
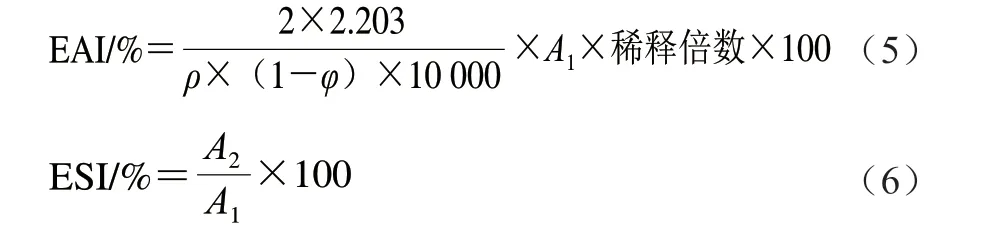
式中:ρ为蛋白质量浓度/(g/mL);φ为油相体积分数/%。
1.3.4 肌原纤维蛋白降解相关指标的测定
1.3.4.1 MFI的测定
参考Ilian等[9]的方法,取0.5 g肉样,加入10 倍体积的缓冲液(氯化钾0.1 mol/L、磷酸氢二钠0.02 mol/L、EDTA 0.001 mol/L、氯化镁0.001 mol/L,pH 7.1),低速冰浴匀浆1 min后,于3 000×g、4 ℃下离心15 min,取沉淀重复上述操作1 次后,将最终沉淀用缓冲液重悬,采用双缩脲法测定蛋白质量浓度,并调至0.5 mg/mL,然后在540 nm波长处测蛋白质OD值,MFI按公式(7)计算。

1.3.4.2 SDS-PAGE分析
肌原纤维蛋白提取方法参考C a l v o 等[10]的方法,取0.5 g 肉样,加入1 0 倍体积分离缓冲液A(磷酸盐0.0 3 m o l/L),冰浴匀浆后离心2 0 m i n(1 2 0 0 0 r/m i n、4 ℃),取沉淀加入1 0 倍体积缓冲液A,漩涡振荡均匀,于10 000 r/min、4 ℃下离心2 0 m i n,重复此过程3 次后取沉淀,加入4 倍体积分离缓冲液B(磷酸氢二钠0.1 m o l/L、叠氮化钠0.000 6 mol/L、碘化钾0.14 mol/L),冰浴匀浆30 s后离心20 min(12 000 r/min、4 ℃)取上清液,用BCA法测蛋白质量浓度并调至1 mg/mL。随后以体积比4∶1与蛋白上样缓冲液混合,并在99 ℃水浴锅中煮沸变性10 min,制得变性蛋白样品。SDS-PAGE条件为:分离胶质量分数为12%,浓缩胶质量分数为4%,蛋白上样量为14 μg,先以80 V电压电泳直到指示条带迁移至浓缩胶与分离胶界限处,然后以135 V电压电泳直到指示条带迁移至距底端1 cm处结束,最后用考马斯亮蓝法染色。
1.4 数据统计与分析
采用Excel软件对原始数据进行处理计算,结果以平均值±标准差表示;采用SPSS软件中的单因素方差分析法进行显著性分析。
2 结果与分析
2.1 苏尼特羊宰后成熟过程中肉品质的变化
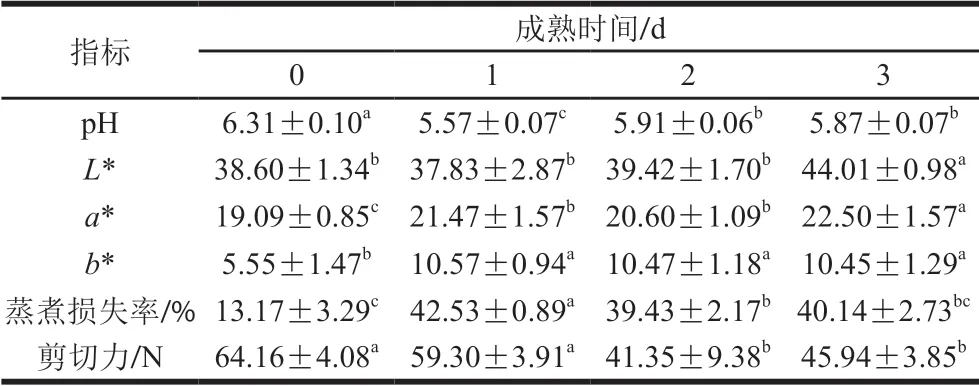
表1 苏尼特羊宰后成熟过程中肉品质的变化(n=6)Table 1 Changes in meat quality during post-mortem aging of Sunite sheep carcasses (n= 6)
苏尼特羊宰后成熟过程中肉品质变化如表1所示。肌肉的pH值是预测肉品质的重要指标,对嫩度、保水性等品质都有较大影响。动物屠宰后,氧气供应停止,细胞能量代谢方式变为糖酵解,分解机体内的糖原产生乳酸,导致pH值下降;当pH值的变化趋于稳定时,说明机体的糖酵解已经彻底完成[11]。从表1可以看出,苏尼特羊肉pH值在成熟1 d时达到最低,成熟2 d时有所回升,随后趋于稳定,这与陈槟颖的研究结果[12]一致。肉色是影响消费者购买欲的主要因素之一,成熟3 d的苏尼特羊肉亮度(L*值)显著高于未成熟时的(P<0.05),分析原因可能是宰后pH值降低至蛋白质等电点,减弱了对水分子的吸引能力,导致水分流失,产生更多的游离水并附着于肌肉表面,增强了光的反射,进而使亮度升高[13]。红度(a*值)在成熟过程中持续升高,可能是因为肌肉在成熟过程中,与空气中的氧气充分结合,生成了较多氧合肌红蛋白(红色)[14]。Joseph等还发现红度与糖酵解相关蛋白含量呈正相关性,这说明宰后红度升高与糖酵解程度有很大关系[15]。黄度(b*值)在成熟1 d时显著升高(P<0.05),随后趋于稳定,该趋势与Alvarenga等的研究结果[16]一致。另外,b*值上升的原因可能是肌肉与氧气的充分接触导致氧合肌红蛋白逐渐生成高铁肌红蛋白(褐色)[17]。蒸煮损失率是反映保水性的指标,由表1可知,苏尼特羊蒸煮损失率在成熟1 d显著上升(P<0.05),但在成熟2 d时又显著下降(P<0.05),然后趋于稳定。蒸煮损失率在宰后初期上升的原因可能是肌动球蛋白的形成导致肌节变短,肌纤维空隙增大,促使更多的水分流失[18];也可能是肌肉因糖酵解而使pH值降低,导致一些储存水分的肌原纤维蛋白(肌球蛋白头部)发生变性,进而产生交联,破坏了维持水分空间的稳定结构,从而影响肌肉的持水性[19]。而随后蒸煮损失率的下降则可能是因为肌原纤维蛋白发生降解,肌肉结构崩塌,水分子流失通道遭到破坏,形成了“海绵效应”,阻断了水分流失[20]。肉品嫩度通常用剪切力表示,这二者呈负相关关系[21]。许多研究表明,宰后成熟有助于肌肉嫩化,主要是宰后许多酶促系统(钙蛋白酶体系、组织蛋白酶体系和细胞凋亡酶体系)发挥作用,其促使细胞骨架蛋白发生降解,难以维持肌纤维结构稳定,进而改善肉的嫩度[22]。在本实验中,苏尼特羊剪切力持续下降,在成熟2 d达到最低,随后趋于稳定,这与王柏辉等关于3 岁绒山羊在成熟3 d时剪切力达到最低值的研究结果[23]不一致,原因可能是羊肉品种和年龄不同。
经过宰后成熟3 d的处理及肉品质指标的测定,发现苏尼特羊的pH值、蒸煮损失率和剪切力在2 d时达到最优值,并与成熟3 d时无显著性差异(P>0.05),这说明6 月龄苏尼特羊肉在宰后成熟2 d时已达到成熟期品质。
2.2 苏尼特羊宰后肌原纤维蛋白功能特性的变化
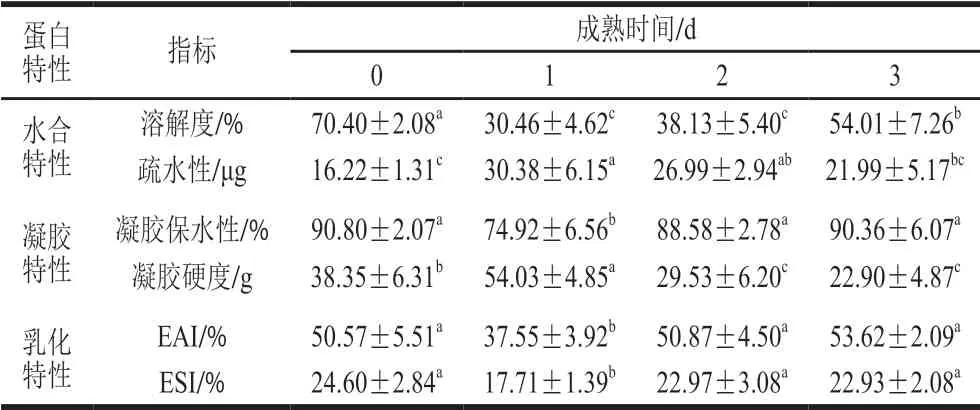
表2 苏尼特羊宰后成熟过程中肌原纤维蛋白功能特性的变化(n=6)Table 2 Changes in myofibrillar protein functional properties during post-mortem aging of Sunit sheep carcasses (n= 6)
肌原纤维蛋白的水合特性包括溶解度和疏水性,由蛋白的疏水基团和亲水基团决定,疏水基团的相对含量决定蛋白疏水性,亲水基团决定蛋白的溶解度。Huff-Lonergan研究发现蛋白的变性氧化会导致疏水基团暴露,降低蛋白的溶解度,使肌肉保水性变差[24]。溶解度作为决定其他功能特性优异与否的主要因素,对肉品质也有很大影响,一般来说溶解度高的肉类,其保水性较高、嫩度较好、加工性能优异[5,25]。由表2可见,苏尼特羊宰后成熟过程中溶解度呈现先下降后上升的趋势,在成熟1 d时达到最低(P<0.05)。分析原因是肌肉进入僵直状态,肌球蛋白与肌球蛋白结合形成肌动球蛋白,蛋白质的天然构象发生改变,暴露了较多疏水基团,进而导致溶解度下降[26]。蛋白疏水性通常利用其螯合溴酚蓝的能力表示,在本实验中,肌原纤维蛋白的疏水性呈先升高后降低的趋势,在成熟1 d时达到最高,在成熟2 d后趋于稳定,这与王晓君等的研究结果[27]相同。
蛋白质凝胶是指在加热变性过程中,蛋白质分子或基团聚集形成的三维网状立体结构[6]。一般采用凝胶保水性、质构特性和白度等指标来反映蛋白凝胶品质[28]。有研究表明,蛋白溶解度与凝胶保水性呈正相关性[29]。肌原纤维蛋白凝胶主要由肌球蛋白形成,对肉类产品的保水性、质地和加工特性都有很大影响[30]。本实验中,肌原纤维蛋白凝胶保水性呈先降低后升高的趋势,在成熟1 d时达到最低值(P<0.05),成熟2 d后有所回升并趋于稳定。凝胶硬度呈先升高后降低的趋势,在成熟1 d时达到最高值(P<0.05),在成熟2 d时降低,然后趋于稳定。产生这种趋势的原因可能是成熟1 d时蛋白质溶解度下降、疏水性升高,导致凝胶保水性下降、硬度提高;而在成熟2 d时,蛋白溶解度回升、疏水性下降、水合能力提高,进而改善了凝胶保水性和硬度[31]。
乳化性由蛋白的分子结构决定,它反映了蛋白质与蛋白质以及蛋白质与脂肪的交联能力,对肉类产品的质地和保水性有较大影响。乳化能力一般通过EAI和ESI来表示,由表2可知,苏尼特羊肉乳化活性和乳化稳定性均呈现先下降后上升的趋势,并在成熟1 d时达到最低值(P<0.05)。分析原因是乳化性由蛋白的水合能力决定,即溶解度与乳化能力呈正相关,疏水性与乳化能力呈负相关,它们共同影响了蛋白的乳化稳定性和脂肪结合能力[32]。在苏尼特羊成熟前期,溶解度的降低和疏水性的升高致使乳化能力下降,到了成熟后期,蛋白溶解度升高,可溶性蛋白含量的增加可能有助于形成稳定的交联键,从而捕获更多的脂肪和水分,提高乳化能力[33]。
综上所述,肌原纤维蛋白各项功能特性基本在成熟1 d时达到最低,确定该时间处于苏尼特羊僵直期;在成熟2 d时各项指标基本回升并与成熟3 d总体无显著性差异(P>0.05),通过肌原纤维蛋白功能特性可以基本确定苏尼特羊成熟2 d时已进入成熟期,具备可食用肉的良好品质。
2.3 苏尼特羊宰后肌原纤维蛋白的降解
2.3.1 宰后MFI的变化
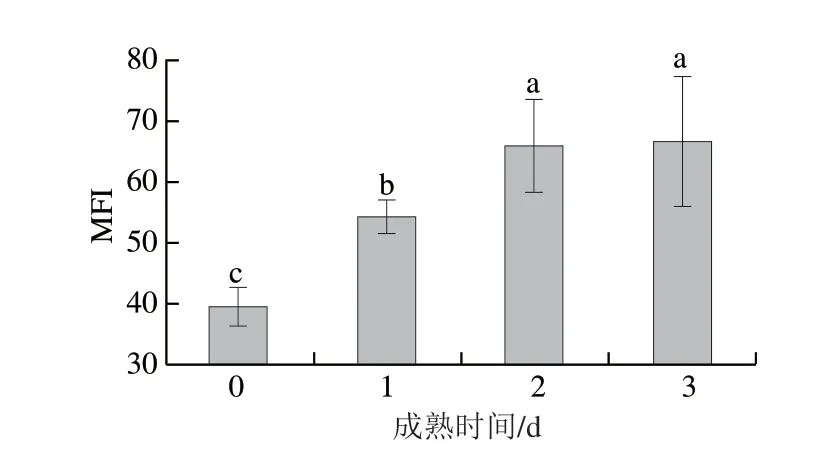
图1 苏尼特羊宰后成熟过程中MFI的变化(n =6)Fig.1 Changes in MFI during post-mortem aging of Sunit sheep carcasses (n = 6)
宰后成熟过程中,肌原纤维蛋白的降解致使蛋白小分子化,影响蛋白功能特性并且改变肉品质[34]。Koohmaraie等报道称,在宰后成熟过程中以钙蛋白酶为主的蛋白水解酶会导致肌肉组织发生变化,例如Z线的崩塌、肌钙蛋白T的消失、结蛋白和肌动蛋白的降解,进而导致肌原纤维的片段化[35]。Li Jiaolong等发现当μ-钙蛋白酶mRNA水平升高时,肌肉滴水损失率和剪切力会降低,因此可以推断肌原纤维蛋白降解程度升高,可以改善保水性和嫩度[36]。目前公认的检测肌原纤维蛋白降解的方法有MFI和碎裂指数法,而MFI法是目前应用最广泛的[21]。Li Zheng等发现绵羊在宰后的前2 d MFI显著升高,但在此后的第3、5、7天没有明显变化,说明随着肌肉成熟的进行,肌原纤维片段化程度越来越低[37]。在本实验中,MFI在宰后成熟过程中处于持续上升趋势,但成熟2 d和成熟3 d无显著性差异(P>0.05)(图1),说明肌原纤维蛋白处于持续小分子化的过程,肌原纤维结构逐渐被破坏,直到成熟2 d羊肉基本成熟才得以缓解。
2.3.2 肌原纤维蛋白的SDS-PAGE分析结果
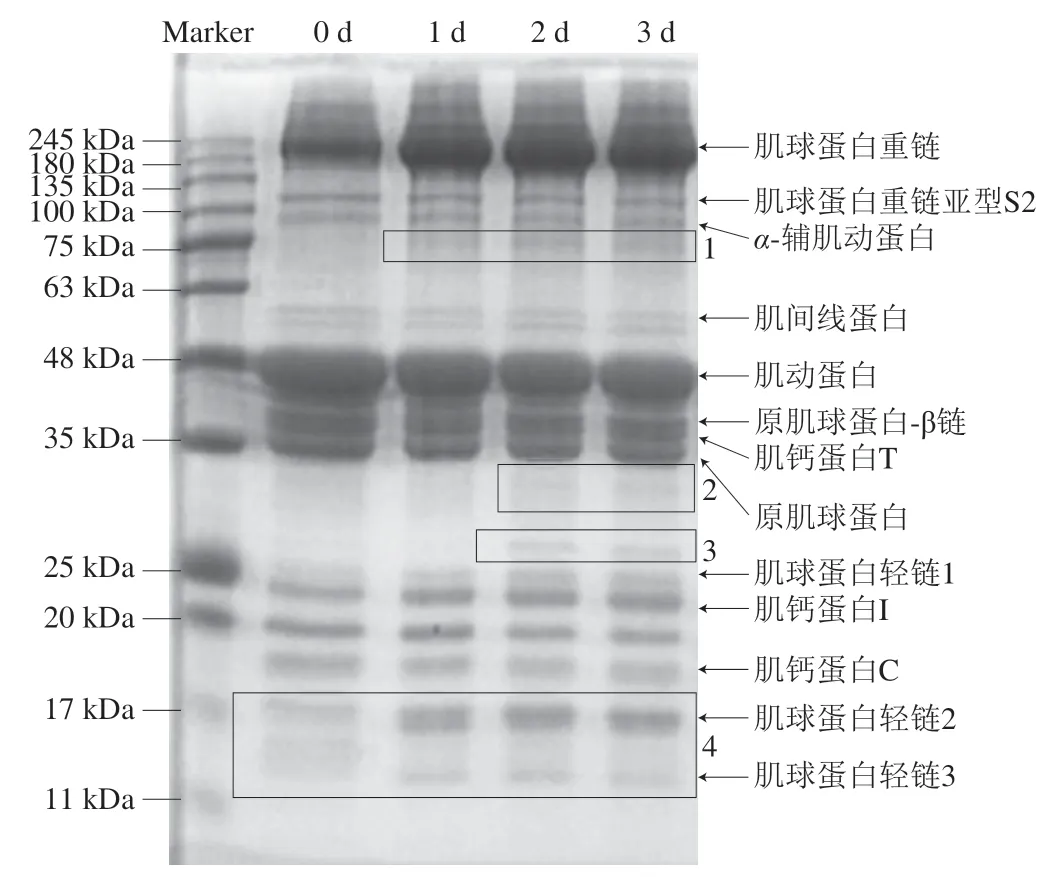
图2 宰后成熟过程中苏尼特羊肉中肌原纤维蛋白的降解Fig.2 Degradation of myofibrillar protein in Sunit lamb meat during post-mortem aging
SDS-PAGE结果显示了苏尼特羊宰后0~3 d的肌原纤维蛋白降解情况,由图2可知,肌原纤维蛋白主要包括肌球蛋白重链(250 kDa)、肌球蛋白重链亚型S2(130 kDa)、α-辅肌动蛋白(95 kDa)、肌间线蛋白(50 kDa)、肌动蛋白(43 kDa)、原肌球蛋白-β链(39 kDa)、肌钙蛋白T(37 kDa)、原肌球蛋白(35 kDa)、肌球蛋白轻链1(23 kDa)、肌钙蛋白I(21 kDa)、肌钙蛋白C(18 kDa)、肌球蛋白轻链2(16 kDa)和肌球蛋白轻链3(11 kDa)[10,38-40]。宰后成熟过程中,细胞内源酶系统会降解肌原纤维蛋白,促使蛋白小分子化,进而产生新的多肽片段或使原有片段消失[1]。从图2中可以看出,有4 个区域的蛋白图谱发生变化。区域1可能是未自溶的μ-钙蛋白酶(80 kDa)及其自溶产物(76、78 kDa),已有许多研究表明μ-钙蛋白酶在宰后肌原纤维蛋白降解过程中起着至关重要的作用;针对其自溶产物,也有研究表明其与pH值和L*值呈负相关[41]。存在于原肌球蛋白和肌钙蛋白I之间的2和3区域的条带可能是原肌球蛋白断裂形成的新多肽,也可能是肌钙蛋白T的降解产物30 kDa多肽,该多肽片段可作为蛋白水解指数来指示宰后成熟进度[10]。区域2和3的条带均在羊肉成熟2 d时出现,这也可以说明在成熟2 d时羊肉达到成熟期品质。区域4在羊肉成熟1 d时出现条带加深以及新条带产生的情况,分析原因可能是肌球蛋白分解导致的。研究表明肌球蛋白轻链不稳定,在宰后成熟过程中容易被降解[40]。综上所述,肌原纤维蛋白的降解大多发生在成熟1 d时,在成熟2 d后基本没有变化,说明苏尼特羊肉在成熟2 d时蛋白降解已基本完成,与MFI呈现一致的规律,可以基本确定羊肉经过2 d成熟已经基本完成从肌肉到可食肉的转变。
2.4 MFI、蛋白功能特性和肉品质间的相关性分析结果
肌原纤维蛋白降解是宰后成熟过程中重要的生理阶段,对蛋白功能特性和肉品质均有较大影响。由表3可知,pH值与溶解度、EAI、ESI和凝胶保水性均呈显著正相关(P<0.05),这解释了本实验宰后成熟过程中,pH值先下降到极限值,再回升最后趋于稳定;溶解度、EAI、ESI和凝胶保水性也呈现相同的趋势。动物屠宰后,细胞供能方式变为糖酵解,分解糖原产生乳酸,pH值开始下降直至达到最小值,表明胴体进入最大僵直期,这时蛋白特性和各项品质均较差;但随着成熟的进行,pH值开始缓慢上升、肌原纤维蛋白逐渐降解、功能特性得以好转、肉品质也得到改善[2]。由此可见,pH值不仅可以作为指示宰后成熟进程的指标,其高低还会影响蛋白特性与肉品质。Starkey等的研究也表明pH值是宰后成熟过程最重要的预测因子,也是影响其他肉品质的重要因素[42]。蒸煮损失率与蛋白溶解度同ESI呈显著负相关(P<0.05),蒸煮损失率与疏水性和MFI呈显著正相关(P<0.05)。这说明宰后成熟过程中,由于蛋白的降解,导致MFI升高、肌原纤维蛋白小分子化,进而提高了蛋白溶解度,降低了疏水性,提高了ESI,使蛋白分子锁住更多的水分并具有较好的稳定性,最终提高了肉的保水性,这与Li Xia等的研究结果[43]一致。剪切力与MFI呈显著负相关(P<0.05),Lokman等也报道了相同的结果,他们称宰后成熟过程中由于蛋白发生水解,导致肌原纤维碎片化,进而改善了嫩度[44]。色泽品质中,b*值同溶解度和ESI呈显著负相关(P<0.05);b*值同疏水性和MFI呈显著正相关(P<0.05),这进一步说明宰后肌原纤维蛋白的降解与功能特性对色泽有较大影响。产生这种关系的可能原因是蛋白水解,导致其溶解度、ESI升高,疏水性下降,使得肌肉组织中的蛋白、脂肪和水分结合较稳定,保水性较好,没有过多汁液流失,进而没有溶解空气中过多的氧气,无法生成较多的高铁肌红蛋白,使得b*值可以维持较低值,羊肉色泽呈现较好状态。而b*值与MFI的显著正相关关系可能是由于肌原纤维蛋白降解,导致肌原纤维小片化,无法维持稳定结构,使肌肉无法锁住水分,溶解空气中较多的氧气,促使产生更多的高铁肌红蛋白。总而言之,宰后肌原纤维蛋白的降解会促使功能特性发生变化,影响肉品质,也会因其难以维持肌肉稳定结构而直接影响各项肉品质指标,是决定宰后肉品质的重要因素。
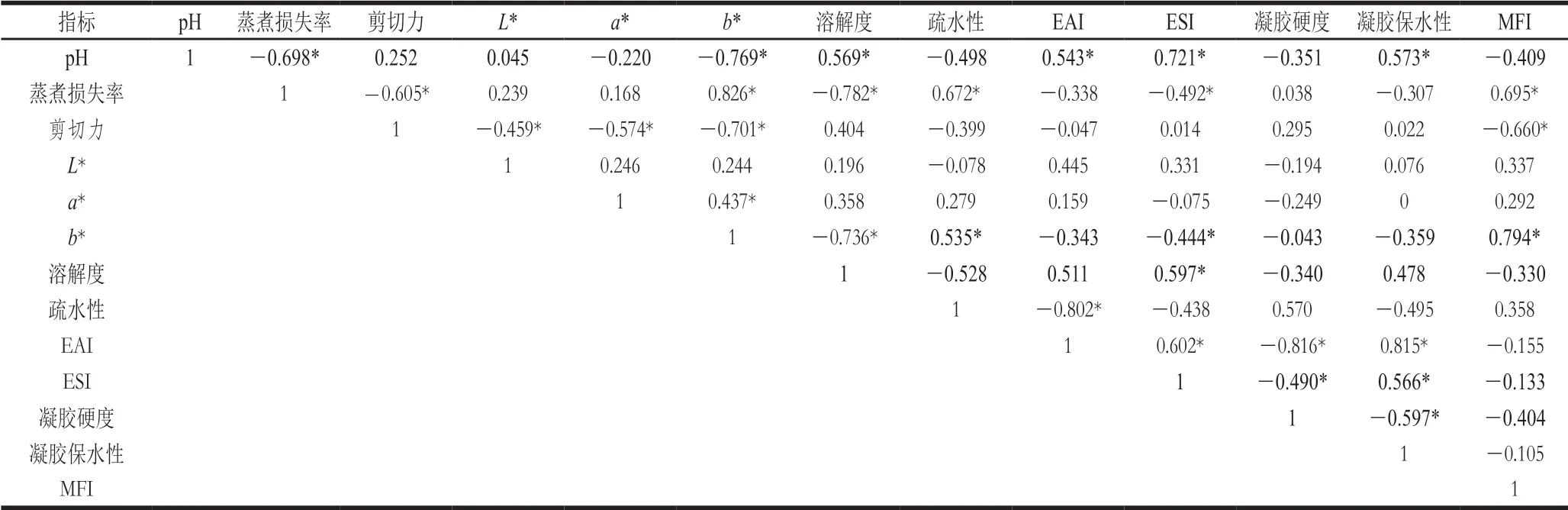
表3 MFI、肌原纤维蛋白功能特性和肉品质间的相关性分析Table 3 Correlation analysis among MFI, myofibrillar protein functional properties and meat quality
3 结 论
通过测定苏尼特羊宰后成熟0~3 d时的4 项肉品质指标(pH值、蒸煮损失、剪切力和色泽),发现在成熟1 d时pH值达到极限值,各项品质指标也较差,在成熟2 d时肉品质均得以好转,基本达到最佳状态并与成熟3 d时无明显差异,由此可以确定苏尼特羊在成熟2 d时已达到可食用肉的品质。
由宰后成熟过程中肌原纤维蛋白功能特性(水合特性、凝胶特性和乳化特性)的各项指标(溶解度、疏水性、凝胶保水性、凝胶硬度、EAI和ESI)测定结果可以发现,在成熟1 d时3 种功能特性均较差,在成熟2 d时各指标水平开始回升并趋于稳定,基于此,可以基本确定苏尼特羊在成熟2 d时已具备成熟期的优良品质。
MFI在成熟2 d时趋于稳定,SDS-PAGE图也反映出在成熟2 d后蛋白条带无明显变化,说明肌原纤维蛋白在成熟2 d时已完全降解,肌肉进入成熟阶段。
通过MFI、肌原纤维蛋白功能特性相关指标和肉品质的相关性分析结果可以发现:MFI、溶解度、疏水性、EAI、ESI和凝胶保水性与各项肉品质指标间都有一定的显著相关关系,说明宰后肌原纤维蛋白降解与功能特性对肉品质的影响较大,甚至决定了成熟后肉品质。
