HSP70调控Bcl-2抑制急性脓毒症患者内皮细胞损伤研究
2021-03-01郭东风刘国荣陈雅静袁晓燕罗娅娟
陈 果,郭东风,许 磊,刘国荣,陈雅静,袁晓燕,杭 敏,王 佩,罗娅娟
(上海市浦东新区公利医院急诊科,上海 200135)
急性脓毒症是目前临床中较为常见的危重性疾病,随着患者病情进展可能导致患者出现多脏器功能不全综合征、急性呼吸窘迫综合征等[1]。有研究指出,毛细血管渗漏是典型的脓毒症病理学特征,其主要表现为微血管内皮细胞受炎症因子影响致细胞凋亡引起出现内皮屏障功能受损,导致血管通透性增高[2,3]。B-细胞淋巴瘤/白血病-2原癌基因(Bcl-2)是人体内重要的抗凋亡蛋白家族成员,可有效抑制细胞的凋亡[4]。热休克蛋白70(HSP70)是体内重要的分子伴侣,可通过多种途径和多种凋亡诱导因子,进而起到抑制凋亡的作用[5]。但HSP70对急性脓毒症患者内皮细胞的影响仍鲜有报道,本文选择急性脓毒症患者内皮细胞作为研究对象,分析HSP70调控急性脓毒症患者内皮细胞损伤的机制。
1 资料与方法
1.1 一般资料
经本院伦理委员会批准,选取2017年2月~2018年12月本院收治的3例急性脓毒症患者作为观察组,其中男性2例,女性1例,年龄分别为43、31、52岁,同期选择3例行手术治疗的骨折患者作为对照组,其中男性2例,女性1例,年龄分别为54、29、44岁,对照组患者除骨折外无其他疾病,分组合理。
1.2 入组标准
(1)心率大于90次/min、PaCO2<32 mmHg或呼吸频率>20次/min;(2)末梢血白细胞<4 000 mm3或>12 000/mm3;(3)体温低于36℃或高于38℃;(4)幼稚细胞>10%。
1.3 排除标准
(1)伴随慢性阻塞性肺部疾病、冠心病、肿瘤、高血压、糖尿病、风湿免疫疾病、血液系统疾病、肝肾功能不全或肝硬化等疾病;(2)大于75岁成年人或未成年人;(3)无法全程参与该试验;(4)酗酒或抽烟史;(5)主动申请退出本研究。
1.4 方法
本组研究中所有受试者入组后采集手术区域或介入治疗创面周围皮肤。将标本剪成小块,放入含抗菌素的DMEM培养基中,并将培养基浸泡组织置入5℃冰箱中保存。经组织自培养基中取出后使用105的乳酸环丙沙星和105青霉素溶液清洗3次,并剪成1 mm3大小组织块后置于培养皿(DMEM培养基润洗)中,后加入完全培养基并置入二氧化碳培养箱中2 h,60 h后将组织块去除,待细胞汇合呈单层细胞后冻存并用于后续实验。每24 h更换一次完全培养基,后滴入2~3滴胰酶,10 s后将培养基去除加入新完全培养基。倒置显微镜观察待细胞达全部的80%左右使用胰酶消化60 s左右,后加入等体积胎牛血清终止消化,收集细胞置入10 mL离心管中加入培养基至10 mL,使用离心机1 000 r/min离心10 min,去除上清后加入2 mL完全培养基吹打均匀,后依照细胞悬液和完全培养基1∶2的比例进行传代。
1.5 分组及处理
使用完全DMED培养基对提取的内皮细胞进行培养,并在细胞生长至对数生长期后将各细胞分为空白对照组及10、50、100 mg/L组,依照分组采用不同剂量的HSP70蛋白进行干预。后采用噻唑蓝法(MTT)检测各组细胞活力,使用Hoechst 33258染料对细胞核进行染色并采用荧光显微镜观察细胞核形态,通过透射电镜观察内皮细胞自噬体。采用Western blot法检测各组细胞中Bcl-2、Beclin-1及β-actin蛋白表达量。
1.6 统计学处理
2 结果
2.1 细胞活力检测结果
HSP70的干预可有效改善急性脓毒症患者内皮细胞活力,其中观察组和对照组中100 mg/L亚组细胞活力最高,空白对照亚组细胞活力最低,差异具有统计学意义(P<0.05),见表1。

表1 细胞活力检测结果
2.2 荧光染色调查结果
与对照组比较,急性脓毒症患者内皮细胞细胞核缺损严重,采用HSP70的干预可有效改善细胞核形态,其中100 mg/L亚组的细胞核形态最佳,见图1。

A、B、C、D为观察组患者(空白对照组、10 mg/L组、50 mg/L组、100 mg/L组);E、F、G、H为对照组患者(空白对照组、10 mg/L组、50 mg/L组、100 mg/L组)图1 荧光染色图Fig 1 Result of fluorescentstaining
2.3 观察组患者内皮细胞自噬体检测结果
本组研究结果显示,采用HSP70对急性脓毒症患者内皮细胞干预后干显著改善患者自噬体形态和结构,其中100 mg/L亚组的自噬体形态和结构形态最佳,见图2。

A、B、C、D为观察组患者(空白对照组、10 mg/L组、50 mg/L组、100 mg/L组)图2 内皮细胞自噬体检测结果Fig 2 Autophagosome of endothelial cells
2.4 各组患者内皮细胞蛋白水平检测结果
HSP70的干预可有效改善急性脓毒症患者内皮细胞内Bcl-2及Beclin-1水平,其中观察组和对照组中的100 mg/L亚组中Bcl-2及Beclin-1水平最高,空白对照亚组中最低,差异具有统计学意义(P<0.05),见表2。
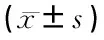
表2 各组内皮细胞蛋白水平检测结果
3 讨论
脓毒症是目前临床中较为常见的由感染所导致的全身炎症性反应综合征,其在临床中多被证实为细菌或高度感染灶[6]。虽然脓毒症的发生及发展与感染密切相关,但其在病发脓毒症后可能导致疾病遵循自身病理规律和过程进行发展,对患者的生命安全造成严重不良影响[7,8]。急性脓毒症发生及发病机制尚未完全揭示,其可能涉及到复杂的全身炎症性网络效应、免疫功能障碍、基因多态性、组织损伤、凝血功能异常及宿主对毒素、病原微生物反应等多因素密切相关[9]。
HSP70是重要的热休克蛋白家族成员,其可有效抑制凋亡的发生及发展,并在多种细胞应激反应发生发展过程中起到十分重要的保护作用[10]。有研究结果显示,IGF-1等多种细胞因子可有效调控牦牛卵丘细胞中HSP70的表达,且可有效调控细胞凋亡[11]。研究发现,热应激可有效诱导胚胎细胞中HSP 70的表达,且HSP70变化可促进胚胎适应环境改变,使细胞可有效保持和维护最佳的质量[12,13]。研究发现,IGF-1可有效调控HSP70蛋白表达水平,并可有效减少热应激对细胞的损伤和凋亡的应用,可更为有利地促进细胞生长发育[14-16]。
本研究采用HSP70对急性脓毒症患者内皮细胞的影响进行分析,结果显示HSP70蛋白干预后可有效提高急性脓毒症患者内皮细胞活力,有效改善细胞核形态及自噬体。进一步深入分析发现,采用HSP70干预后可调控内皮细胞内Bcl-2及Beclin-1蛋白水平,分析认为HSP70蛋白可有效改善急性脓毒症患者内皮细胞内抗凋亡蛋白表达,有效激活抗凋亡相关信号通路[17,18]。Bcl-2是人体内重要的凋亡抑制基因,其中Bcl-2高表达可有效阻滞多用因素引起的细胞凋亡,应激、生长因子缺失等[19]。Beclin-1蛋白是人体内重要的自噬启动基因,其可与PI3K蛋白形成复合物[20],有效调节体内ATG蛋白自噬前体的定位,促进自噬体形成,采用HSP70干预后可有效改善细胞内Bcl-2及Beclin-1蛋白水平表达,进而可有效抑制内皮细胞的凋亡。
综上所述,HSP70可有效调控急性脓毒症患者内皮细胞中Bcl-2水平,有效抑制细胞凋亡并缓解细胞皮肤损伤。
