HPV E6/E7 mRNA检测用于绝经后未明确诊断意义的不典型鳞状上皮细胞分流筛查的价值
2021-03-01王希波王丽
王希波,王丽
潍坊市人民医院,山东潍坊261041
子宫颈癌发病率和病死率均居于全球女性恶性肿瘤的第4位[1],高危人乳头状瘤病毒(HR-HPV)的持续感染是子宫颈癌及癌前病变的关键因素[2]。研究发现,HPV感染有两个年龄高峰:15~24岁、大于54岁[3]。目前我国已经进入老龄化社会,出现了第二个HPV感染高峰[4],且绝经后子宫颈癌具有发现晚、临床分期晚、疾病预后差、病死率高等特点。因此,绝经后女性的子宫颈癌筛查不容忽视,早发现、早干预对防治子宫颈癌有重要价值。目前,液基细胞检查(TCT)是诊断子宫颈病变的有效方法。但由于绝经后雌激素降低引起子宫颈上皮细胞萎缩、生理性形态改变等特点,面对许多性质不明的细胞学异常结果如未明确诊断意义的不典型鳞状上皮细胞(ASCUS),是随诊还是观察,需要进一步的检查来辅助判断。HR-HPV DNA临床常被用于早期子宫颈癌筛查,但不能分辨病毒是一过性感染还是持续性感染,其预测子宫颈病变存在局限。HPV E6/E7 mRNA代表致癌基因的活动状态,可用于评估子宫颈病变的发病风险和预后评价[5-6]。本研究旨在评价HPV E6/E7 mRNA在绝经后ASCUS分流中的诊断效能,从而为这一特殊群体子宫颈病变的早期诊治提供依据。
1 资料与方法
1.1 临床资料 经潍坊市人民医院医学伦理委员会批准,选取2016年1月—2018年12月就诊于潍坊市人民医院妇科且TCT结果为ASCUS的绝经后患者196例,年龄49~67(54.7± 7.2)岁,绝经年限1~19(8.3±7.7)年,均签署知情同意书。排除既往有子宫颈上皮内瘤变(CIN)或宫颈癌病史、子宫颈手术史者,有自身免疫疾病或正在接受免疫抑制治疗者,3 d内有阴道用药或阴道冲洗者。
1.2 HR-HPV DNA、HPV E6/E7 mRNA检测方法取样:用阴道窥器充分暴露子宫颈,棉签拭去子宫颈口多余的分泌物;将一次性取样器插入子宫颈管,顺时针方向轻轻转动5~10圈;收集子宫颈管、子宫颈移行带及子宫颈表面的细胞,置于特制的保存液中。HR-HPV DNA检测:采用PCR体外扩增和DNA反向点杂交相结合的方法,先利用HPV的基因特点设计特异引物,扩增出23种HPV基因型目的片段(包括17种高危型和6种低危型),再将扩增产物与固定在膜条上的分型探针进行杂交,根据杂交信号的有无来判断HPV是否感染;试剂盒购自凯普生物公司基因检测,可检测23种HPV亚型,包括17种HR-HPV(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82)和6种低危型HPV(6、11、42、43、44、81)。HPV E6/E7 mRNA检测:标本采集后先进行离心、裂解细胞、配置检测缓冲液、杂交捕获E6/E7、放大信号、底物发光反应等一系列步骤,然后放入河南科蒂亚公司Quanti VirusTM诊断试剂盒及冷光仪进行检测。阴性:E6/E7<1.0,无拷贝数值;阳性:E6/E7≥1.0,拷贝的数值由仪器自动读数。
1.3 阴道镜检查及活检方法 采用电子阴道镜放大10~40倍下观察,于醋白及碘试验异常处行子宫颈多点活检术;如镜下未见明显异常,则于3、6、9、12点位分别取材并同时行子宫颈管搔刮。所取组织送病理学检查,病理检查结果分为慢性子宫颈炎、CINⅠ、CINⅡ、CINⅢ和子宫颈癌。
1.4 统计学方法 采用SPSS26.0统计软件。计数资料用例或百分比描述,以子宫颈活检或子宫颈管搔刮的组织学诊断结果为金标准,子宫颈炎及CINⅠ提示病理阴性,CINⅡ及以上提示病理阳性,两种方法的灵敏度、特异度、阳性预测值和阴性预测值比较行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 绝经后ASCUS患者HR-HPV DNA、HPV E6/E7 mRNA检测及病理检查结果 阴道镜检查及活检结果,慢性子宫颈炎126例、CINⅠ26例、CINⅡ21例、CINⅢ16例、子宫颈癌7例;HR-HPV DNA阳性102例,其中慢性子宫颈炎43例、CINⅠ18例、CINⅡ19例、CINⅢ15例、子宫颈癌7例;HPV E6/E7 mRNA阳性72例,其中慢性子宫颈炎19例、CINⅠ13例、CINⅡ18例、CINⅢ15例、子宫颈癌7例。
2.2 HR-HPV DNA、HPV E6/E7 mRNA检测在绝经后ASCUS分流中的诊断效能比较 在152例子宫颈病变病理阴性患者中,HR-HPV DNA阳性61例,而HPV E6/E7 mRNA阳性32例;在44例子宫颈病变病理阳性患者中,HR-HPV DNA阳性41例,HPV E6/E7 mRNA阳性40例。HPV E6/E7 mRNA诊断病理阳性患者的灵敏度、阳性预测值、阴性预测值与HR-HPV DNA差别不大,而特异度高于HR-HPV DNA(P<0.05)。见表1。
3 讨论
子宫颈癌的发生发展是一个相对缓慢的过程,要经历数年至10余年,预防的关键是通过高效的筛查,尽早确诊并能有效治疗癌前病变,减少其发生。随着人口老龄化的迅速发展,绝经期人群日益庞大。已有流行病学研究发现,我国绝经后女性由于各种原因造成子宫颈癌筛查过程中中晚期浸润癌多见[7]。积极的早期筛查并进行干预可以达到早发现、早诊断、早治疗的效果。
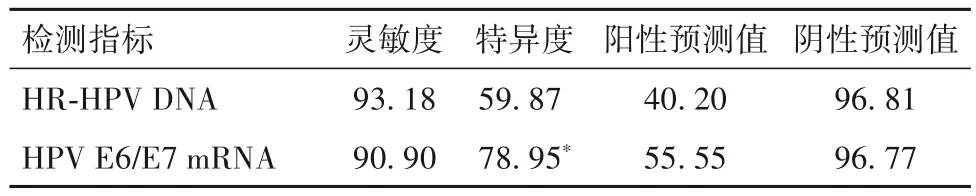
表1 HR-HPV DNA、HPV E6/E7 mRNA诊断绝经后ASCUS子宫颈病变病理阳性的效能比较(%)
TCT是目前子宫颈细胞学筛查的主要检查方法,其有效性、实用性已得到广泛认可。ASCUS是临床医生最难判断的诊断结果,可以由各种原因引起,主要包括炎症反应、子宫内节育环、癌前病变,异常细胞程度不够诊断标准等,但发生子宫颈高级别病变甚至子宫颈癌的概率较低。如何分流ASCUS,目前国际国内均无统一标准,临床处理比较棘手。而绝经后妇女由于体内雌激素水平降低导致子宫颈上皮细胞萎缩,生理性形态发生改变及慢性炎症的增加,导致子宫颈细胞发生异型性改变,ASCUS检出率较未绝经妇女明显增加。研究发现,绝经后女性ASCUS转归为子宫颈高级别病变和子宫颈癌的概率明显高于未绝经女性,如何正确处理绝经后女性的ASCUS,是临床上一个亟需解决的问题。
子宫颈癌作为惟一明确病因的恶性肿瘤,HRHPV感染为其主要病因,但子宫颈HPV感染常为一过性,有90%的感染者在8~24个月内自然清除[8-9],而HR-HPV持续感染是子宫颈癌发生的主要原因,真正HPV阴性的高度鳞状上皮内病变(HSIL)或者子宫颈癌极为罕见[10]。临床检测的HPV DNA仅能提示是否有HPV感染,不能区分是持续性感染还是暂时的无意义感染。美国一项多中心研究发现,细胞学为ASCUS的患者中,HR-HPV DNA分型检测CIN及以上的敏感度为96.3%,其中真正需要阴道镜检查和子宫颈活检的患者仅56.1%[11]。这说明其特异度不高,可能造成过度诊断、过度治疗,不适合用HPV DNA进行分流。
当HPV的DNA被整合到人体宿主细胞时,E6、E7被大量复制,代表致癌基因的活动状态;所以,HPV E6/E7 mRNA的检测可以剔除那些一过性的游离感染,更有助于判断子宫颈癌前病变的进展情况。有研究发现,HPV E6/E7 mRNA在年轻女性ASCUS及轻度鳞状上皮内病变(LSIL)中筛查子宫颈高级别病变的特异度及阳性预测值均高于HR-HPV DNA,能对ASCUS患者进行有效分流,避免了过度诊断和潜在的过度治疗[12]。国内有研究发现,HPV E6/E7 mRNA检测ASCUS中HSIL及子宫颈癌的灵敏度与HPV DNA检测差异无统计学意义,而特异度明显高于HPV DNA检测,差异有统计学意义[13]。本研究在绝经后女性中也证实了这一观点,即HPV E6/E7 mRNA在ASCUS中对于诊断子宫颈高级别病变及子宫颈癌的特异度高于HR-HPV DNA,诊断效能更高,能把更多无进展性病变重新归入常规的筛查程序中,减少不必要的阴道镜及子宫颈活检。这样处置可以减少漏诊子宫颈高级别病变的风险并指导后续随访监测,且避免过度治疗,对后续治疗及随访有指导意义,但需要前瞻对照研究继续论证。
综上所述,在绝经后妇女ASCUS患者中,HPV E6/E7 mRNA可以作为辅助分流诊断子宫颈高级别病变的有效检测手段,并在一定程度上评估HRHPV的致瘤性,为临床医生提供了比HPV DNA更有预测价值的检测结果。HPV E6/E7 mRNA可以有效提高ASCUS中子宫颈高级别病变的检出率,降低漏诊率,分流ASCUS患者并指导随访和治疗;可以增加高级别病变的检出率,减少患者等待重复细胞学检查的心理焦虑和不必要的阴道镜检查[14-15],并指导后续随访及治疗,在早期子宫颈高级别病变筛查中有重要的临床价值。
