瓦氏黄颡鱼头肾组织学观察与先天性免疫屏障研究
2021-02-28戴旭平覃川杰
陈 杰,贺 扬, ,戴旭平,王 均, ,覃川杰,,李 锐
(1.内江师范学院生命科学学院,四川 内江 641000;2.内江师范学院长江上游鱼类资源保护与利用四川省重点实验室,四川 内江 641000)
免疫系统是一个保护机体免受感染或疾病的复杂系统,包括先天性免疫和适应性免疫系统。机体通过先天性和适应性免疫反应识别抗原结构,触发不同的分子和细胞机制以清除抗原。免疫反应对所有个体都至关重要,因此在进化过程中除保留所有物种都具有的一些重要特征外,各物种都出现了变化,如免疫反应方式、器官、免疫球蛋白以及细胞因子等。鱼类的免疫器官没有淋巴结和骨髓,但具有胸腺、脾脏和头肾[1]。胸腺、脾脏分别为鱼类初级、次级免疫器官,头肾兼具造血、免疫和内分泌功能:造血功能类似于哺乳动物的骨髓,免疫功能类似于哺乳动物的淋巴结,而内分泌功能等同于哺乳动物的肾上腺[2-3]。因此,研究鱼类头肾的组成结构对于深入探索鱼类造血、免疫和内分泌功能均具有重要意义。
瓦氏黄颡鱼 (Pelteobagrus vachelli),隶属于鲿科、黄颡鱼属,主要分布于长江、黄河、珠江等流域,其生长速度快、养殖周期短、肉质鲜嫩,深受养殖者和消费者喜爱[4]。根据《2019 中国渔业统计年鉴》数据,2018 年我国黄颡鱼养殖年产量超50万吨,比2017 年增长了6.16%[5]。随着黄颡鱼养殖业的发展,细菌、寄生虫以及病毒性疾病问题日益凸显,严重威胁到黄颡鱼的健康养殖。增强鱼体免疫力和调节免疫体系是预防和治疗水产动物疾病的重要策略。因此,掌握鱼体的免疫系统组成、免疫途径及免疫过程是研发鱼类免疫增强剂和免疫调节剂的必备基础。目前,关于瓦氏黄颡鱼免疫系统的研究尚薄弱,各免疫器官的组成、结构和分工尚不明确。本研究通过HE 常规染色和改良James 特殊染色技术观察了头肾的结构和组成,并采用台盼蓝活体染色法对头肾的先天性免疫屏障进行了定位,以期为瓦氏黄颡鱼疾病的诊断提供新思路,为深入研究头肾的免疫功能提供基础资料。
1 材料与方法
1.1 实验动物
2019 年9 月,于内江市水产市场购买瓦氏黄颡鱼50 尾,体质量为 (100±20) g,鱼体健康无病,雌雄均有。活体运回实验室,用2 mg·L−1高锰酸钾溶液浸泡消毒10 min,移入已备好的曝气水桶内,暂养15 d。每天按瓦氏黄颡鱼体质量的3%~4% 投喂饲料 (普加特牌黄颡鱼饲料f3 系列1.5 号料),水温为 (26±2) ℃。每2 d 换水1 次,每次换水1/3。
1.2 头肾的解剖形态
随机挑选6 尾瓦氏黄颡鱼,用0.5 mL·L−1乙二醇苯醚麻醉致死,放于解剖盘中。解剖前,将瓦氏黄颡鱼左侧平放;由肛门前端开剪,斜向上剪至侧线下方,然后平行侧线剪至胸鳍基部后端,最后斜向下剪至围心腔前端,暴露瓦氏黄颡鱼腹腔,观察头肾位置、形态和颜色。
1.3 头肾的组织学方法
采集健康瓦氏黄颡鱼的头肾,置于4%多聚甲醛中固定48~72 h。固定后经50%、70%、80%、95%和100%梯度乙醇脱水,甲苯透明,石蜡包埋。石蜡包埋块使用LEICA 轮转式切片机进行切片,HE 染色切片厚度为3 μm,改良James 染色为7 μm。参照《实用现代病理学技术》[6]及林鸿翔和朱建善[7]的改良James 染色技术,分别对2 种切片进行HE 染色和改良James 染色。
1.4 先天性免疫屏障观察
采用台盼蓝活体染色法进行头肾先天性免疫屏障观察。具体方法为:36 尾健康瓦氏黄颡鱼用乙二醇苯醚麻醉后,腹腔注射1% 台盼蓝注射液0.2 mL·尾−1。注射后立即放入水中继续饲养,分别于第4、第8、第24、第48 和第72 小时随机采集6 尾瓦氏黄颡鱼,观察并记录鱼体颜色变化。于台盼蓝注射前,采集6 尾健康瓦氏黄颡鱼的头肾,记为第0 小时,作为对照。采集的头肾于4%多聚甲醛中固定,用于组织学观察。头肾经脱水、透明、包埋后,进行切片。捞取连续2 张切片,1 张用于HE 染色,1 张直接脱蜡后封片。
1.5 结果分析与统计
切片使用Motic SMZ-168 型数码显微镜在10×和40×物镜和10×目镜下观察,并用Moticam 2506 数码成像系统采集图片。为监测台盼蓝的动态变化情况,随机拍取 (400×)采集台盼蓝处理后的未染色头肾切片 (每张4 个视野),使用Image-Pro Plus 6.0 软件定量测定台盼蓝的分布面积。使用SPSS 16.0 软件One-way ANOVA 对实验数据进行统计分析,用Graph Pad Prism 绘图。
2 结果
2.1 头肾的解剖位置与形态
瓦氏黄颡鱼头肾位于体腔前端的围心腹腔隔膜的前背方,与胸腔内咽退缩肌相连接。头肾与后肾不相连,颜色与后肾颜色相近,但体积明显小于后肾。头肾分为两叶,对称地分布于脊柱两侧,呈扇形,左右两叶之间有浅凹,红褐色 (图1)。

图1 瓦氏黄颡鱼头肾解剖示意图a.头肾的解剖位置;b.头肾的形态Figure 1 Anatomical diagram of head kidney of P.vachellia.Anatomical location of head kidney;b.Anatomical structure of head kidney
2.2 头肾的组织结构
健康瓦氏黄颡鱼的头肾主要由被膜和实质两部分组成。被膜位于头肾最外层,为薄层纤维组织,未见明显的小梁 (图2-a)。实质中无肾单位,可见大量核大、质浅的网状细胞相互联结,形成形状不规则的细胞支架,与内皮细胞相连,形成网状内皮系统。根据淋巴细胞的聚集程度和排列方式,可将其分为粒细胞聚集区和淋巴细胞聚集区,两区之间无明显界限。粒细胞聚集区HE 染色较浅,主要为中性粒细胞和一些淋巴细胞,细胞排列无序,血窦狭窄 (图2-b);淋巴细胞聚集区呈蓝紫色,淋巴细胞高度聚集,呈条状索排列,血窦较宽,相间分布于淋巴细胞条索间。肾间组织主要位于血管周围,细胞嗜酸性较强,但嗜碱性较弱,使整个区域较淋巴细胞区染色浅 (图2-c)。在淋巴细胞聚集区和血管周围可见黄褐色的黑色素巨噬细胞中心,呈不规则团状,周围无扁平细胞包裹 (图2-d)。
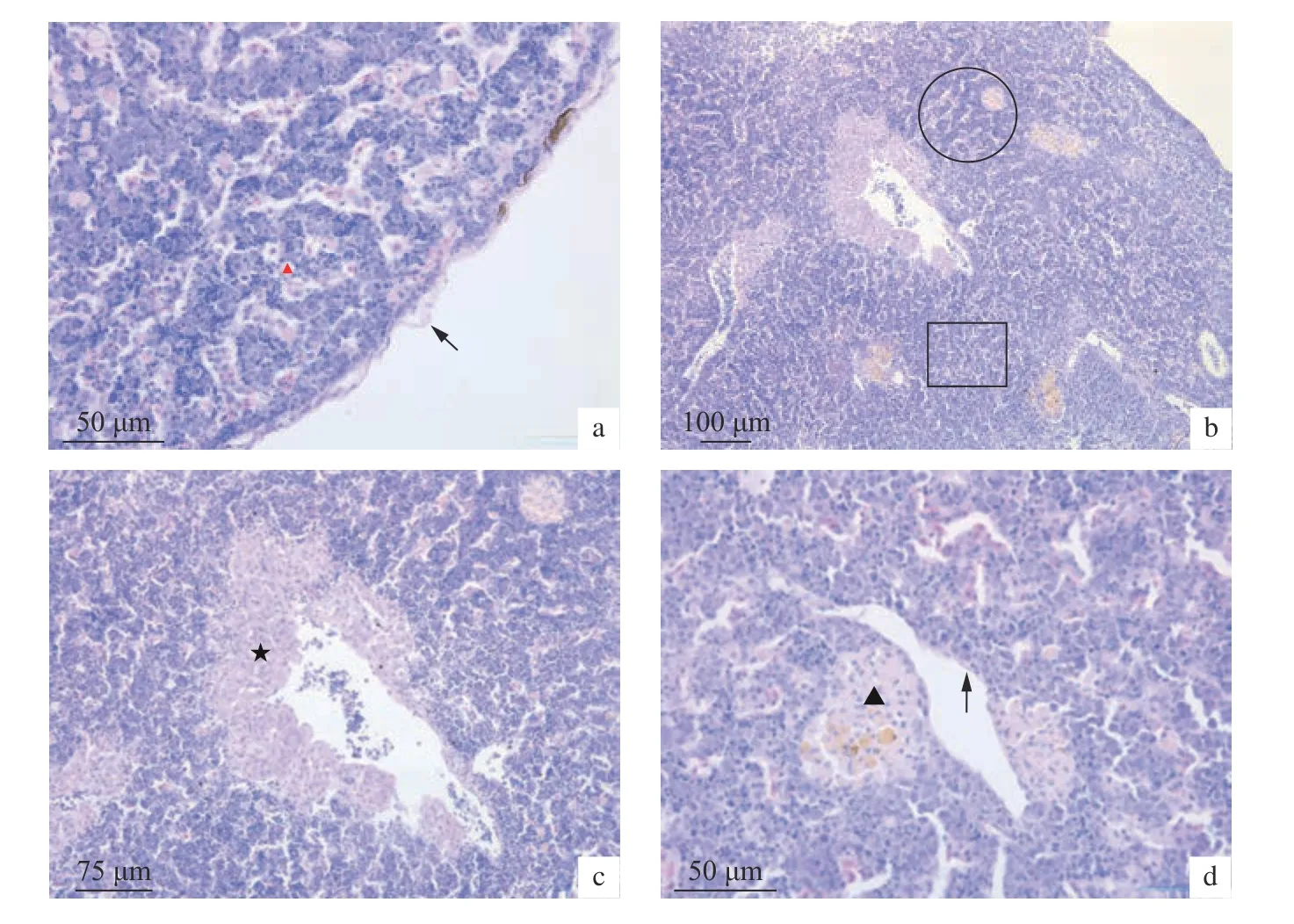
图2 瓦氏黄颡鱼头肾的组织结构HE染色观察a.被膜 (→),血窦 (▲);b.淋巴细胞聚集区 (○) 与粒细胞聚集区 (□);c.肾间组织 (★);d.内皮细胞 (→)和黑色素巨噬细胞中心 (▲)Figure 2 HE Staining observation of head kidney of P.vachellia.Capsule (→),blood sinus (▲);b.lymphoid zone (○) and granulocytic zone (□);c.Anterior inter-renal tissue (★);d.Endothelial cells (→) and melanin macrophage centers (▲)
2.3 头肾的血管与纤维系统
经改良James 染色后,观察瓦氏黄颡鱼头肾的血管与纤维分布情况发现:网状纤维呈黑色,胶原纤维呈黄色,细胞核为红色。头肾中主要为静脉血管,可见少量动脉血管 (图3-a);网状纤维广泛分布于头肾中,而胶原纤维仅见于动脉管壁周围;网状纤维位于头肾被膜时,呈线条状环绕头肾 (图3-b);位于静脉血管时,绕血管内侧数圈后,呈放射状向四周分布;位于动脉血管时,贴附于血管管腔(图3-c);胶原纤维仅见于动脉血管周围,呈多量胶原纤维围绕在动脉周围 (图3-d);除血管和被膜外,还可见单层网状纤维包绕在黑色素巨噬细胞中心的外层 (图3-e);交错缠绕的网状纤维形成网眼,分布于肾间细胞中 (图3-f)。
2.4 台盼蓝活体染色
2.4.1 体色变化 注射台盼蓝前,瓦氏黄颡鱼体色呈青黑色 (图4-a)。腹腔注射台盼蓝第4 小时瓦氏黄颡鱼的胸鳍基部和鳃盖边缘被台盼蓝浸染为蓝色;第8 小时吻端、鳃盖和全身鳍条被浸染为蓝色,鳍条基部最为明显 (图4-b);第24 小时整个头部、各鳍基部及尾柄处呈蓝色(图4-c);第48 小时一些鱼整体呈现蓝色;第72 小时鱼体蓝色加深 (图4-d)。

图4 注射台盼蓝不同时间点瓦氏黄颡鱼体颜色变化a.正常体色,未注射台盼蓝;b.注射第24 小时;c.注射第48 小时;d.注射第72 小时Figure 4 Changes of fish color at different time of injection trypan blue in P.vachellia.Normal body color without trypan blue injection;b.24 h after injection;c.48 h after injection;d.72 h after injection
2.4.2 台盼蓝的定量分析 腹腔注射台盼蓝后,显微镜观察台盼蓝的分布情况。结果显示,注射后第4 小时头肾中出现少量台盼蓝,呈点状或小聚集团状;注射后第8 至第72 小时台盼蓝的数量逐渐增多,颜色更加分明,细胞内的台盼蓝从小聚集团慢慢变成大聚集团 (图5)。IPP 6.0 测定台盼蓝的出现面积,SPSS 16.0 统计结果显示,第0 小时未检测到台盼蓝;第4 小时台盼蓝含量较少;第8 小时台盼蓝的数量有所增加但不显著 (P>0.05);第24 小时台盼蓝数量明显增多 (0.01 2.4.3 台盼蓝分布部位 对比台盼蓝出现比较丰富的第48 和第72 小时头肾的HE 染色和不染色切片,发现台盼蓝只出现于血窦内壁网状内皮系统的细胞内和血窦中的一些游离的巨噬细胞内,未出现于血管壁、头肾间组织及黑色素巨噬细胞中心(图7)。 头肾的颜色、大小在一定程度上可反映鱼体的健康状态,观察头肾形态颜色,在一定程度上可作为疾病诊断的指标。Singh 等[8]发现慢性氟化物中毒的尖齿胡鲶 (Clarias gariepinus),头肾与鱼体的比值明显减小;Fishelson[9]发现生长于严重污染水体中的巨齿天竺鲷(Cheilodipterus lineatus)头肾明显增大;何洁[10]报道尼罗罗非鱼 (Oreochromis niloticus) 感染无乳链球菌(Streptococcus agalactiae)后,其头肾颜色变暗并肿大。因此,了解头肾及其形态,对鱼体健康评价具有一定的应用价值。然而,不同鱼类的头肾在形态上差异较大。有些鱼类头肾和体肾间无明显界限,如鲑鳟鱼类、牙鲆 (Paralichthys olivaceus) 的头肾呈暗红色,与体肾无明显界限,左右两叶呈Y 型对称相连[11-12];四指马鲅 (Eleutheronema tetradactylum)、尼罗罗非鱼的肾体前端分叉膨大部分为头肾,呈深褐色[10,13];花尾胡椒鲷(Plectorhinchus cinctus)、花鲈 (Lateolabrax japonicus)、驼背鲈 (Chromileptes altivelis)、草鱼 (Ctenopharyngodon idellus)、条石鲷 (Oplegnathus fasciatus) 和红笛鲷 (Lutjanus sanguineus) 的头肾虽有心腹隔膜与体肾隔开,但头肾基部与腹腔内体肾前端相连,且头肾左右两叶在基部相连,呈扁平状,呈暗红或红褐色[14-19];鳜(Siniperca chuatsi) 成鱼头肾通过狭窄的过渡区与体肾相连[20]。有些鱼类头肾与体肾、两叶头肾之间明显分离,如南方鲇 (Silurus meridionalis)、鲻 (Mugil cephalus) 的头肾与体肾明显分离,且头肾的左右两叶不相连,颜色为红褐色[21-22]。也有些鱼类头肾可分为多叶,如鲤 (Cyprinus carpio) 的头肾分为左右对称的两叶,但每一叶又可分为一近三角形和一近四边形的前后两小叶,呈褐色[23]。本研究中瓦氏黄颡鱼头肾与体肾分离,头肾呈扇形,左右两叶以浅凹分开,与祁保霞[24]观察的黄颡鱼头肾与体肾相连、呈圆锥状的结果不同。这种差异可能与鱼的体腔大小、体形、生活习性、生长环境等因素相关[25]。因此,正确认识不同鱼类的头肾形态和大小,对鱼体健康状态的诊断具有重要意义。 图5 瓦氏黄颡鱼头肾中台盼蓝的分布 (未染色)a.第0 小时未注射台盼蓝,正常头肾;b.第4 小时台盼蓝开始出现在一些细胞里面,呈点状或小聚集团状 (→);c.第8 小时台盼蓝开始增多(→);d.第24 小时台盼蓝数量增多较明显,可明显看见小聚集团面积增大(→);e.第48 小时台盼蓝增加特别明显,可看见大面积台盼蓝聚集团(→);f.第72 小时台盼蓝数量继续增多(→)Figure 5 Distribution of trypan blue in head kidney of P.vachelli (Unstained)a.Trypan blue was not injected at the 0th hour,normal head kidney;b.Trypan blue began to appear in some cells at the 4th hour,showing punctate or small aggregates (→);c.Trypan blue began to increase at the 8th hour (→);d.The number of Trypan blue increased more obviously at the 24th hour,and the area of small aggregates could be clearly seen (→);e.The increase of Trypan blue at the 48th hour was particularly obvious,and large area of Trypan blue aggregates could be seen (→);f.The number of trypan blue continued to increase at the 72nd hour (→). 图6 瓦氏黄颡鱼头肾中第0至第72小时台盼蓝含量变化趋势*.0.01 图7 瓦氏黄颡鱼台盼蓝的分布部位a.第48 小时头肾,HE 染色,示台盼蓝(→);b.a 中同一区域头肾未染色,示台盼蓝(→);c.第72 小时头肾,HE 染色,示台盼蓝(→);d.c 中同一区域头肾未染色,示台盼蓝(→);e.网状内皮细胞(→);f.血窦中游离的巨噬细胞(→)Figure 7 Distribution of trypan blue in P.vachellia.48th hour head kidney,HE staining,showing trypan blue (→);b.The same area of a,unstained,showing trypan blue (→);c.72nd hour head kidney,HE staining,showing trypan blue (→);d.The same area of c,unstained,showing trypan blue (→);e.Reticular endothelial cells (→);f.Free macrophages in blood sinus (→) 被膜是头肾最外层的保护层,对于头肾的形态结构具有很好的保护作用。疾病状态下头肾的被膜可能出现增厚、变薄、破坏等病变,如尼罗罗非鱼感染无乳链球菌24~72 h,其头肾被膜覆盖有白色颗粒状物质[10]。健康头肾是否有小梁对于评价头肾增生有重要意义。健康鱼体头肾的被膜系统差异较大:1) 很薄,如花尾胡椒鲷、花鲈、条石鲷、红笛鲷、鲤和草鱼,表面仅为一层极薄的纤维结缔组织覆盖[14-15,17-19,23],小锯盖鱼(Centropomus paralle-lus) 虽然被膜很薄,却可在实质内形成小梁[26];2) 厚薄不一,如驼背鲈[16];3) 被膜较厚,如黄颡鱼有较厚的胶原纤维质膜包裹[24]。因此,判断头肾被膜是否发生病变,需有健康头肾作对照。本研究中,瓦氏黄颡鱼的头肾最外层由薄层的结缔组织覆盖,结缔组织中有网状纤维,但无胶原纤维。 硬骨鱼类的头肾在胚胎时期具有泌尿功能,但随着年龄的增长,多数鱼类头肾的泌尿机能逐渐丧失,被淋巴髓样组织充填;仅少数成鱼的头肾中仍保留了肾单位,如弹涂鱼 (Periophthalmus cantonensis) 的头肾中有肾单位[25]、尼罗罗非鱼的头肾中有少量肾小管[26]。本研究中瓦氏黄颡鱼的头肾实质中未见肾单位,推测瓦氏黄颡鱼的头肾和大多数硬骨鱼一样不再有泌尿功能。作为淋巴-肾上腺组织,头肾除具有大量淋巴细胞外,还有肾上腺,也可能存在甲状腺。本研究发现,瓦氏黄颡鱼有肾上腺,无甲状腺。肾上腺的肾间组织细胞与淋巴细胞分界明显,由网状纤维分隔成小叶,与南方鲇[21]、条斑星鲽 (Verasper moseri)[27]等相似。 黑色素巨噬细胞中心被认为参与了抗原递呈、铁离子回收、异物清除等免疫生理过程[1,28-29],其数量、色素颜色及形态等可反映鱼体的年龄、应激状态和疾病状态。如黄绿色的脂褐素是过氧化产物,可能产生自由基,并反映组织分解;棕色或黑色的蜡样黑色素常见于巨噬细胞溶酶体中,可能暗示细菌感染;棕色至黑色颗粒样的含铁血黄素可反映红细胞破坏[30]。黑色素细胞中心的形态、大小以及细胞成分随种类、器官、性别、季节的不同而有差异[31]。有些鱼类的黑色素巨噬细胞中心形状较规则,周围有单层扁平细胞包裹,如鲤[23];有些鱼类黑色素巨噬细胞中心形状不规则,如印度囊鳃鲶(Heteropneustes fossilis)[31]。本研究中瓦氏黄颡鱼头肾中的黑色素巨噬细胞中心未见单层扁平细胞包裹,但其边缘有一层网状纤维围绕,推测瓦氏黄颡鱼头肾中黑色素巨噬细胞聚成球体而不散离的状态可能是网状纤维的网罗作用。 网状内皮系统是头肾的重要组成部分,具有吞噬和抗原递呈作用[32]。为观察瓦氏黄颡鱼头肾的先天性免疫屏障,本研究使用腹腔注射台盼蓝方法对其进行活体染色。台盼蓝是一种常用的活体染色剂,可用来检测细胞膜的完整性、细胞是否存活,也可用于机体的天然屏障观察[33]。经台盼蓝腹腔注射后,发现台盼蓝主要分布于瓦氏黄颡鱼头肾中血窦周围的内皮细胞以及游离的巨噬细胞,推测这两类细胞构成了瓦氏黄颡鱼头肾的先天性免疫屏障。本研究中黑色素巨噬细胞未见台盼蓝存在,是否与黑色素巨噬细胞的选择性吞噬有关有待进一步研究。3 讨论
3.1 瓦氏黄颡鱼头肾形态



3.2 瓦氏黄颡鱼头肾的组织结构
3.3 瓦氏黄颡鱼头肾的先天性免疫屏障
