基于脂肪酸标记法和稳定同位素技术的通州湾养殖水域海蜇食性分析
2021-02-28王佚兮冯慧敏王陈星
张 健 ,王佚兮,冯慧敏,王陈星,唐 议
(1.上海海洋大学海洋科学学院,上海 201306;2.上海海洋大学大洋渔业资源可持续开发教育部重点实验室/上海海洋大学国家远洋渔业工程技术研究中心/农业农村部大洋渔业开发重点实验室,上海 201306;3.上海海洋大学海洋文化与法律学院,上海 201306)
海蜇 (Rhopilema esculentum) 隶属于腔肠动物门、钵水母纲、根口水母目、根口水母科、海蜇属[1],是近岸营浮游生活的暖水性大型水母,主要由水和蛋白质组成,具有很高的食用价值[2]、医药价值[3]和美容价值[4]。我国海蜇野生资源丰富,是重要的海洋捕捞产品之一,为了满足国内外市场需求,渔民长期过度捕捞使得其野生资源急剧减少,而海蜇养殖业成为弥补其自然产量的一种必然手段。海蜇生长速度快、养殖周期短、成本低,能够带来很高的商业利益,因此,海蜇人工养殖技术逐渐成为水产养殖的新兴产业[5]。在海蜇养成阶段主要以通过施肥培养的浮游生物作为饵料[6-7],但随着海蜇的生长,池塘内的浮游生物越来越难以满足其对饵料的需求。缺乏适合海蜇生长的人工饵料已成为制约其养殖业发展的一个重要因素。因此,研究养殖海蜇的食性特征对研制人工饵料有重要意义;此外,在可控水域条件下研究海蜇食性,对今后开展我国近海海蜇资源及种群的生态研究具有参考价值。
传统的食性研究方法如胃含物分析法,只能获得近期摄入的食物信息,无法得知被吸收的食物类型[8-9]。20 世纪70 年代以来,生物化学示踪技术被广泛应用于营养生态学研究。生物对脂肪酸的合成及改造能力具有差异性,特定的脂肪酸只能被特定的生物合成,且脂肪酸在食物网的传递过程中具有保守性,因此脂肪酸标记法可以用来指示消费者的食物来源并判定生物间的摄食关系[10]。在生态系统中,碳、氮同位素可通过食物链在生物体内稳定富集,通过生物体内的稳定同位素比值和与其食物相应同位素比值的对比可以有效地揭示较长时间尺度上消费者的食物来源及组成[11]。目前对人工养殖海蜇的研究大多集中在生态养殖技术[6,12-13]、生长发育[14-15]、人工育苗[16-17]等方面,对其食性方面的研究甚少,因此,本研究运用脂肪酸生物标记法和稳定同位素技术探究养殖成体海蜇的食性,分析其主要摄食来源,为人工饲料的研制提供参考,并为改善养殖海蜇种质退化的研究提供依据。
1 材料与方法
1.1 样本采集与前处理
养殖海蜇于2018 年10 月24 日随机取自江苏通州湾养殖水域,共取样32 只,均为成熟海蜇(无人工饵料喂养)。海蜇捕获后,置于过滤海水(用0.45 μm 滤膜过滤的表层海水) 中暂养2 h,排空消化道[18],测定其伞径 (mm) 和体质量 (g) 等基础生物学信息,经超离子水润洗后用干冰冷藏迅速运回实验室,−80 ℃保存。将冰冻状态的样本放入冷冻干燥机 (Christ Alpha 1-4) −54 ℃干燥48 h,用混合磨球仪磨成粉末,装入干燥离心管保存于干燥箱中以备后续实验。
1.2 脂肪酸测定
采用改进的Folch 方法提取海蜇中的脂肪酸[19]。取0.2 g 样品粉末于50 mL 离心管中,加入15 mL 三氯甲烷-甲醇溶液 (2∶1) 浸泡20 h 以上,离心后取上清液于带塞试管中,加入10 mL 三氯甲烷-甲醇混合溶液冲洗试管内的残渣,再次离心取上清液,将两次离心收集的上清液合并,加入4 mL 0.9%的氯化钠溶液,静置约2 h。吸取下层溶液置于圆底烧瓶中使用水浴进行蒸馏,得到粗脂肪样品[20]。继续向圆底烧瓶中加入4 mL 氢氧化钾-甲醇溶液 (0.5 mol·L−1),混合后连接水浴回流装置(100 ℃),水浴加热5~10 min,加入4 mL 三氟化硼-甲醇溶液煮沸25~30 min,最后加入4 mL 正己烷回流萃取2 min。待圆底烧瓶中溶液冷却后加入10~15 mL 氯化钠饱和溶液,摇晃均匀后将溶液倒入试管中静置1~2 h 分层。使用注射器吸取一定量的正己烷层 (即上层) 溶液进行测量。用美国Agilent 公司的5977A 气相色谱质谱联用仪[21]进行色谱分析。气相色谱质谱联用仪的条件控制为:色谱柱HP-88;初始温度125 ℃维持0 min,以8 ℃·min−1的速度升至145 ℃,维持26 min,再以2 ℃·min−1的速度升至220 ℃,维持1 min,最后以1 ℃·min−1的速度升至227 ℃,维持1 min;分流比为10∶1。以37 种脂肪酸混标及内标19 烷酸甲酯标品作为标准[22],通过比对保留时间对脂肪酸进行定性分析,采用内标法对脂肪酸进行定量分析。脂肪酸含量表示为单个脂肪酸占全部脂肪酸总量的百分比。
1.3 稳定同位素测定
称取2 mg 样品粉末放入锡箔纸中包被,送入IsoPrime 100 稳定同位素分析质谱仪 (IsoPrime Corporation,英国) 和vario ISOTOPE cube 元素分析仪(Elementar Analysensysteme GmbH,德国) 进行测定[23]。样品的碳稳定同位素 (δ13C) 组成和氮稳定同位素 (δ15N) 组成表达:

其中X=δ13C 或δ15N,R=13C/12C 或15N/14N 的同位素比值。δ13C 标准为Vienna PDB (相当于最初的PeeDee Belemnite 石灰岩标准),δ15N 标准为大气N2。
1.4 数据处理
脂肪酸与稳定同位素数据均重复测定3 次,以“平均值±标准差 ()”表示,采用SPSS 18.0软件进行数据统计分析。
2 结果
2.1 基础生物学
经测定,样本海蜇伞径介于190~430 mm,平均伞径为 (329±522) mm;体质量介于620~5 500 g,平均体质量为 (2 568±1 096) g。伞径-体质量关系采用幂函数表示为W=4.016×10−4×L2.6926(R2=0.95,n=32)。
2.2 海蜇脂肪酸组成
本研究共检测出29 种脂肪酸 (表1),起始碳链长度介于14 碳到24 碳。其中饱和脂肪酸 (Saturated fatty acid,SFA) 有10 种,总含量为 (232.05±13.23) %,主要为十六酸 (C16:0) 和十八酸 (C18:0);单不饱和脂肪酸 (Monounsaturated fatty acids,MUFA) 共有8 种,总含量为 (42.33±4.49) %,主要为十八碳一烯酸 (C18:1 n-9c) 和二十四碳烯酸(C24:1 n-9);多不饱和脂肪酸 (Polyunsaturated fatty acids,PUFA) 共有11 种,总含量为 (253.31±16.16) %,主要为二十碳五烯酸 (C20:5 n-3,Eicosapentanoic Acid,EPA)、二十二碳六烯酸 (C22:6 n-3,Docosahexaenoic,DHA) 和花生四烯酸 (C20:4 n-6)。n-3 系列脂肪酸含量明显高于n-6 系列脂肪酸含量。ΣPUFA 和ΣSFA 显著高于ΣMUFA 含量。
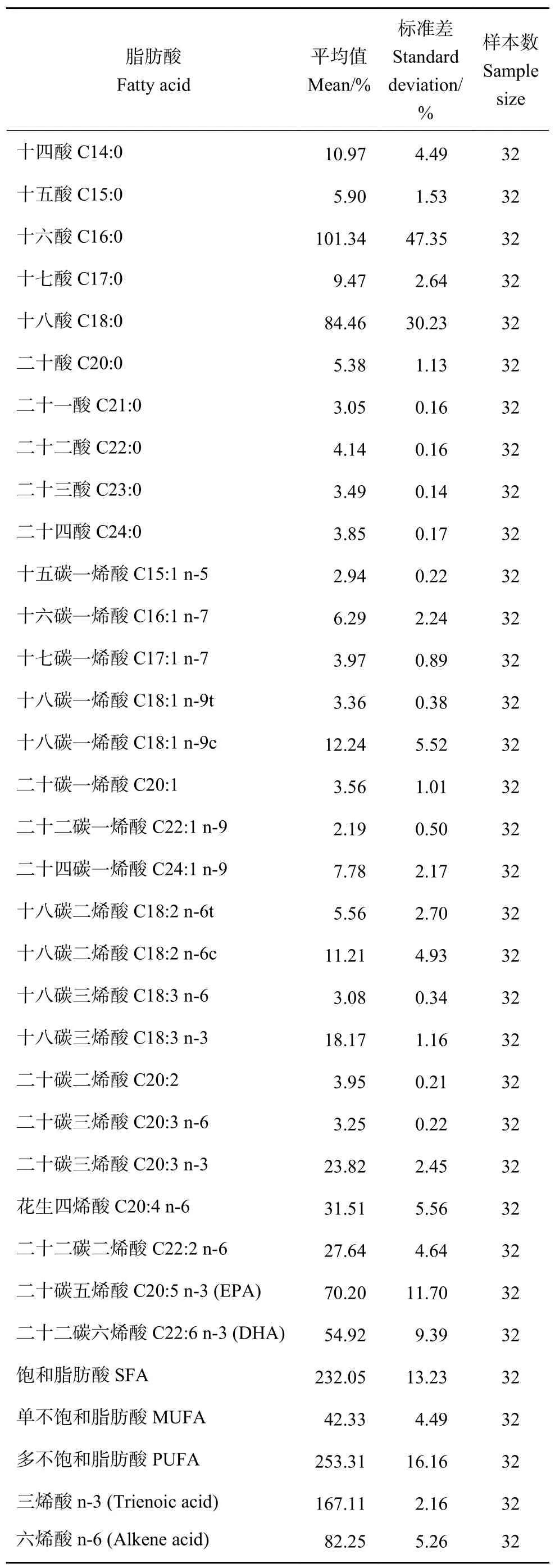
表1 海蜇的脂肪酸组成Table 1 Fatty acids compositions of R.esculentum
2.3 脂肪酸含量与伞径的关系
用Pearson 检验养殖海蜇脂肪酸含量与伞径的相关性,发现29 种脂肪酸中仅二十一酸 (C21:0)与伞径显著相关 (P<0.05,n=32),脂肪酸含量随着伞径的增加呈逐渐下降趋势。对于具有食性指示标记的脂肪酸比值分析结果显示,PUFA/SFA 和DHA/EPA 与海蜇伞径之间均不存在相关性。
2.4 海蜇的碳、氮稳定同位素组成
养殖海蜇不同伞径的碳、氮稳定同位素含量见表2,其中δ13C 的分布介于−23.54‰~−20.75‰,跨度为2.79‰,平均值为 (−22.26±0.66)‰;δ15N的分布介于8.39‰~9.85‰,跨度为1.46‰,平均值为 (9.02±0.29)‰;C/N 为3.37~3.94。
3 讨论
海蜇生长极快,从碟状幼体到伞径400 mm 的成体水母仅需约3 个月[5]。李培军等[24]对海蜇的生长研究表明,海蜇的生长呈一条S 型曲线,其生长到某一最大值后,曲线开始下降。本研究分析的养殖海蜇随着伞径的增长体质量迅速增大,说明此阶段的海蜇未到衰老期。对其脂肪酸和稳定同位素进行了以下讨论。
3.1 脂肪酸组成
郑斌[25]对不同发育阶段的养殖海蜇 (营口市荣发参蜇有限公司) 脂肪酸组成进行了分析,在成蜇(伞径>15 cm) 中共检测出28 种脂肪酸,含量较高的几种脂肪酸分别是C16:0、C18:0、十八碳一烯酸 (C18:1)、花生三烯酸 (C20:3 n-3)、EPA、DHA。本研究海蜇含量较高的脂肪酸分别是C16:0、C18:0、EPA 和DHA,这与郑斌[25]的研究结果较为接近。刘希光等[26]研究了黄海海域成熟海蜇不同部位 (海蜇皮、海蜇头、海蜇生殖腺) 脂肪酸的组成,结果发现3 个部位的脂肪酸组成差别不大,且含量最高的脂肪酸均为DHA、C20:4 n-6、EPA,这与本研究结果稍有差异,推测可能是海蜇成长环境不同造成,本研究所用的是养殖海蜇,刘希光等[26]采用的是黄海海域自然成熟的海蜇。
3.2 特征脂肪酸分析
特征脂肪酸及其来源参照Alfaro[27]的研究结果。十八碳二烯酸和十八碳三烯酸 (C18:2 n-6+C18:3 n-3) 通常被看作陆地植物的标志[28],一般含量高于2.5%被认为陆地植物贡献显著,本研究海蜇的C18:2 n-6+C18:3 n-3 含量为6.62%,表明陆地植物对其食物来源贡献较大。EPA 可作为硅藻的特征脂肪酸[29-30],本研究中养殖海蜇存在大量的EPA,说明硅藻是其重要的食物来源之一。十五酸和十七酸 (C15:0+C17:0) 可用来指示捕食者对浮游细菌的摄食[31-32]。在本研究中,C15:0+C17:0 的含量达到了2.91%,表明碎屑物质是养殖海蜇的食物来源。这一结果与郑斌[25]研究结果一致。二十碳一烯酸 (C20:1) 和二十二碳一烯酸 (C22:1)可以作为高营养级摄食植食性桡足类的标志脂肪酸[33]。本研究C20:1+C22:1 的含量为5.75%,表明海蜇对植食性桡足类摄食较多[34-45]。C20:4 n-6 被看作底栖生物的标志[36-39],水母可通过对碎屑[28]及微型浮游动物[40]的摄食在体内累积。海蜇中C20:4 n-6 的含量为6.01%,表明底栖生物对其食物组成贡献较大。PUFA/SFA 和DHA/EPA 可用来评估营养级的大小,比值越大营养级越高[41]。金鑫等[42]通过DHA/EPA 得出蝶水母 (Ocyropsis crystallina)、瓜水母 (Bero cucumis)、四叶小舌水母(Liriope tetraphylla) 和箭虫 (Sagittaspp.) 在浮游食物网中的营养级高于中华哲水蚤 (Calanus sinicus)和磷虾 (Euphausiaspp.)。本研究中PUFA/SFA 和DHA/EPA 与海蜇伞径之间均不存在相关性,即养殖海蜇成熟后 (>200 mm),其营养地位没有发生明显的变化。Fukuda 和Naganuma[43]认为Σn-6/Σn-3可用来估算腐生食物链与捕食食物链对高营养级捕食者的贡献比例。金鑫等[18]通过比较Σn-6/Σn-3 得出墨绿多管水母 (Aequorea coerulescens) 主要参与腐生食物链,本研究Σn-6/Σn-3 较低,说明腐生食物链对养殖海蜇摄食贡献较小。
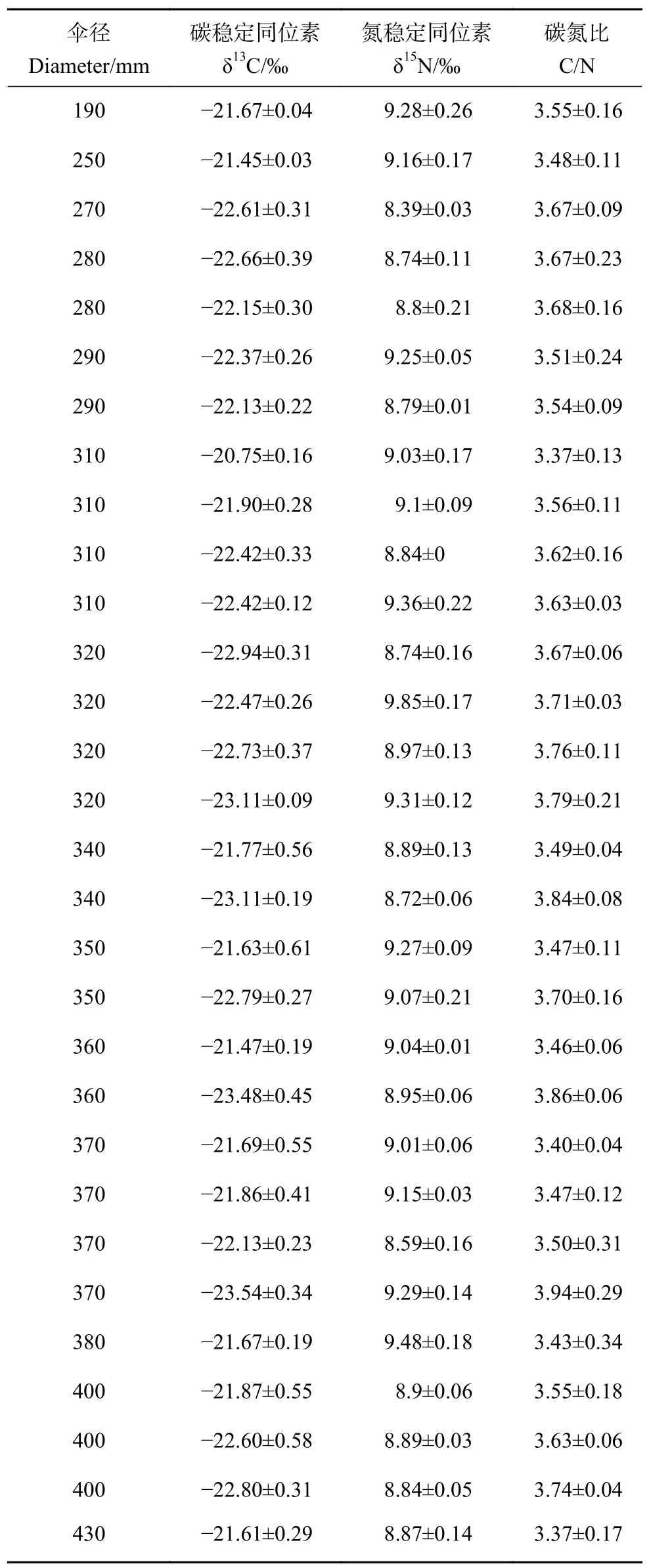
表2 海蜇碳、氮稳定同位素比值和碳、氮含量比值Table 2 Ratio of stable isotope and content of carbon and nitrogen in R.esculentum
3.3 碳氮稳定同位素分析
在水生生态系统中,δ13C 适于判断食物来源,而δ15N 用于确定生物体的营养级[44-45]。不同的初级生产者因生长代谢方式不同会导致碳氮稳定同位素特征值有很大的差异,因此消费者的碳氮稳定同位素值可以反映其食物来源[46]。Boutton[47]认为陆源C3 植物δ13C 介于−30‰~−23‰,δ15N 介于−5‰~18‰;陆源C4 植物δ13C 介于−17‰~−9‰,δ15N 介于3‰~6‰。河口区浮游植物δ13C 介于−30‰~−19‰,δ15N 介于6‰~9‰[48]。本研究海蜇δ13C 平均值为 (−22.26±0.66) ‰,介于陆源C3 植物和河口区浮游植物之间且更接近于陆源C3 植物,这可能是因为海蜇对陆源C3 植物碎屑有较多的摄食。金鑫等[18]用δ15N 特征值判断出蝶水母、瓜水母和四叶小舌水母在浮游食物网中处于较高营养级。本研究中δ15N 值差异不显著,说明海蜇 (伞径>200 mm) 食物来源基本趋于稳定,这与孙明等[49]的研究结果一致。本研究海蜇δ13C 值、δ15N 值和C/N 与海蜇伞径的相关性均不显著 (P>0.05),说明随着海蜇个体的成长,其伞径也逐渐增长,但海蜇在营养位置上并没有明显的变化。
4 结语
脂肪酸标记法和稳定同位素技术已广泛应用于海洋生物的食性研究,相比胃含物分析法更能反映出生物较长时间段内的食性[50-51]。碳、氮稳定同位素能够指示有机物的来源,其结果反映的是捕食者在相当长的一个生命阶段中所摄取的食物,经过新陈代谢消化吸收的结果。脂肪酸具有生物差异性、保守性和可保存性,可以被特定的生物合成,并通过摄食沿食物链向各级消费者传递,保留在消费者体内,但值得注意的是,同一种特征脂肪酸可以指示几个食物来源。因此将脂肪酸与稳定同位素相结合,两者相互补充,可以更准确地反映生物的食性,后续也应加入胃含物分析研究,3 种方法交叉验证,使实验结果更加全面。此外,本研究只对养殖海蜇做了脂肪酸与同位素分析,未采集浮游生物样本,后续应对浮游生物样本进行同等分析,将研究结果与养殖海蜇进行对比,以提高实验结果的准确性。
