热带普通小球藻生长过程中色素质量浓度和颜色值变化及相关性分析
2021-02-28吝思琪杨守国张兴志VASQUEZHerbertEly顾志峰王爱民
郑 兴 ,吝思琪 ,杨守国 ,张兴志,VASQUEZ Herbert Ely,顾志峰,王爱民
(1.海南大学海洋学院,海南 海口 570228;2.海南大学/南海海洋资源利用国家重点实验室,海南 海口 570228;3.海南省海洋与渔业科学院,海南 海口 571126;4.广西水产科学研究院,广西 南宁 530021)
微藻是地球上最早利用太阳能进行光合作用的生命体之一,是微观的、低等单细胞水生生物,具有太阳能利用效率高、适应环境能力强等特点[1]。微藻含蛋白质、氨基酸、多糖、维生素、不饱和脂肪酸和色素等多种高附加值的生物物质[2-3]。其种类繁多,目前已知两万多种。人类利用微藻已有几百年历史,主要集中在食用、活性物质提取利用、生物能源提取利用、环境治理等方面[4-7],微藻在海水养殖中一般用作水产动物的开口饵料。热带普通小球藻 (Chlorella vulgaris) 属于绿藻门、绿藻纲、绿球藻目、卵囊藻科、小球藻属,是一类普生性的单细胞绿藻,含有蛋白质、多糖、细胞色素、不饱和脂肪酸和生物生长因子等多种丰富的营养物质,开发应用前景十分广阔[8-9]。小球藻在1950 年首次成功被人工培养后,一直是研究者和生产者关注的焦点,其形态、营养特性、生产培养方式、加工及应用等方面被广泛研究[10]。
微藻的生长过程可简单分为接种期、快速生长期 (指数生长期)、稳定期和衰亡期。在水产养殖相关生产过程中一般使用快速生长期阶段的微藻作为饵料或加工原材料,从而保证其数量和质量。微藻生长过程的监测一般使用血球计数板技术检测细胞数,但这对生产者有一定的技术要求,如需掌握血球计数板、显微镜等操作方法,因此在实际生产过程中大部分养殖户仅通过肉眼观察藻液颜色变化来初步判断微藻的生长情况,但用人体感官判断颜色变化会受到操作者主观性的影响,存在随意性,不同评判者由于个体视觉差异对同一颜色的特征区分会存在一定偏差,无法满足现代农业生产对精准化的要求。因此有必要在利用颜色体系对微藻的生长情况进行定性描述的同时开展定量研究,尤其是量化颜色参数。
国内外颜色的量化分析研究在众多行业早已得到广泛应用,主要利用色差计开展。色差计是利用仪器内部的标准光源照明被测物体,测定其CIEL*a*b*值。CIE1976 中L*、a*、b*推荐的表色系具有均匀的颜色空间,与人的视觉相一致,其中颜色指标L*代表明度值;a*(−A~+A) 代表红度值,表示从绿到红的变化,其正值越大,绿色越淡,红色愈浓;b*(−B~+B) 代表黄度值,表示从蓝到黄的变化,其正值越大,黄色越浓[11-13]。目前尚未见颜色的量化分析在微藻养殖上的应用,因此,本研究以色度学理论为前提,利用色差仪对热带普通小球藻生长过程中的颜色动态分析进行色度学指标量化测定,分析颜色参数与色素质量浓度间的关系,以期为建立小球藻生长状况快速检测技术奠定理论基础。
1 材料与方法
1.1 实验藻种及培养
实验所用热带普通小球藻取自海南大学海洋学院保种室。实验前将藻种进行纯化扩培,取快速生长期的藻液进行实验。实验温度维持在 (25±1) ℃,光照强度控制在5 000 lx,光周期为24 h 全光照。使用过滤并灭菌的自然海水及“宁波3#微藻培养液”在5 L 三角锥形瓶中进行5 L 体积藻液的培养,用带有2 μm 孔径空气过滤器的充氧泵进行连续充气,充气量为20 L·min−1。藻细胞培养接种量为5×104个·mL−1。
1.2 实验设计
设置5 个平行培养组,以接入藻种与培养介质充分混合后为时间起点,每隔24 h 进行取样,取样前将培养瓶中的藻液摇匀,取一定量样品检测藻类细胞数目、干质量、色素质量浓度、颜色,操作重复3 次。
1.3 测定项目及方法
1.3.1 藻细胞数目的测定 采用血球计数板法进行测定。
1.3.2 光合色素质量浓度及比值测定 在弱光条件下用丙酮萃取法萃取样品色素后,用三波长比色法[14]在分光光度计岛津UV-1 700 上进行提取液的光吸收值检测,计算叶绿素a(Chl-a)、叶绿素b(Chl-b)、总叶绿素 (Chl) 和类胡萝卜素 (Caro) 的质量浓度,并计算类叶比 (Caro/Chl)。
1.3.3 颜色参数测定 采用CM-5 型号的全自动分光测色仪 (Konica Minolta,日本) 测定藻液样品的颜色参数,测定的色度学指标主要包括L*、a*、b*、相角 (H°)、饱和度 (C) 和色差值 (ΔE)。以相同的无藻培养水体作为对照值,分别测得L*、a*和b*,并计算H°、C和ΔE。计算公式为H°=arctan (b*/a*);C=(a*2+b*2)1/2;ΔE=(ΔL*2+Δa*2+b*2)1/2。
1.4 数据处理
2 结果
2.1 热带普通小球藻的生长过程及阶段划分
热带普通小球藻在养殖周期10 d 内,细胞数整体趋势为先缓慢增长后快速增长,随后呈稳定状态,最后开始降低,可分为接种期、快速生长期、稳定期和衰亡期 (图1)。接种密度为 (6.13±1.01)×104个·mL−1,在养殖第1 天后进入快速生长期[(32.20±4.15)×104个·mL−1],并在第4 天达到最高[(732.12±39.44)×104个·mL−1],随后进入稳定期 [第5 至第9 天,平均密度为 (664.12±18.73)×104个·mL−1],在第10 天藻细胞数目出现显著性下降,进入衰亡期,呈快速降低趋势 (细胞数<600×104个·mL−1,P<0.05)。

图1 热带普通小球藻生长过程中细胞数变化及阶段划分不同小写字母表示差异显著 (P<0.05);后图同此Figure 1 Change of cell density and growth phase division of C.vulgaris in process of growthDifferent lowercase letters indicate significant difference (P<0.05).The same case in the following figures.
2.2 热带普通小球藻生长过程中颜色特征值的动态变化
2.2.1L*、a*、b*变化特征 热带普通小球藻在养殖周期10 d 内,L*和a*随生长阶段的推进基本呈逐渐降低趋势,而b*呈逐渐升高趋势 (图2)。其中L*在养殖第3 天由103.04±0.01 显著降至98.70±0.38 (P<0.05),随后逐步平缓下降;a*朝负值方向发展,在养殖第2 天由−0.51±0.01 显著降至−2.08±0.06 (P<0.05);b*在养殖第2 天由0.58±0.03 显著升至7.40±0.21 (P<0.05),随后快速稳定升高。
2.2.2H°、△E和C变化特征 热带普通小球藻在养殖周期10 d 内,△E和C随生长阶段的推进基本呈稳定上升趋势,而H°则呈逐渐降低趋势(图3)。其中H°呈负值变化趋势,在养殖第1 天由−0.84±0.02 显著降至−1.23±0.02,随后平稳小幅度变化;△E在养殖第2 天由0.66±0.01 显著升至7.14±0.22 (P<0.05),然后随着养殖时间而稳健增长;C的变化趋势与△E相同,养殖第2 天由0.77±0.02 升至7.68±0.21 (P<0.05),随后稳健增长。
2.3 热带普通小球藻生长过程中色素成分质量浓度和Caro/Chl 的动态变化
2.3.1 绿色素变化特征 在养殖周期10 d 内,热带普通小球藻绿色素 (Chl-a、Chl-b和总叶绿素) 质量浓度变化整体呈先快速增长后降低的趋势 (图4)。养殖第1 天后绿色素质量浓度开始快速增长,养殖第5 天Chl-a、Chl-b和总叶绿素质量浓度分别显著增加至 (0.57±0.05) mg·L−1、(0.24±0.04) mg·L−1和 (0.81±0.08) mg·L−1(P<0.05);随后缓慢增长,并在养殖第9 天达最大值,Chl-a、Chl-b和总叶绿素质量浓度分别为 (1.03±0.12) mg·L−1、(0.36±0.07)mg·L−1和 (1.38±0.20) mg·L−1,随后开始下降。
2.3.2 Caro 的动态变化 在养殖周期10 d 内,热带普通小球藻Caro 质量浓度变化趋势与绿色素相同,整体呈先快速增长后降低的趋势 (图5)。养殖第1 天后其质量浓度开始快速增长,在第5 天显著增至 (0.52±0.05) mg·L−1(P<0.05),并在第9 天达最大值(1.14±0.15) mg·L−1,随后开始显著快速降低 (P<0.05)。

图2 热带普通小球藻生长过程中明度值 (A)、红度值 (B)和黄度值 (C) 的变化Figure 2 Change of lightness value (A),red value (B) and yellow value (C) of C.vulgaris in process of growth

图3 热带普通小球藻生长过程中相角 (A)、色差值 (B) 和饱和度 (C) 的变化Figure 3 Change of hue angle (A),color difference (B) and chroma (C) of C.vulgaris in process of growth
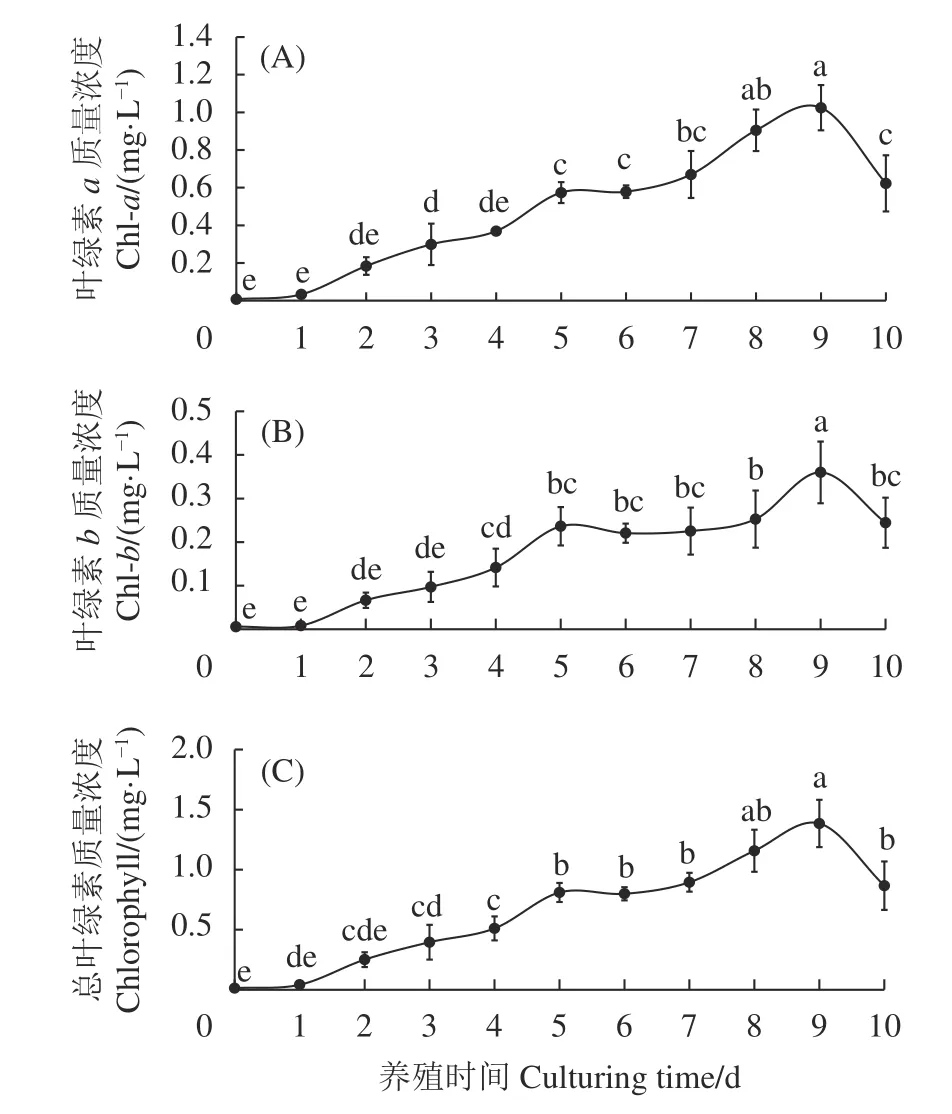
图4 热带普通小球藻生长过程中叶绿素a (A)、叶绿素b(B) 和总叶绿素 (C) 质量浓度的变化Figure 4 Change of Chl-a (A),Chl-b (B) and chlorophyll (C)mass concentrations of C.vulgaris in process of growth

图5 热带普通小球藻生长过程中类胡萝卜素质量浓度的变化Figure 5 Change of carotenoid mass concentration of C.vulgaris in process of growth
2.3.3 Caro/Chl 的动态变化 在养殖周期10 d内,随生长阶段的推进热带普通小球藻的Caro/Chl 呈不断增大趋势 (图6)。养殖第3 天显著增至0.58±0.13 (P<0.05),随后基本稳定在0.74~0.82,养殖第10 天升至1.10±0.14 (P<0.05)。

图6 热带普通小球藻生长过程中类叶比值的变化Figure 6 Change of ratio of carotenoid and chlorophyll of C.vulgaris in process of growth
2.4 热带普通小球藻生长过程中细胞密度、色素参数与颜色特征值的相关分析
在养殖周期10 d 内,热带普通小球藻的细胞密度、色素参数与L*、a*、H°均呈负相关,与b*、△E、C呈极显著正相关 (表1)。细胞密度与L*呈极显著负相关 (P<0.05),与其他颜色参数特征值呈极显著相关 (P<0.01);Caro/Chl 与H°呈极显著负相关 (P<0.01),而其他色素成分 (Chl-a、Chlb、总叶绿素、Caro) 质量浓度与H°呈显著负相关(P<0.05);色素成分质量浓度均与L*和a*呈极显著负相关 (P<0.01)。热带普通小球藻生长过程中,其色素成分质量浓度和Caro/Chl与L*、a*、b*、△E、C的相关系数绝对值介于0.91~0.98,而与H°的相关系数绝对值介于0.64~0.77。L*、a*、b*、△E、C与色素成分质量浓度、Caro/Chl 之间的相关性相对更高、更密切。

表1 热带普通小球藻生长过程中颜色参数与细胞密度、色素参数质量浓度的简单相关分析Table 1 Simple correlation analysis among color parameters and cell density,pigment contents of C.vulgaris in process of growth
2.5 热带普通小球藻生长过程中细胞密度、色素参数与颜色特征值的线性回归分析
在养殖周期10 d 内,热带普通小球藻L*、a*、b*、△E与细胞密度、绿色素、Caro、总色素质量浓度均具有显著线性相关关系 (P<0.05,表2)。其中Xa的回归系数绝对值最大;不同变量中的决定系数均大于0.90 (R2>0.90),代表回归方程拟合度较高,其中Caro 最高 (R2=0.973 1),其次为细胞密度值 (R2=0.971 6),而Chl-a最小 (R2=0.914 0)。

表2 热带普通小球藻生长过程中细胞密度、色素参数质量浓度与颜色参数的回归分析Table 2 Analysis of regression among cell density,pigment contents and color parameters of C.vulgaris in process of growth
3 讨论
微藻的培养按规模可分为一级保种培养、二级中等扩培和三级大规模培养;按培养系统可分为开放式培养系统 (开发最早、应用最为普遍)、半封闭式培养系统、封闭式培养系统 (较为现代化)。其中封闭式培养系统包含管道式生物反应器、机械搅拌式生物反应器、平板式光生物反应器、鼓泡式光生物反应器、气升式光生物反应器、浮式薄膜袋光生物反应器等多种形式,具有能够有效控制培养条件、控制污染、实现纯种培养、营养盐损失小等特点[1]。本研究所采用的培养方式是建立在二级中等扩培基础上的鼓泡式,严格控制接种量、营养盐水平和光照强度,因此研究结果可为后期热带普通小球藻的规模化培养提供可靠基础数据。微藻的培养生长周期可简单概括为接种期、快速生长期 (指数生长期)、稳定期和衰亡期,本研究条件下热带普通小球藻在养殖周期10 d 内符合该生长规律,在养殖第2 天便进入快速生长期,在第4 天接近最大生长值,是连续培养中作为生物饵料使用时的最佳采收时期,这与丁丽欢等[8]、葸玉琴等[15]的研究结果较为一致。
感官技术是把人作为精密测量仪器对产品进行感官检验的科学方法,如将视觉、触觉、嗅觉、味觉和听觉用于产品的测量和分析[16],但这种技术主观随意性大,会受到技术人员的认识程度等诸多因素的影响,从而难以满足精准化生产操作的要求[12]。微藻养殖过程中颜色的变化是其生理变化的宏观体现,也是确定采收及使用时间的主要外观指标之一。本研究在色度学理论基础上,利用色差仪对热带普通小球藻生长过程中的颜色变化进行指标量化测定,并分析了颜色变化与藻细胞浓度、色素质量浓度的相关关系,可提高养殖监测的科学性和准确性。本研究表明,在热带普通小球藻生长过程中,养殖水体颜色变化与藻类细胞密度和色素质量浓度变化规律具有较强的相关性 (相关系数在0.95 以上),具有规律性,因此可以通过测定颜色参数值来判定热带普通小球藻密度及色素质量,具有快速、准确、科学的特点。这与孟凡娟等[17]、Timothy 等[18]对番茄 (Solanum lycopersicum)、蔡鸿昌等[19]对黄瓜 (Cucumis sativusL.) 初花期叶片,以及于国锋等[20]对烟叶颜色的研究结果相似,因此颜色变化可应用于生物量与质的快速评价。
植物的颜色是其最显著的表观性状,取决于其所含色素种类、含量及相对含量,而色素的相对含量与种类、生长状态、生长条件等密切相关。色素是植物光合作用的基础,其浓度高低可反映植物功能的强弱[21-22]。热带普通小球藻生长过程中,绿色素 (Chl-a、Chl-b、总叶绿素) 和Caro 在快速生长期呈线性增长趋势,这与b*和△E变化趋势相似,因此可将b*和△E作为热带普通小球藻生长进程和色素质量的判断指标。此外,本研究通过建立线性回归方程,把热带普通小球藻生长过程中细胞密度、色素总含量与颜色参数值联系起来,从而通过无损失、无损伤的颜色参数值的变化来反映热带普通小球藻的生长情况和质量,达到了无接触性判断的目的,在一定程度上保障其不会因取样、检测等操作而被污染。在热带普通小球藻生长过程中总叶绿素、Caro、总色素质量浓度和b*、△E和C均呈增加趋势,而L*、a*、H°呈降低趋势。L*、a*、b*、△E与细胞数及色素质量浓度的线性回归模型拟合度较高,均达极显著水平,今后应在不同条件下对模型进行进一步验证和修正,使其具有更广泛的适用性和普遍的指导意义。
4 结论
综上,颜色参数值b*和△E的变化可有效指示热带普通小球藻生长过程中细胞密度及色素质量浓度的变化,特别是在快速生长期更为灵敏,可作为较佳的指示指标。该法可在一定程度上对微藻养殖过程进行非接触性动态变化监测,并为实现实时监测的定量化提供理论依据,具有快速、准确、科学的特点;然而,不同品种之间可能存在显著差异,因此需对在不同品种上的应用进行进一步实验和验证,从而提高该法应用的广泛性。
