脂肪因子Chemerin对骨代谢影响的研究进展
2021-02-27李军张婷李希
李军 张婷 李希
重庆医科大学生命科学研究院,重庆 400016
随着人们生活水平的提高和久坐不动生活方式的日益发展,肥胖人群在世界范围内逐年增加[1-2]。肥胖状态下伴随皮下脂肪和内脏脂肪增生、肥大,骨髓腔内脂肪也显著增加,导致骨髓腔内多种脂肪因子释放发生变化,如Leptin、Adiponectin等,多项研究[3-7]发现这些脂肪因子可正向或负向调控骨代谢。Chemerin也是一种脂肪因子,在循环中水平高于经典脂肪因子Leptin和Adiponectin,对全身以及局部免疫和代谢起到重要作用。临床病例对照研究[8]显示,血清Chemerin水平与骨密度呈现显著负相关。体外研究表明,Chemerin可以调控成骨细胞和破骨细胞分化。体内研究显示,Chemerin信号促进骨量增加以及减轻炎症水平,对于骨稳态的维持和代谢性骨病的发病机制研究具有重要作用(表1)。但是,关于Chemerin对骨代谢的研究仍以体外实验为主,并且缺乏系统总结。本文回顾近年Chemerin与骨代谢相关研究,探讨和总结Chemerin对骨代谢的作用和机制,以期寻求未来的研究方向及临床治疗靶点。
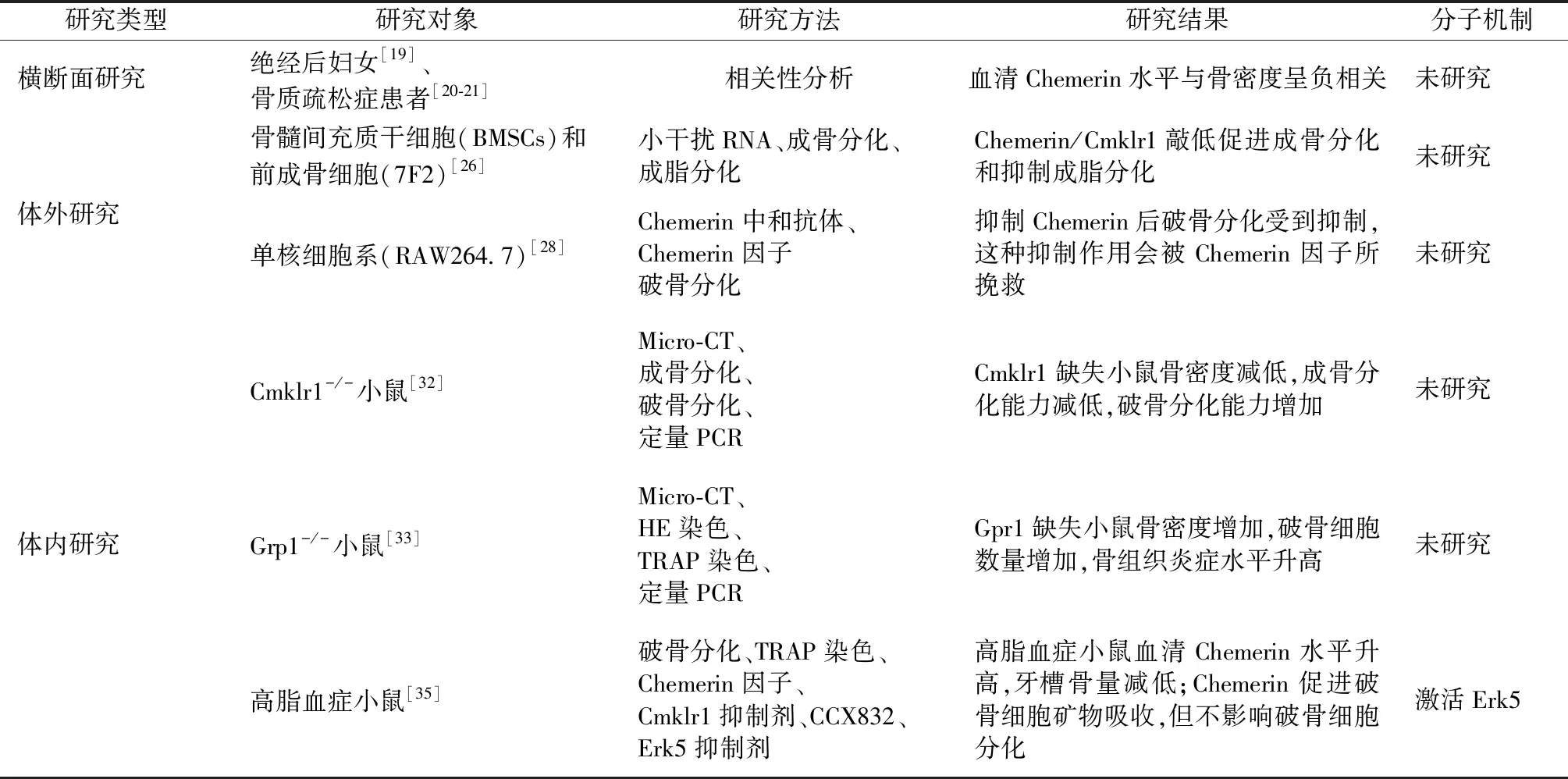
表1 脂肪因子Chemerin对骨代谢影响的研究Table 1 Effects of adipokine Chemerin on bone metabolism
1 脂肪因子Chemerin
Chemerin于2007年由Garalski等首次报道[9],又被称为维甲酸受体反应蛋白2(retinoic acid receptor response protein 2,Rarres2)和他唑罗汀诱导基因蛋白2(tazarotene induce gene protein 2,TIG2),它有三种受体:趋化因子样受体1(chemokine-like receptor 1,Cmklr1)、G蛋白偶联受体1(G-protein coupled receptor 1,Gpr1)和 C-C基序趋化因子样受体2(C-C motif chemokine receptor like 2,Ccrl2)[10]。Chemerin最初的合成形式是具有183个氨基酸的前体,随后氮端20个氨基信号肽截断形成非活性前体(chemerin-S163)释放到细胞外或循环中,经纤溶酶、弹性蛋白酶和组织蛋白酶G作用裂解碳末端5-9个氨基酸,形成具有活性的、与Cmklr1具有不同亲和力的各种异构体(chemerin-K158,-S157,-F156)[11]。研究[12-14]表明,Cmklr1 是Chemerin的功能性受体,主要由巨噬细胞、树突状细胞和自然杀伤细胞等免疫细胞表达,Chemerin通过Cmklr1受体可诱导这些细胞向炎症部位迁移,从而在免疫应答中发挥重要作用。Chemerin也可促进胰岛β细胞释放胰岛素,但抑制骨骼肌和脂肪组织胰岛素敏感性,从而调控全身以及局部葡萄糖代谢[15]。目前对Chemerin/Cmklr1信号通路的了解主要来自细胞系分析,并表明Cmklr1与Gαi/o信号通路相偶联,导致细胞内钙离子释放,抑制cAMP积累[16]。此外,Chemerin也可通过激活Erk、p38和Akt等信号通路在脂肪细胞分化[9]、内皮细胞血管生成[17]和软骨细胞增殖[18]过程中发挥重要作用。
2 人血清Chemerin水平与骨密度的关系
随着对Chemerin研究的不断深入,研究人员发现 Chemerin与骨密度具有密切相关性。一项基于多中心的大数据研究[8]分析了不同体质量指数人群血清Chemerin水平与BMD的关系,结果表明肥胖组循环Chemerin水平与骨量呈负相关,而正常组和超重组循环Chemerin水平与骨量无相关性。另一项对543名中国绝经后肥胖妇女血清Chemerin水平与股骨颈和腰椎骨密度相关性的研究[19]中发现,血清Chemerin水平与腰椎BMD呈负相关。王裕祥[20]对正常组和骨质疏松组各100例患者的血清Chemerin水平进行检测,也发现骨质疏松组患者的血清Chemerin水平更高,且两组血清Chemerin水平与股骨和腰椎骨密度均呈负相关。但是,Engin-Ustun Y等[21]通过骨密度将对象分为正常组和骨质疏松组后,对血清Chemerin水平进行检测,发现骨质疏松组血清Chemerin水平显著低于正常组。这些研究都提示Chemerin很可能在骨质疏松或者骨代谢的发生发展过程中发挥作用,但针对Chemerin对骨密度起到正向还是负向的调控作用尚无定论。
近年来,骨髓内脂肪组织(marrow adipose tissue,MAT)的概念越来越受到研究者们重视[22-23]。既往研究[24]表明,人体内MAT占骨组织体积的70 %(约1 kg)左右,而MAT也能像皮下脂肪组织一样发挥内分泌功能,分泌包括Leptin、Adiponectin在内的多种脂肪因子[25]。因此,基于既往结论相悖的研究结果,Chemerin通过内分泌作用对骨代谢的调控可能并不是主要作用。考虑到骨组织中丰富的MAT,Chemerin通过旁分泌对骨代谢的调节机制不容忽视。的确,Muruganandan S等[26]发现前成骨细胞系7F2和小鼠原代骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)都表达Chemerin基因,体外诱导两种细胞成脂分化过程中Chemerin表达逐渐上调,在人原代BMSCs培养基也检测到了Chemerin蛋白分泌[27]。另一项研究[28]在造血干细胞(hematopoietic stem cells,HSCs)、成骨细胞和破骨细胞培养基中都检测到了Chemerin蛋白表达。这些研究都说明,在骨组织中不管是MAT,还是成骨细胞、破骨细胞、BMSCs和HSCs都可表达Chemerin,Chemerin极有可能以自分泌或者旁分泌方式调控骨代谢。
3 Chemerin对成骨细胞的影响
间充质干细胞(mesenchymal stem cells,MSCs) 是一种具有多向分化潜能的细胞,能够分化形成包括成骨细胞、脂肪细胞、软骨细胞等在内的多种细胞[29-30]。研究[26]表明,Muruganandan S等利用小干扰RNA敲低Chemerin或其受体Cmklr1后,发现BMSCs成脂分化降低,成骨分化和矿物质沉积增加,说明在体外条件下Chemerin具有促进成脂、抑制成骨的作用。进一步研究[31]表明,Chemerin/Cmklr1信号可以通过抑制经典Wnt信号通路关键因子β-Catenin表达、细胞定位和转录活性从而调控间充质干细胞成骨和成脂的系谱定向。该研究还发现,Cmklr1是一种新型的Wnt信号响应基因,Wnt信号激活抑制Cmklr1表达,而Cmklr1表达上调会抑制β-Catenin表达和功能,二者以负反馈回路的形式调控Wnt信号的促成骨分化作用,从而调控BMSCs在成骨和成脂分化间的平衡。但是,Chemerin受体Cmklr1[32]和Gpr1[33]敲除小鼠成骨分化和骨密度均降低。这表明Chemerin信号在体内复杂环境下促进成骨,这与体外单纯细胞实验抑制成骨并不一致,考虑可能是由于体外实验环境过于单一,不能很好反映机体作为有机整体的微环境、系统激素以及能量状态等影响。当然,受体(Cmklr1和Gpr1)的敲除并不能完全代表Chemerin作用的缺失,因为研究[34]已经发现除Chemerin外,Gpr1的配体还有FAM19A1,Cmklr1的配体还有Resolvin E1[16],但是Chemerin仍然是这两个受体的主要配体。总之,Chemerin对成骨细胞的影响体内和体外实验尚不一致,未来需要更加系统的体内和体外实验予以明确,如构建BMSCs特异性敲除Chemerin小鼠。
4 Chemerin对破骨细胞的影响
研究[28]显示,HSCs能够表达Chemerin和Cmklr1基因,且在诱导原代HSCs向破骨细胞分化时Chemerin的表达上调。Chemerin中和抗体能够有效抑制HSCs的破骨分化和对矿物基质吸收,而额外添加Chemerin重组因子可以挽救破骨细胞分化的丧失,这表明Chemerin对于破骨细胞分化是必需的。该研究还显示,Chemerin的中和抗体使用减弱了RANKL(receptor activator of nuclear factor κB ligand,RANKL)对破骨细胞形成相关基因,如NFATc2、Fos、Igtb3和Src等的诱导作用。Ramos-Junior ES等[35]观察到高脂饮食喂养的肥胖小鼠和糖尿病小鼠(db/db)血清Chemerin水平升高,并且都合并有牙槽骨量丢失。深入研究发现,梯度Chemerin重组蛋白不会增加破骨细胞分化,但增加破骨细胞矿物吸收能力,并且两种小鼠牙槽骨中Chemerin、Cmklr1和破骨细胞标识基因Ctsk均上调,这种上调作用可以通过注射Cmklr1的抑制剂CCX832所阻断,表明Chemerin可以在小鼠体内通过作用于Cmklr1受体增强破骨细胞功能。此外,机制研究表明,Chemerin可激活Erk5磷酸化从而达到激活破骨细胞功能的作用。综合体内和体外实验表明,Chemerin对于破骨细胞分化或者破骨细胞矿物基质吸收具有促进作用。但是,针对Chemerin对破骨细胞的研究仍在起步阶段,其体内功能实验和分子机制尚未阐明,未来仍需深入研究。
5 Chemerin对骨髓腔微环境的影响
多项研究[26,36]都表明,Chemerin可以促进原代BMSCs向脂肪细胞分化,而骨髓内脂肪细胞与外周皮下脂肪和内脏脂肪一样具有分泌功能,可以分泌包括Leptin、Adiponectin、IL-6、M-CSF等多种因子,从而改变骨髓腔微环境,进而对骨稳态产生影响[25,37]。研究[3]发现,利用Prx-Cre重组酶条件性敲除小鼠BMSCs Leptin受体后,小鼠成骨增加、成脂减少以及骨折愈合加快,表明Leptin可以直接作用于BMSCs进而抑制成骨。同时,BMSCs中敲低Adiponectin可下调β-Catenin表达,进而降低成骨细胞分化和矿物沉积,延缓骨缺损修复[38]。M-CSF是调控HSCs向破骨细胞分化的关键因子之一[39],骨髓内脂肪细胞分泌M-CSF增加将明显影响破骨细胞形成。此外,Chemerin作为一种趋化因子,可以趋化免疫细胞募集,起到抗炎或者促进炎作用[13,40]。这表明,Chemerin在不同环境下根据机体情况发挥抗炎或者促炎作用,从而在免疫反应和炎症反应中发挥调控作用。传统脂肪因子Leptin还可作用于下丘脑摄食中枢通过影响摄食和交感神经从而间接调控骨代谢[4]。外周脂肪细胞分泌的Adiponectin以内分泌方式调控交感神经和胰岛素敏感性间接调控骨代谢[6]。Chemerin对骨稳态的调控主要依赖于其对骨髓间充质干细胞、成骨细胞和破骨细胞的直接调控,同时也可影响骨髓微环境。
6 总结
Chemerin作为肥胖与骨代谢之间的媒介,调控骨组织对全身能量代谢失衡响应。Chemerin对骨代谢的影响是一种综合作用的结果,它既可以调控BMSCs成骨和成脂分化的平衡,协调破骨细胞分化或破骨细胞矿物吸收能力,也可以改变骨髓腔微环境从而影响骨稳态[26,31-33]。骨髓内发挥作用的Chemerin主要来源于MAT,以自分泌或者旁分泌方式调控骨稳态(图1)[22-23]。但是目前仍缺失关于Chemerin作为代谢性骨病的独立预测因子和治疗靶点的研究,需要更加详细和系统的研究来明确Chemerin对骨代谢的影响及其在代谢性骨病中的作用。
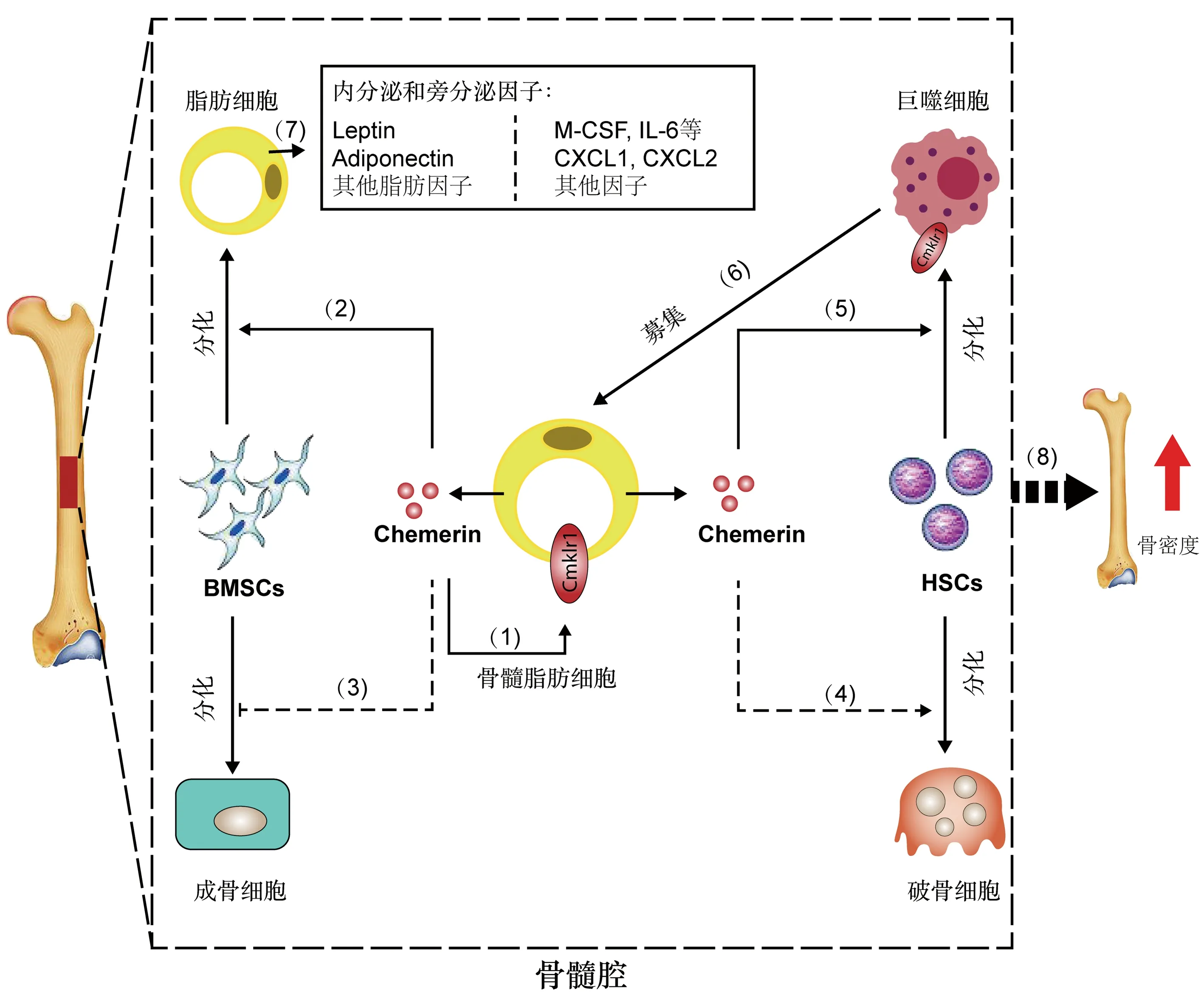
图1 脂肪因子Chemerin对骨代谢的影响Fig.1 Effects of adipokine Chemerin on bone metabolism
