盐摄入量对腹膜透析大鼠残余肾功能的影响
2021-02-27钟晓红蒋建平
康 瀚,王 羽,钟晓红,殷 伟,李 芳,蒋建平
南方医科大学1南方医院肾内科,2动物实验管理中心,广东 广州510515
在慢性肾脏病病人心脑血管事件发生、发展的众多危险因素中,残余肾功能(RRF)的减退是病人发生心脑血管事件的独立危险因素[1]。腹膜透析病人的残余肾功能对病人的预后起关键作用[2]。保护腹膜透析患者残余肾功能有利于控制容量负荷、减轻心室肥厚的严重程度、缓解机体炎症状态。有残余肾功能的腹膜透析病人食欲、膳食蛋白质和总热量摄取比较残余肾功能完全丧失的病人均有增强[3]。控制血压、减少尿蛋白、控制患者容量负荷以及使用肾素-血管紧张素-醛固酮系统阻滞剂,是目前公认的能延缓残余肾功能减退的重要手段[4]。
既往的研究提示高盐摄入可引起血压升高、水钠潴留、容量负荷增加[5],同时还进一步使肾血流量和肾小球的压力增加,加重残余肾单位高灌注[6],增加尿蛋白排泄量[7]。高盐的摄入使肾脏氧化应激活化[8],导致肾脏局部RAS系统活化[9-10],促进肾脏炎症、肾脏纤维化等多种病理改变,造成了肾脏进一步的损伤[11]。以Dah1盐敏感大鼠为实验对象的研究结果提示,低盐对残余肾脏纤维化的影响更小[12],支持上述理论。但有临床研究发现低盐的摄入可使腹膜透析患者的全因死亡率上升[13],钠摄入量与心血管病人死亡率呈负相关[14-16]。探索适合腹膜透析患者的摄盐量是非常必要的。
我们前期的临床研究结果提示,腹透患者残余肾功能的下降和摄钠量相关,高钠饮食可使残余肾功能下降更快[17]。但目前临床研究样本量不大,且缺乏深入的机制探索,本研究利用5/6肾切除的CKD大鼠腹膜透析模型,更精准地观察饮食中盐的摄入对腹膜透析大鼠残余肾功能的影响,并进一步探讨腹膜透析状态下盐对残余肾功能影响的可能机制。
1 材料和方法
1.1 动物
6~8周龄、体质量约为220~250 g的健康雄性SD大鼠[南方医科大学动物实验中心(SCXK(粤)2016-0041)],饲养在SPF环境中(SYXK(粤)2016-0167)。所有动物实验均经南方医科大学动物伦理委员会批准。
1.2 分组
36只SD大鼠随机分为2组,每组18只,一组为腹膜透析组(慢性肾衰+规律腹膜透析),一组为对照组(慢性肾衰未腹透组),每组再根据所喂含0.02%NaC1、0.4%NaC1、4%NaC1的饲料,分为3个亚组,每个亚组各6只,分别为:规律腹膜透析+低盐饮食(0.02%NaC1)、规律腹膜透析+正常盐饮食(0.4%NaC1)、规律腹膜透析+高盐饮食(4%NaC1)、慢性肾衰+低盐饮食(0.02%NaC1)、慢性肾衰+正常盐饮食(0.4%NaC1)、慢性肾衰+高盐饮食(4%NaC1)组。
1.3 动物模型的建立
采用5/6肾切除的方法建立SD大鼠慢性肾衰竭(CRF)的模型[18]。SD大鼠适应性喂养5 d后行5/6肾切除,术后第8 周对腹透组大鼠行腹透管植入术[19]。腹透组大鼠5/6 肾切除第9 周开始给予腹膜透析治疗,腹膜透析方案:每次以2.5%的低钙葡萄糖腹透液10 mL/100 g腹腔内注入,每次留腹4 h,透析3次/d,夜间不留腹。
1.4 标本的采集
分别于5/6肾切除术8周后和12周后使用大鼠代谢笼采集24 h尿液,记录尿量后取样1 mL尿液标本冻存。使用剪尾法采集血液标本,4 ℃静置6 h后,4 ℃离心(3000 r/min,10 min),取上清冻存。腹膜透析治疗4周后采集腹透流出液标本。5/6肾切除术12周后戊巴比妥麻醉处死大鼠,取肾脏组织用于石蜡包埋和制备肾皮质匀浆。
1.5 肌酐和钠浓度的测定
用自动化学分析仪(AU480;Beckman Cou1ter)测量采集的血清、尿液和腹透流出液的肌酐、钠浓度。
1.6 肾纤维化的评估
大鼠取残余肾脏固定于10%福尔马林中24 h后,进行石蜡包埋。制成2 μm 厚切片进行马森三色染色(Masson 染色)和高碘酸-希夫染色(PAS 染色),使用Image pro p1us进行半定量分析评估肾小球硬化指数[18]和间质纤维化分级评分[20]。
1.7 RAS的表达和活性
采用Western B1ot 分析方法,使用抗AGT(IBL,JP28101)、抗ACE-1(abcam,ab11734)、抗AT1 受体(abcam,ab18801)检测肾皮质匀浆中RAS组分的水平。
1.8 统计分析
使用SPSS 22.0统计软件进行分析处理。符合正态分布的计量资料用均数±标准差形式表示。采用配对样本t检验对透析治疗前后生化指标进行比较;采用两独立样本t检验对腹透组和对照组间进行比较;腹透组和对照组组内不同盐饮食亚组间对比分析采用单因素方差分析(ONE-WAY ANOVA),组间两两对比采用LSD-t检验。对于等级资料、不符合正态分布或符合正态分布但方差不齐的计量资料,则采用非参数的检验方法。相关性分析使用Spareman相关性分析。均以P<0.05为差异有统计学意义。
2 结果
2.1 不同盐饮食对大鼠血肌酐的影响
大鼠5/6肾切除8周后,腹透组和对照组血肌酐浓度无明显差异(P=0.856)。12周后,透析组大鼠血肌酐较8周后无明显差异(P=0.939),而对照组大鼠血肌酐明显高于8周后(P=0.004);对照组血肌酐浓度明显大于腹透组(P=0.023,表1)。
在腹透组大鼠中,5/6肾切除8周后,给予高盐、正常盐和低盐喂养的大鼠血肌酐未见明显差异(P=0.588),透析前后血肌酐变化幅度也未见显著差异(P=0.196)。对照组三个亚组中的大鼠血肌酐均出现不同程度的上升,且摄盐量越大,上升越明显。同样喂以高盐饮食,腹透组大鼠血肌酐上升幅度小于对照组大鼠(P<0.05);正常盐喂养的大鼠,腹透组血肌酐上升幅度与对照组无显著差异(P=0.207);低盐喂养的大鼠,腹透组血肌酐上升幅度明显小于对照组大鼠(P<0.05,表2)。
通过残余肾肌酐清除率的分析发现,腹透治疗组中,给与高盐、正常盐和低盐喂养的大鼠肌酐清除率均出现了不同程度的下降(P=0.092),高盐摄入组下降趋势明显,尤其较低盐摄入组大鼠下降幅度更大(P=0.040)。对照组各组大鼠肌酐清除率也出现了不同程度下降(P=0.028),摄盐量越大,肌酐清除率下降幅度越大。同样喂以高盐饮食,腹透组大鼠肌酐清除率下降幅度小于对照组(P=0.047);无论正常盐或低盐喂养的大鼠,腹透组肌酐清除率下降幅度与对照组相比无显著差异(P=0.057,P=0.589,表2)。

表1 5/6肾切除8周和12周后腹透组和对照组大鼠血肌酐、尿肌酐、肌酐清除率及大鼠质量的比较Tab.1 Serum creatinine, urinary creatinine, creatinine clearance rate, and body mass of the rats in peritoneal dialysis group and control group at 8 and 12 weeks after 5/6 nephrectomy(Mean±SD)
2.2 不同盐摄入大鼠残肾病理的变化情况
无论是腹透组还是对照组,高盐摄入组大鼠肾小管间质纤维化和肾小球硬化程度均比低盐摄入组和正常盐摄入组大鼠重。腹透组中,低盐摄入组大鼠和正常盐摄入组大鼠肾小管间质纤维化和肾小球硬化程度无明显差异(P>0.5)。对照组中,低盐摄入组大鼠肾小管间质纤维化和肾小球硬化程度最低,正常盐摄入组次之,高盐摄入组最重。同样喂以高盐饮食,腹透组大鼠肾小管间质纤维化和肾小球硬化程度明显轻于对照组大鼠(P<0.05)。正常盐喂养的大鼠,腹透组肾小管间质纤维化和肾小球硬化程度与对照组无显著差异(P=0.553,P=0.311);低盐喂养的大鼠,腹透组肾小管间质纤维化程度与对照组无显著差异(P=0.063),而肾小球硬化程度重于对照组(P<0.05,图1)。
2.3 不同盐摄入大鼠血压的变化情况
大鼠5/6肾切除8周后,对照组与腹透组相比,收缩压(SBP)和舒张压(DBP)未见明显差异(P>0.05)。12周后,对照组大鼠SBP和DBP明显高于腹透组大鼠(P<0.05);对照组大鼠SBP和DBP上升幅度大于腹透组大鼠(P<0.05)。腹透组大鼠中,给予低盐和正常盐喂养的大鼠SBP和DBP变化无显著差别(P>0.05),高盐摄入大鼠SBP和DBP较正常盐摄入组大鼠明显升高(P分别为0.004和0.048)。高盐饮食喂养的大鼠中,腹透组大鼠与对照组大鼠相比,两组大鼠SBP上升幅度未见明显差异(P>0.05),而腹透组大鼠DBP则明显低于对照组(P=0.000,图2)。
2.4 盐摄入对肾脏RAS表达的影响
取大鼠残肾皮质组织进行蛋白印迹法,观察肾脏局部RAS组分表达的变化情况。腹透组大鼠中,与正常盐摄入组大鼠相比较,高盐摄入组大鼠肾脏局部的血管紧张素原(AGT)、血管紧张素-1(ACE-1)和血管紧张素II 1型受体(AT-1)表达水平更高(P<0.05);而低盐摄入组大鼠与正常盐摄入组大鼠肾脏局部AGT、ACE-1和AT-1表达水平无显著差异(P>0.05)。对照组大鼠中,摄盐量越大大鼠肾脏局部RAS组分AGT、ACE-1、AT-1表达水平越高。同样在高盐饮食喂养下,与对照组大鼠相比,腹透组大鼠残余肾AGT、ACE-1表达量有减少的趋势(P<0.05);正常盐喂养的大鼠,腹透组AGT表达量与对照组无显著差异(P=0.190),ACE1、AT-1明显低于对照组(P<0.05);低盐喂养的大鼠,腹透组AGT、ACE1表达量与对照组无显著差异(P=0.977,P=0.699),而AT-1的表达水平明显高于对照组(P<0.05,图3)。
2.5 大鼠对钠的清除
腹透组大鼠中,低盐摄入组和正常盐摄入组大鼠在5/6肾切除12周后24 h尿钠排泄量较8周后出现明显降低(P<0.05);而高盐摄入组大鼠24 h尿钠排泄量则出现明显增加(P<0.05,图4A)。对照组大鼠中,24 h尿钠排泄量情况与腹透组大鼠相似。经12 h腹透后,低盐喂养的大鼠经腹透净排钠量为-2.03±2.54 mmo1,正常盐喂养的大鼠为0.56±1.24 mmo1,高盐喂养的大鼠为4.83±2.07 mmo1(图4B)。12周后,低盐喂养的腹透大鼠钠排泄总量为负值,这于对照组大鼠不同(P<0.05);正常盐喂养的大鼠,腹透组总钠排量与对照组大鼠无显著差异(P=0.685);同为高盐饮食喂养,腹透组大鼠总排钠量明显高于对照组大鼠(P<0.05,图4C)。
2.6 大鼠钠排泄总量与摄钠量、血压变化、肾脏RAS表达相关性分析
对大鼠摄钠量与钠排泄总量、血压变化、肾脏RAS表达水平进行相关性分析发现:钠的摄钠量与总排泄量、SBP变化幅度、DBP变化幅度呈正相关;钠的摄钠量与ACE-1、AGT、AT-1表达量存在正相关(表3)。
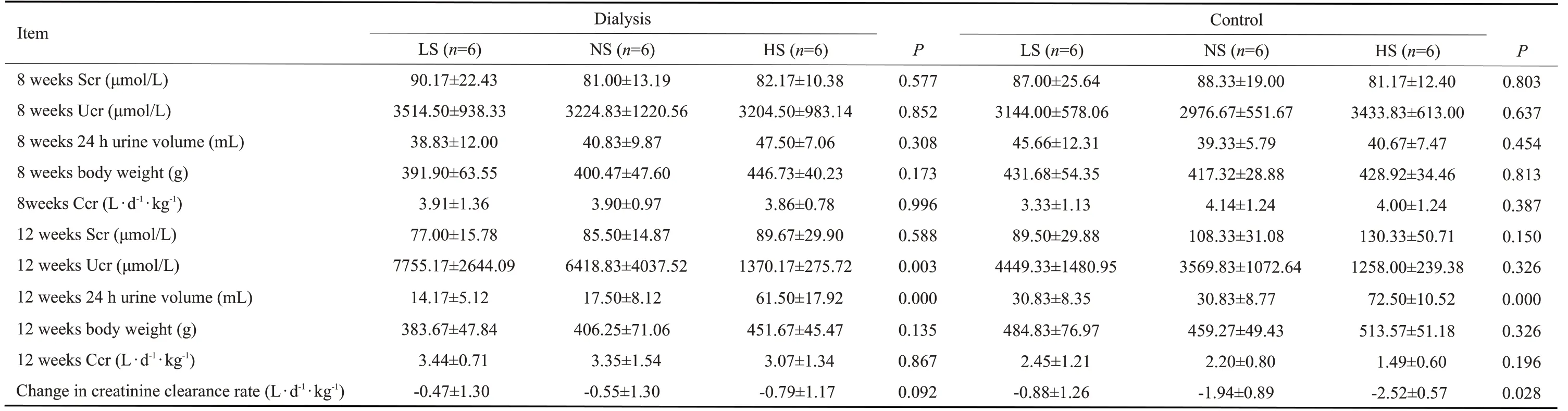
表2 5/6肾切除8周和12周后各组大鼠血肌酐、尿肌酐、尿量、肌酐清除率及大鼠质量的对比Tab.2 Serum creatinine,urinary creatinine,creatinine clearance rate,and body mass of the rats in peritoneal dialysis group and control group at 8 and 12 weeks after 5/6 nephrectomy(Mean±SD)
高盐饮食喂养的12只大鼠(对照组6只,腹透组6 只)中,钠的总排泄量与DBP 变化幅度、AGT 表达水平存在负相关(r=-0.797,P=0.002;r=-0.636,P=0.026);与SBP 变化幅度、ACE-1 和AT-1 表达水平未见显著相关性(r=-0.531,P=0.075;r=-0.382,P=0.221;r=-0.466,P=0.126)。
3 讨论
本研究实验结果提示,无论慢性肾衰未透析或行腹膜透析治疗的大鼠,高盐的摄入均使大鼠残余肾功能下降加速。同时,本研究首次发现,腹膜透析治疗的大鼠,低盐摄入和正常盐摄入对大鼠血压、残余肾功能的影响程度类似,这与慢性肾衰未透析大鼠盐摄入量与血压的升高、残余肾功能下降呈正相关不同。
肾脏纤维化是CKD进展为ESRD的共同途径[21-23]。通过对实验大鼠肾组织片染色观察,我们发现在未透析的慢性肾衰大鼠中,不同含盐量饲料喂养的大鼠,肾小球硬化和肾小管间质纤维化程度存在差异,高盐摄入组明显更重,这与既往的实验结论一致[12]。腹透组中,高盐饮食仍明显促进肾脏纤维化的进展;但低盐摄入和正常盐摄入的大鼠肾小球硬化指数和肾小管间质纤维化评分并无明显差异,两者肾脏结构改变程度相当,与残余肾肌酐清除率下降水平相符合,这是本研究的首次发现,但其机制并不明了。
肾脏通过一系列复杂的调节机制来精确地控制水、钠平衡[24-25]。本实验对大鼠残肾和腹膜24h钠清除情况进行了观察。残余肾脏和腹膜对大鼠体内钠平衡的调节都起到了重要作用。对照组大鼠通过残肾进行钠排泄,随着大鼠摄钠量的增加钠排泄量也相应增加。腹透组大鼠能通过残肾和腹膜两种途径进行钠清除,随着大鼠摄钠量的增加,残肾的钠排泄量随之增加;但低盐饮食的大鼠腹透液净排钠量为负值,其经腹膜透析获得的钠补充;而正常盐和高盐饮食的大鼠,随摄钠量的增加,经腹膜透析排钠量也相应升高。通过计算总排钠量,我们发现同样给予高盐饮食喂养,腹透组大鼠排钠量明显高于对照组;同样给予低盐饮食,对照组大鼠排钠量极少,而腹透组大鼠总排钠量呈负值,腹膜透析的钠反向进入了体内补充了大鼠钠摄入的不足。这提示腹膜透析通过调节机体钠的平衡,或弥补钠摄入不足或协助排钠减缓了高盐饮食对大鼠残余肾脏的不利影响。从病理改变的结果看,同样给与高盐饮食喂养,腹透组大鼠肾小球硬化和肾小管间质纤维化程度明显较对照组大鼠轻,腹膜透析一定程度上缓解了高盐饮食对CKD大鼠纤维化的影响。这提示体内钠平衡对残余肾功能可能存在影响。
不同盐饮食通过影响血压、容量负荷、肾脏局部RAS的激活等多种方式对残余肾功能产生影响。高血压是盐影响残余肾功能的主要途径之一[26]。CKD大鼠盐摄入量越大,大鼠血压升高幅度也越大。本研究对慢性肾衰大鼠摄钠量的分析,发现摄钠量与SBP和DBP变化幅度存在显著相关,随着摄钠量的增加,SBP 和DBP随之升高,对肾脏造成的损伤也越重,这与以往研究结论一致[12]。但在接受腹膜透析治疗的慢性肾衰大鼠,高盐饮食使大鼠SBP和DBP上升幅度明显大于低盐摄入组和正常盐摄入组大鼠;但由于通过腹膜透析能补给低盐摄入大鼠的摄钠不足,使得低盐摄入组大鼠和正常盐摄入组大鼠SBP和DBP变化幅度无明显差异。这在以往的研究中并未见报道。这种现象可能仍与体内钠平衡有关。
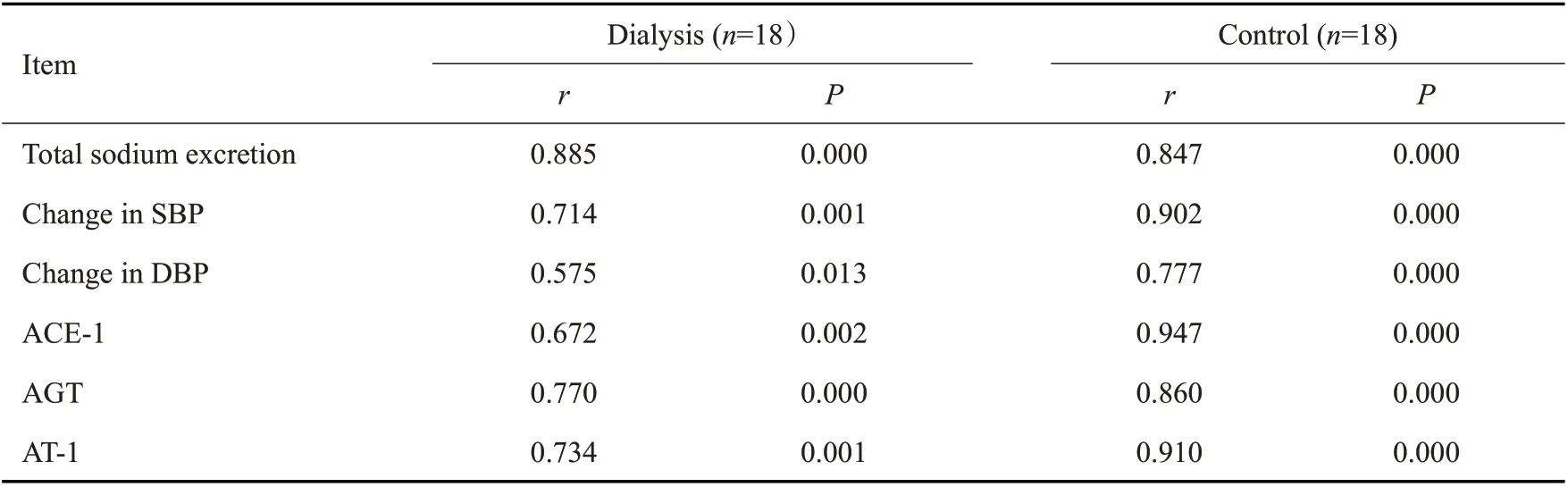
表3 大鼠摄钠量与钠排泄总量、血压变化、RAS表达相关性分析Tab.3 Correlation between sodium intake and total sodium excretion, changes of blood pressure, and renal RAS expression in the rats
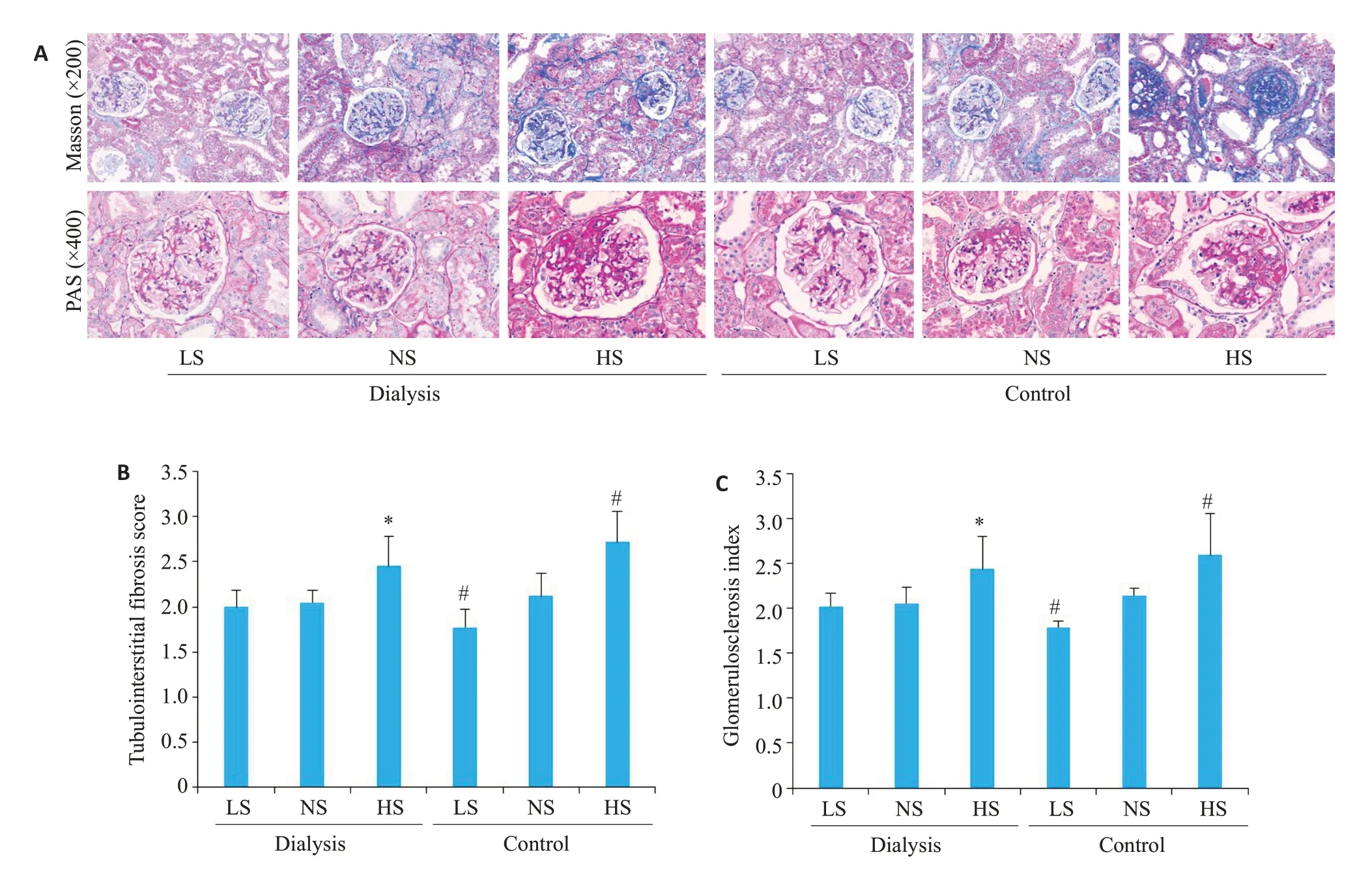
图1 大鼠肾组织肾小管间质纤维化和肾小球硬化情况Fig.1 Renal tubulointerstitial fibrosis and glomerular sclerosis in rat renal tissue.A:Masson staining and PAS staining of rat renal tissue. B: Tubulointerstitial fibrosis scoreof rat renal tissue. C: Glomerulosclerosis index of rat renal tissue. *P<0.05, low or high salt intake group versus normal salt intake group in peritoneal dialysis group;#P<0.05,low or high salt intake group vs normal salt intake group in the control group.PAS:Periodic acid-Schiff.
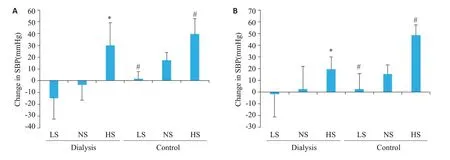
图2 大鼠血压变化Fig.2 Change in SBP (A) and DBP (B) of the rats. *P<0.05, low or high salt intake group vs normal salt intake group in peritoneal dialysis group;#P<0.05, low or high salt intake group vs normal salt intake group in the control group.SBP:Systolic blood pressure.DBP: Diastolic blood pressure.
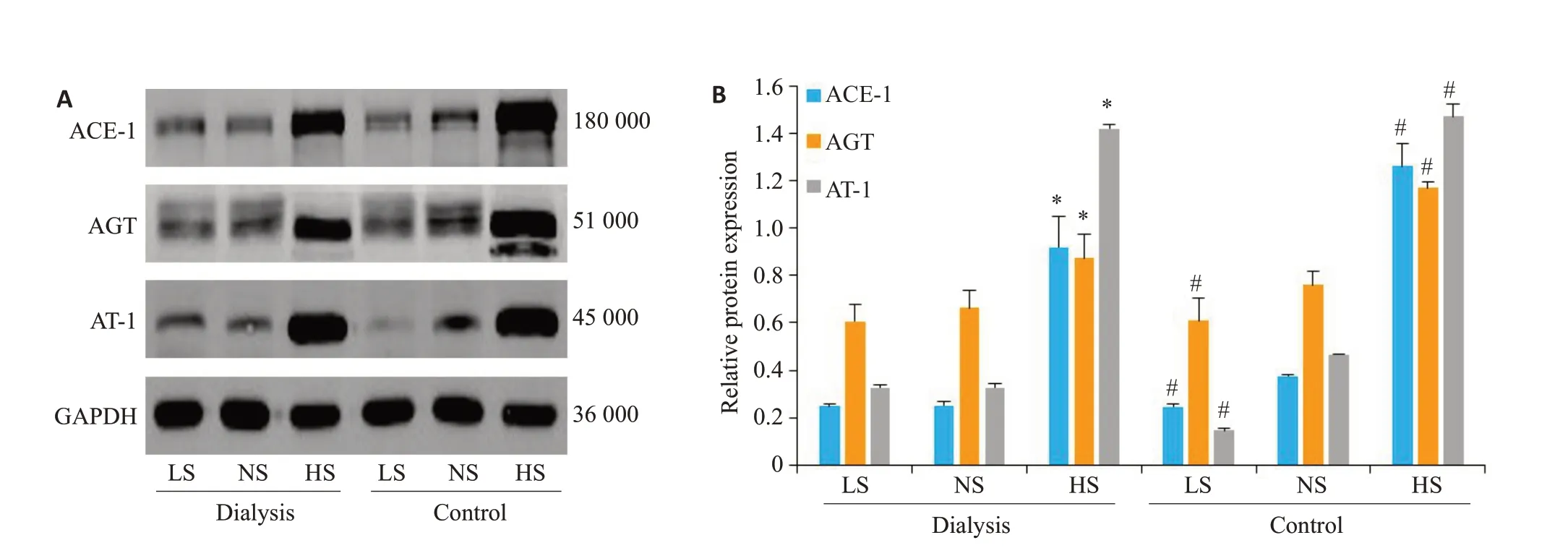
图3 大鼠肾脏AGT、ACE-1、AT-1 Western b1ot检测和蛋白表达定量Fig.3 Western blot analysis of AGT, ACE-1, and AT-1 in the renal tissues of the rats (A) and quantitative assessment of protein expressions (B). *P<0.05, low or high salt intake group vs normal salt intake group in the peritoneal dialysis group;#P<0.05,low or high salt intake group vs normal salt intake group in the control group.
肾脏局部RAS的激活是加速残余肾功能下降的重要机制,其参与肾脏炎症[27]和纤维化的进程[28],有报道指出肾脏ACE活性的升高可用于预测大鼠肾脏疾病模型的肾脏损伤[29]。同时肾脏局部RAS的激活使得转化生长因子—β1 mRNA和蛋白表达增加[6,30],介导肾脏纤维化的发生。阻断肾脏RAS的激活能有效减轻肾脏纤维化[31],通过适当控制钠的摄入能减轻肾内RAS的激活表达[32]。我们的研究中发现:CKD大鼠肾脏RAS组分AGT、ACE-1和AT-1的表达水平随摄钠量的增加而增加。无论是腹透组还是CRF未腹透组,高盐喂养4周后肾脏局部RAS组分如AGT、ACE-1和AT-1表达均明显增高。但同为高盐饮食饲养条件下,腹透组大鼠肾脏局部AGT、ACE-1表达量却比对照组有所减少。通过对高盐摄入组大鼠钠总排泄量与AGT表达水平之间相关分析发现,两者存在显著负相关关系(r=-0.636,P=0.026),推测这可能与高盐摄入的腹透组大鼠钠总排泄量大于对照组大鼠有关。腹透组中,低盐摄入的大鼠肾脏AGT、ACE-1和AT-1表达量与正常盐喂养的大鼠无差异,其机制目前尚不清楚,这种现象可能仍与腹透维持体内钠平衡存在一定的关联。
总之,在腹透大鼠和慢性肾衰未透析大鼠中,高盐饮食的摄入均促使肾脏RAS系统激活,血压升高,肾纤维化加重,加速大鼠残余肾功能下降。腹膜透析通过对钠的清除,部分减轻了高钠饮食对慢性肾衰大鼠残余肾功能的损伤。
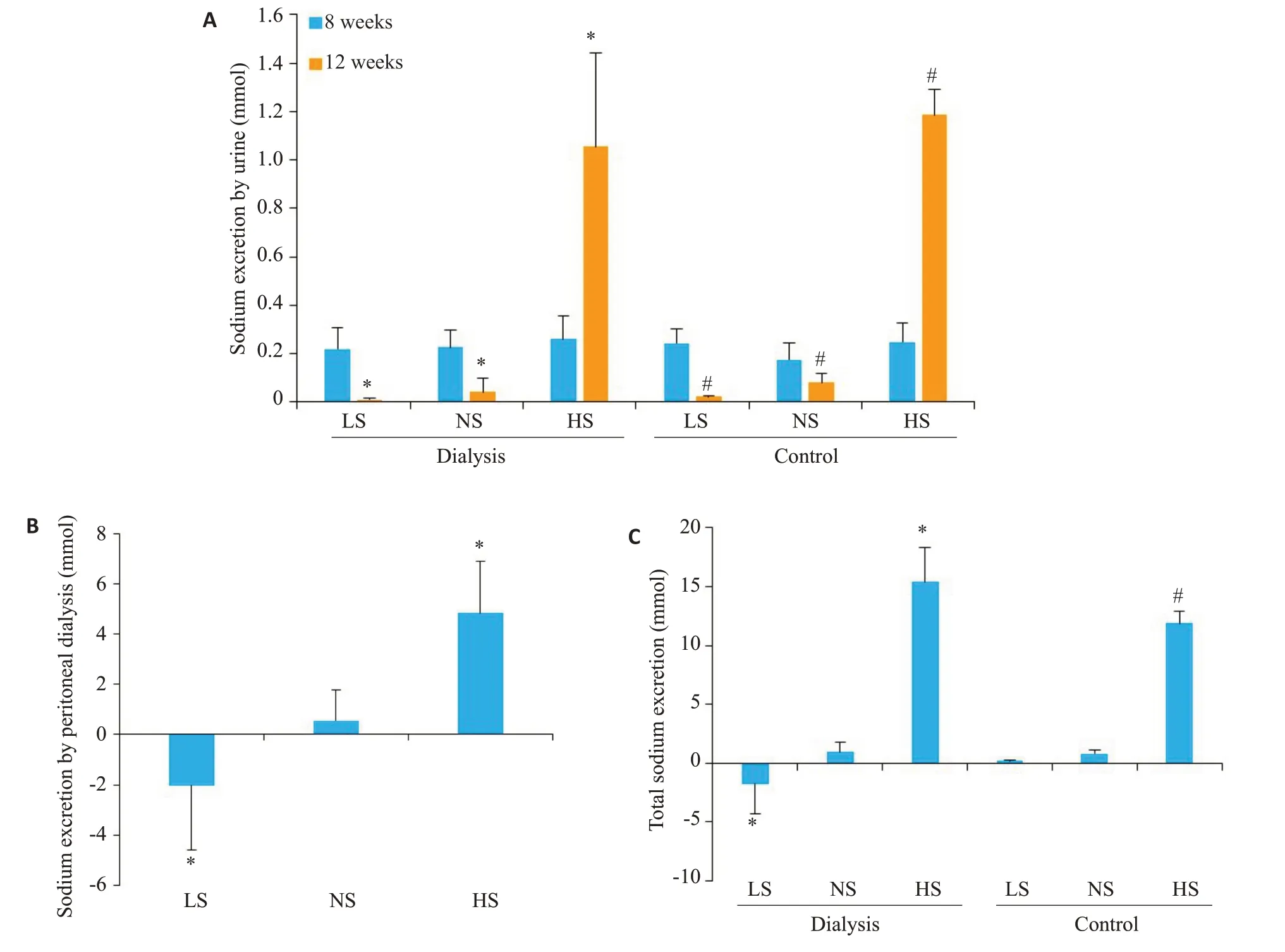
图4 大鼠钠清除的情况Fig.4 Sodium excretion of rats. (A) Sodium excretion by the urine. *P<0.05, 12 weeks vs 8 weeks inperitoneal dialysis group;#P<0.05, 12 weeks vs 8 weeks in the control group. (B) Sodium excretion by peritoneal dialy sisafter 12 weeks.*P<0.05, loworhigh salt intake group vs normal salt intake group in peritoneal dialysis group;#P<0.05, loworhigh salt intake group vs normal salt intake group in the control group. (C) Total sodium excretion after 12 weeks. *P<0.05,loworhigh salt intake group vs normal salt intake group inperitoneal dialysis group;#P<0.05, loworhigh salt intake group vs normal salt intake group in the control group.
