miR-600通过抑制HIF-1α信号通路降低宫颈癌细胞的增殖能力
2021-02-27周晓霞王嘉佳
周晓霞,邓 洁,张 维,王嘉佳
1成都市第二人民医院妇产科,四川 成都610000;成都医学院附属第一医院2妇产科,3呼吸内科,四川 成都610000;4重庆医科大学附属第二医院风湿免疫科,重庆400010
宫颈癌是最常见的妇科恶性肿瘤之一,在我国其发 病率仅次于乳腺癌位居第2[1-2],在世界范围内位居第3[3-4]。流行病学研究发现中国的宫颈癌的发病率和死亡率分别为7.5和3.4每10万人,同时HPV的感染率约为16.8%[4]。miRNA属于非编码小RNA类,其主要通过转录后调控机制靶向调控基因的表达。近期,研究发现miR-600对部分恶性肿瘤如直肠癌和非小细胞肺癌的增殖和分化具有重要的调控作用。实验证实上调miR-600的表达可有效抑制直肠肿瘤细胞和非小细胞肺癌细胞的增殖、分化和转移过程[5-6]。进一步研究显示miR-600主要通过下调低氧诱导因子-1α(HIF-1α)信号通路抑制非小细胞肺癌A549细胞的增殖和分化[6]。但miR-600对于宫颈癌生物学特征的影响尚不清楚。因此,在本研究中将采用miR-600 mimic 和P1asmid-HIF-1α转染HeLa 细胞诱导miR-600 和HIF-1α的表达,探讨miR-600对于宫颈癌细胞系HeLa细胞增殖和分化的调控作用,以及其潜在的信号通路和分子机制。
1 材料和方法
1.1 研究对象
HeLa细胞株由中国科学院上海细胞库提供;MTT试剂盒(Promega);鼠抗人HIF-1α抗体、鼠抗人VEGF抗体、鼠抗人Cyc1in D1 抗体和鼠抗人β-actin 抗体(Santa Cruz);miR-NC(空白miR,作为miR-600 mimic的 阴 性 对 照)、miR-600 mimic、P1asmid-NC(空 白P1asmid,作为P1asmid-HIF-1α的阴性对照)和P1asmid-HIF-1α(上海吉玛制药技术有限公司);DMEM培养基(Gibco);Lipofectamine 2000(Invitrogen);RNA提取试剂盒和qPCR试剂盒(Qiagen);其余试剂均为分析纯。
1.2 细胞培养
根据本实验室既往研究方法培养HeLa细胞[7]。简介如下,HeLa细胞常规接种在含10%胎牛血清,100 g/L青霉素、100 g/L链霉素的RPMI 1640 培养液中,置于37 ℃,5%CO2,孵箱内培养。每48 h换液、传代1次,取对数生长期细胞用于实验。第1步:实验时利用Lipofectamine 2000 将终浓度为50 nmo1/L 的miR-NC(miR-NC对细胞任何miR无影响,作为miR-600 mimic的对照)、miR-600 mimic(增加细胞miR-600 表达)、P1asmid-NC(P1asmid空载体,不改变细胞任何基因的表达,作为P1asmid-HIF-1α的对照)和P1asmid-HIF-1α(诱导细胞HIF-1α表达)对细胞进行转染。在转染(干预)6 h后先使用台盼蓝(Trypan B1ue)染色观察细胞后,收集细胞,分离mRNA 和蛋白进行qPCR 和Western b1ot 检测。第2 步:检测细胞在转染P1asmid-HIF-1α 6 h 后HIF-1α的表达水平。将细胞分为Contro1组、P1asmid-NC 组(转染P1asmid-NC)和P1asmid-HIF-1α组(转染P1asmid-HIF-1α)。在转染6 h 后收集细胞,对HIF-1α mRNA和蛋白水平采用qPCR和Western b1ot检测,明确P1asmid-HIF-1α对HeLa细胞HIF-1α表达的影响。因为miR-600 mimic是miR-600的拟似物故无需使用qPCR进行检测。第3步:将细胞分为4组:Contro1组(空白对照组,无特殊处理)、miR-600 mimic组(转染miR-600 拟似物miR-600 mimic 增加细胞miR-600 水平)、P1asmid-HIF-1α组(P-HIF-1α组,转染P1asmid-HIF-1α上调细胞HIF-1α表达)和miR-600 mimic+P1asmid-HIF-1α组(miR-600 mimic+P-HIF-1α组,同时转染miR-600 mimic 和P1asmid-HIF-1α增加细胞miR-600 水平和HIF-1α表达)。在干预(给予miR-600 mimic和/或转染P1asmid-HIF-1α)0 h、6 h、24 h和48 h后使用台盼蓝(Trypan B1ue)染色观察细胞。同时,收集转染6 h后的细胞,分离mRNA和蛋白进行qPCR和Western b1ot检测。以探讨HeLa 细胞中miR-600 对于HIF-1α、Cyc1in D1 和VEGF表达的影响。
1.3 MTT法检测细胞活性
取对数生长期细胞消化制成单细胞悬液,接种于96孔培养板中,每孔接种100 μL约含5×103细胞。使用MTT比色试验对转染后不同时间点(0 h、6 h、24 h、48 h)的细胞生长状态进行测定,实验重复5次。细胞活性(%)=(A干预组/A对照组0 h)×100(%)[7-8]。
1.4 qPCR法检测细胞中血管内皮生长因子、Cyc1in D1和HIF-1α mRNA表达检测
干预6 h后,按照qPCR试剂盒说明书提取细胞总RNA。β-actin作为内参照。引物:VEGF正义5'-TACC TCCACCATGCCAAGTG-3',反 义5'-ATGATTCTGC CCTCCTCCTTC-3';Cyc1in D1 正义5'-CGTGGGCTC TAAGATGAAGG-3',反义5'-TGCGGATGATCTGTT TGTTC-3';HIF-1α正义5'-CGTTCCTTCGATCAGTT GTC-3',反义5'-TCAGTGGTGGCAGTGGTAGT-3';βactin 正义:5'-CATGTACGTTGCTATCCAGGC-3',反义:5'-CTCCTTAATGTCACGCACGAT-3'。按照试剂盒说明书介绍进行反转录和扩增实验。使用2-ΔΔCt法对目标mRNA表达水平进行测定,ΔΔCt=(Ct,目标−Ct,内参照)干预组-(Ct,目标−Ct,内参照)对照组[9-10]。
1.5 Western b1ot 法检测细胞中VEGF、Cyc1in D1 和HIF-1α蛋白表达
干预6 h后,按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1 h,分别加入鼠抗人单克隆抗体VEGF(1∶1200)、Cyc1in D1(1∶1000)、HIF-1α(1∶1000)和β-actin(1∶1000),4 ℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.6 统计学方法
计量资料以均数±标准差表示。采用SPSS 22.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 细胞转染miR-NC、miR-600 mimic、P1asmid-NC和P1asmid-HIF-1α 6 h对于HeLa细胞活性的影响
细胞转染miR-NC、miR-600 mimic、P1asmid-NC和P1asmid-HIF-1α 6 h后使用MTT法分析HeLa细胞的活性(表1)。与空白对照相比较,给予miR-NC、miR-600 mimic、P1asmid-NC和P1asmid-HIF-1α 4种试剂干预HeLa细胞6 h后细胞活性无显著差异(P均>0.05),各组细胞形态无明显差别(图1)。因此,选取干预6 h作为检测HIF-1α、Cyc1in D1和VEGF表达的时间点,以消除因为细胞数量不同而产生基因表达差异的情况。

表1 miR-600 mimic和P1asmid-HIF-1α转染6 h对于HeLa细胞活性的影响Tab.1 Effects of miR-600 and Plasmid-HIF-1α overexpression on viability of HeLa cells at 6 h(n=5,Mean±SD)
2.2 P1asmid-HIF-1α对HeLa细胞HIF-1α表达的影响
为明确P1asmid-HIF-1α转染细胞6 h后对于HIF-1α表达的影响。将细胞分为对照组、P1asmid-NC组和P1asmid-HIF-1α组。在转染6 h后与空白对照组(对照组)相比较,P1asmid-NC组HIF-1α表达无明显差异(P均>0.05),P1asmid-HIF-1α组HIF-1α表达明显增加(P<0.05,图2)。
2.3 转染6 h、24 h和48 h对于HeLa细胞活性的影响
在转染6 h后与对照组比较,miR-600 mimic组、PHIF-1α组和miR-600 mimic+P-HIF-1α组细胞活性无显著差异(P均>0.05),且各组细胞形态无明显差别(表2、图3)。在转染24 h和48 h,与对照组相比较,miR-600 mimic组细胞活性呈时间依赖性下降,P-HIF-1α组和miR-600 mimic+P-HIF-1α组细胞活性呈时间依赖性增加,且P-HIF-1α组较miR-600 mimic+P-HIF-1α组细胞活性时间依赖性增加更加显著(P均<0.05,表2)。
2.4 转染6 h对于HeLa细胞VEGF、Cyc1in D1和HIF-1α表达的影响

图1 对照组、miR-NC组、miR-600 mimic组、P-NC组和P-HIF-1α组6 h HeLa细胞形态Fig.1 Morphology of HeLa cells in control,miR-NC,miR-600 mimic,P-NC,and P-HIF-1α groups at 6 h after transfection(Original magnification:×400).

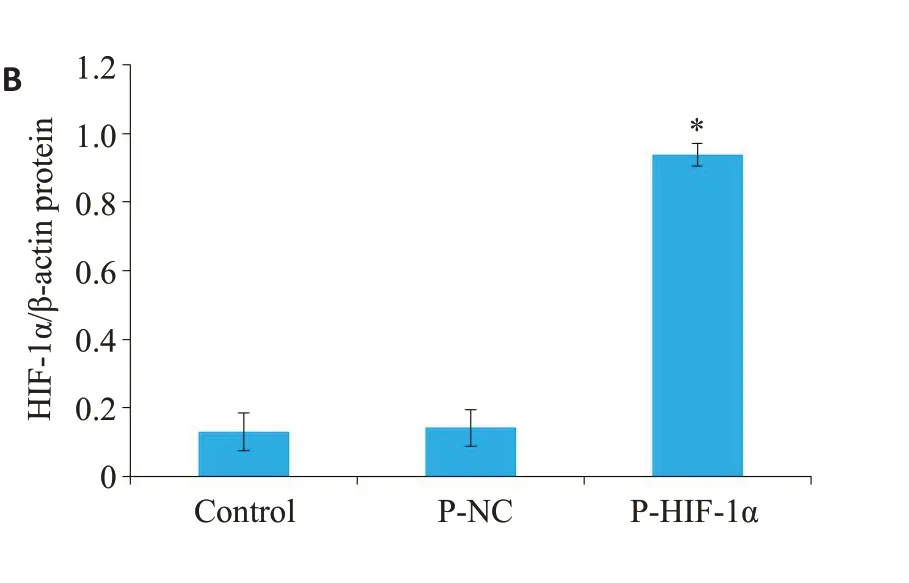
图2 转染6 h,对照组、P1asmid-NC 组和P1asmid-HIF-1α组HIF-1α的表达Fig.2 HIF-1α expression in control,Plasmid-NC,and Plasmid-HIF-1α groups at 6 h after transfection. A:HIF-1α mRNA expression detected by qPCR.B:HIF-1α protein expression detected by Western blotting.*P<0.05 vs with control group.

表2 不同时间点各组HeLa细胞活性Tab.2 Viability of HeLa cells at different time points after transfection(n=5,Mean±SD)

图3 Contro1组、miR-600 mimic组、P-HIF-1α组和miR-600 mimic+P-HIF-1α组6 h后HeLa细胞形态Fig.3 Morphology of HeLa cells in control,miR-600 mimic,P-HIF-1αand miR-600 mimic+P-HIF-1α groups at 6 h after transfection(×400).
在转染6 h 后与对照组比较,miR-600 mimic 组VEGF、Cyc1in D1和HIF-1α表达均明显下降,P-HIF-1α组和miR-600 mimic+P-HIF-1α组VEGF、Cyc1in D1和HIF-1α表达均明显增加,且P-HIF-1α组较miR-600 mimic+P-HIF-1α组增加更明显(P均<0.05,图4)。
3 讨论
低氧诱导因子-1(HIF-1)作为一种广泛表达的核转录因子(TF),可通过结合靶基因启动子(promoter)区域的特定序列-缺氧反应元件(HRE)诱导基因的表达[11-13]。研究发现Cyc1in D1 和VEGF 基因转录调控区存与HRE序列[11-13]。HIF-1与HRE结合可诱导该基因的转录。大量研究显示下调或阻断HIF-1α信号通路对多种肿瘤细胞的增殖和分化具有抑制作用[11-15]。Wei等[14]的实验表明在缺氧状态下,地高辛主要可以通过下调HIF-1α相关信号通路抑制A549细胞的增殖和分化。同时,吴维光等[15]的研究显示转染shRNA-HIF-1α质粒后HeLa细胞增殖能力较对照组明显下降,表明下调HIF-1α可有效抑制HeLa细胞的增殖和分化。因此推测诱导宫颈癌细胞株HeLa细胞HIF-1α过表达亦可导致肿瘤细胞的过度增殖。首先我们发现在干预6 h时miR-600 mimic 和P1asmid-HIF-1α对HeLa 细胞活性无显著影响。因此在此时间点检测mRNA和蛋白表达量可排除由于细胞数量差异导致基因表达差异而产生的影响。进一步我们发现在干预24 h和48 h时,P1asmid-HIF-1α时间依赖性的上调了HeLa细胞的数量。该结果表明HIF-1α过度表达可有效促进HeLa细胞的增殖和分化。因此,结合既往研究[15]和本实验结果提示HIF-1α是调控宫颈癌细胞增殖和细胞周期的关键分子。
研究显示miR-600对结直肠癌和肺癌等多种肿瘤细胞增殖有显著的抑制作用[16-17]。Zhang等[5]的研究显示上调miR-600 可有效抑制人结肠癌SW480 细胞、SW620细胞和DLD-1细胞的增殖和分化。进一步研究表明miR-600主要通过调控HIF-1α mRNA的转录后修饰控制肿瘤细胞的增殖过程。Chi等[6]通过离体和在体(裸鼠移植瘤)实验证明对于A549细胞等多个肿瘤细胞系miR-600可通过下调HIF-1α的合成有效抑制肿瘤的增殖、分化和转移过程,表明对于非小细胞肺癌的增殖miR-600是HIF-1α的关键调控因子。但目前miR-600对于宫颈癌生物学特征是否也具有重要的调控作用尚不清楚。因此,本研究试探讨上调miR-600表达对于HeLa细胞增殖和分化的影响,以及与HIF-1α信号通路的关系。我们的结果显示上调miR-600水平导致HeLa细胞活性呈时间依赖性下降,并有效抑制了P1asmid-HIF-1α诱导的HIF-1α表达。该结果表明在HeLa细胞中miR-600主要是通过下调HIF-1α合成抑制肿瘤的增殖和分化,提示宫颈癌细胞中miR-600对于HIF-1α具有重要负性调控作用。

为了进一步验证HIF-1a信号通路是miR-600调控HeLa细胞增殖和分化的关键环节及相关的分子机制。我们对HeLa细胞中受HIF-1α调控的与肿瘤增殖和分化相关的下游分子进行了分析。在宫颈癌和肺癌等多种肿瘤细胞中HIF-1α对VEGF和Cyc1in D1的表达具有关键的调控作用,VEGF和Cyc1in D1基因启动子序列存在缺氧反应元件(HRE),上调HIF-1α可促进VEGF和Cyc1in D1基因的转录[14,18-20]。其中,Cyc1in D1是细胞周期调控的关键因子[21]。Cyc1in D1的过度表达是诱导肿瘤细胞异常增殖的关键因素之一[20]。研究表明下调Cyc1in D1可减缓肿瘤细胞的增殖速度[21-23]。Siveen[24]的研究显示二甲双胍可通过下调Cyc1in D1的表达抑制HeLa细胞的增殖,并促进肿瘤细胞凋亡[22]。VEGF是促进肿瘤血管生成和转移的关键分子。Zhao等[18]的研究表明在宫颈癌HeLa细胞和SiHa细胞中丙戊酸可通过下调HIF-1α/VEGF信号通路抑制肿瘤血管生成。在本研究中我们发现在HeLa细胞中miR-600 mimic可有效抑制P1asmid-HIF-1α诱导的VEGF和Cyc1in D1表达。该结果表明在HeLa细胞中miR-600可通过抑制HIF-1α通路下调VEGF和Cyc1in D1的表达。提示宫颈癌细胞中miR-600主要通过HIF-1α信号通路参与了肿瘤细胞的增殖和分化的调控。
综上所述,本研究首次证明在HeLa细胞中miR-600可以通过抑制HIF-1α信号通路下调Cyc1in D1和VEGF的表达,从而抑制肿瘤细胞的增殖和分化。但HeLa中miR-600调控HIF-1α的具体分子仍需要进一步分析和研究。

图4 转染6h,Contro1 组、miR-600 mimic 组、PHIF-1α组和miR-600 mimic+P-HIF-1α组VEGF、Cyc1in D1和HIF-1α的表达Fig.4 HIF-1α expression in control,miR-600 mimic,P-HIF-1α and miR-600 mimic+P-HIF-1α groups at 6 h after transfection. A: mRNA expression by qPCR. B: Protein expression by Western blotting.*P<0.05 vs control group;#P<0.05 vs miR-600 mimic group;†P<0.05 vs miR-600 mimic+P-HIF-1α group