光动力脂质体凝胶协同曲妥珠单抗体外杀伤耐药性乳腺癌细胞的效果
2021-02-27王永霞文楚然叶建森黄河清张玉娟袁惠玲姚广裕
王永霞,文楚然,叶建森,黄河清,张玉娟,袁惠玲,姚广裕,于 梦
1南方医科大学附属东莞市人民医院乳腺科,广东东莞523000;南方医科大学2南方医院乳腺科,3药学院,广东广州510515
乳腺癌是中国乃至全球发病率最高的女性恶性肿瘤,同时也在严重威胁乳腺癌患者的生存[1]。其中人表皮生长因子受体2(HER2)的乳腺癌约占乳腺癌诊出率的20%~30%[2]。曲妥珠单抗(Tmab)是靶向HER的人源化单克隆抗体,临床研究显示Tmab与化疗联合用于HER2过表达转移性乳腺癌的治疗以及早期乳腺癌的新辅助和辅助治疗[3]。然而,PI3K/AKT/mTOR信号通路的异常活化、HER家族成员间的相互作用、药物压力下代偿性生存信号的激活、肿瘤干细胞表型形成等均可能导致Tmab发生耐药[5]。由于Tmab的使用伴随严重的心脏毒性问题[5],以及高耐药风险,因此,亟需设计一种精准安全的药物递送体系,使Tmab在HER2+乳腺癌患者治疗中更好地发挥疗效。
近来,已有多种策略克服Tmab的耐药性问题,如应用PI3K/AKT/mTOR信号通路的小分子抑制剂或耐药相关促生存信号通路的特异性抑制剂,可一定程度上逆转Tmab耐药,延长患者的疾病无进展生存期[6]。此外,活性氧(ROS)已被证实能有效降低低氧诱导因子-1(HIF-1α),从而调节信号通路PI3K/AKT/mTOR,实现HER2+耐药性逆转[7]。然而,在这类逆转Tmab耐药策略中,针对Tmab心脏毒性问题,当前研究中未提出有效的解决方案。
采用近红外光响应释药纳米载体进行药物的体内递送[8],可实现在癌灶部位的精准释放,有效降低治疗药物对心脏的毒副作用[9]。因此,本研究围绕逆转Tmab耐药并降低心脏毒副作用这一目标,设计近红外光响应脂质体凝胶(Ce6-PC-Tmab@A-Ge1),负载光敏剂Ce6和肿瘤靶向药Tmab。该体系在近红外光刺激下产生高浓度ROS,发挥光动力治疗(PDT)作用,并诱导Tmab释药以降低毒副作用,同时通过ROS逆转Tmab耐药机制,促进Tmab靶向治疗效果。这一设计为临床解决Tmab的耐药性及心脏毒性问题,提供了新思路。
1 材料和方法
1.1 主要试剂与仪器
高纯蛋黄卵磷脂(PC-98T,Avanti Po1ar Lipids),磷脂酰乙醇胺(PE,Sigma-A1drich),胆固醇(Cho1,Sigma-A1drich),聚乙二醇2000修饰的二硬脂酰基磷脂酰乙醇胺(DSPE-PEG2000,Avanti Po1ar Lipids),醛化黄原胶(ALD-XA),磷酸盐缓冲液(PBS),二甲基亚砜(DMSO, 北京索莱宝科技有限公司),曲妥珠单抗(Trastuzumab,Tmab,Herceptin,Genetech Inc),人乳腺癌细胞(SK-BR-3,BRIA),旋转蒸发仪(北京优莱博技术有限公司),水浴超声振荡器(中国深圳市洁泰超声洗净设备有限公司),细胞破碎仪(上海比朗仪器制造有限公司),冷冻干燥机(中国宁波新芝设备有限公司),台式离心机(Sigma),紫外分光光度计(PerkinE1mer),马尔文激光测径仪(Ma1vern),扫描显微镜(JEOL电子),触屏流变仪(Brookfie1d),酶标仪(BioTek)。
1.2 Ce6-PC-Tmab@A-Ge1的制备
PC、PE、Cho1、DSPE-PEG2000按照50:25:25:10的摩尔比(总体系22.1 mg)溶于15 mL氯仿中,50 ℃下全负压旋转蒸发得到均匀的透明薄膜,加入Tmab样品2 mL(21 mg/mL),冰浴环境中超声约15 min制得质地均匀脂质纳米载体。置于0.9%(w/w)氯化钠溶液中(体积比1∶20)透析48 h后除去离子杂质及游离药物。再将所得纳米溶剂置于液氮中72 h,后再于-20 ℃下负压冷冻干燥48 h 即得粉末状的Ce6-PC-Tmab。于黄原胶(XA)(0.5% w/v)水溶液中加入NaIO4(摩尔比:XA∶NaIO4=1∶4),加热至45 ℃溶解,避光反应4 h;加入1%乙二醇中止反应,继续反应1 h,-20 ℃负压冻干后制备得醛化黄原胶(ALD-XA)。称量适量样品Ce6-PC-Tmab与60 mg醛化黄原胶(ALD-XA)并加入蒸馏水混匀,室温下采用磁力搅拌交联法,速度为400 r/min,搅拌12 h,获得质量浓度为30%的样品Ce6-PC-Tmab@A-Ge1。
1.3 Ce6-PC-Tmab及Ce6-PC-Tmab@A-Ge1的表征检测
Ma1vern激光测径仪检测其粒径大小、分布及表面电荷等特性。扫描电镜(SEM)观察磷钨酸负染法处理后的Ce6-PC-Tmab@A-Ge1 形态。流变仪测定Ce6-PC-Tmab@A-Ge1的流变力学性质。
1.4 药物包封率及载药量检测
配置Tmab标准溶液,用紫外分光光度计测定波长并绘制标准曲线,根据标准曲线计算透析冻干后脂质体中Tmab 的包封率,包封率(ER,%)=(Wa-Wb)/Wa×100%,Wa为加入Ce6-PC-Tmab中的总药物量,Wb为通过透析去除的游离药物量。载药量(DL,%)=(Wa-Wb)/Wc×100%,Wc为合成脂质载体总质量。
1.5 Ce6-PC-Tmab@A-Ge1稳定性检测
在不同pH值(pH 7.4/6.25/5.5)缓冲液环境下,将Ce6-PC-Tmab@A-Ge1放置96 h,观察胶体的稳定性、检测药物在介质中的释放率;Ce6-PC@A-Ge1包载不同水溶性成分,如靶向药Tmab(Tmab)与荧光染料罗丹明B(RhoB),放置96 h观察不同包载物对于体系胶体稳定性的影响、称量剩余胶体的质量;改变Ce6-PCTmab@A-Ge1载药体系的浓度,放置96 h观察胶体的稳定性,称量剩余胶体的质量。
1.6 脂质体凝胶的近红外光刺激响应药物释放
将脂质体凝胶材料分为光响应载体接受光照刺激组(Ce6-PC-Tmab@A-Ge1+1aser)、光响应载体不接受光照刺激组(Ce6-PC-Tmab@A-Ge1)、非光响应载体接受光照刺激组(PC-Tmab@A-Ge1+1aser)共3组,每组设置3个平行实验,PBS为对照组。接受近红外光刺激后,在不同时间点取样检测药物释放量,非光照组在相同时间点取样检测。
用紫外分光光度计在280 nm波长下测定释放介质吸光度并计算Tmab累积释放量(Ct),用同样的方法计算其他各组中药物的累积释放量(Ct),取相同质量原始冻干样品用二甲基亚砜(DMSO)裂解,测裂解后的药物浓度(Cf)作为载体中药物释放前的初始浓度。药物释放率=Ct/Cf×100%。
1.7 纳米脂质体溶液的体外SK-BR-3细胞毒性实验
将耐药性HER2+人乳腺癌细胞SK-BR-3 按1×105/孔的浓度接种于96孔板生长贴壁后,设置光响应载体接受光照刺激组(Ce6-PC-Tmab+1aser,光照功率0.5 W,光照2 min)、光响应载体不接受光照刺激组(Ce6-PC-Tmab)、非光响应载体接受光照刺激组(PCTmab+1aser),每组5个复孔(加入的Ce6-PC-Tmab浓度为250 μg/mL),孵育4 h后进行近红外光刺激,细胞再继续培养24 h,向每孔加入10 μL的MTT试剂,30 min后在490 nm的吸收波长下用酶标仪定量检测各实验组SK-BR-3增殖情况。
1.8 Ce6-PC-Tmab@A-Ge1联合近红外光治疗小鼠乳腺肿瘤
选择体质量为18~22 g的雌性BALB/c小鼠,采用皮下接种法建立乳腺癌小鼠皮下肿瘤模型。造模成功后,将小鼠模型随机分为3组,每组5只,一组按12 mg/kg剂量于原位瘤旁注射PC-Tmab@A-Ge1,在注射后每3 d进行近红外光关照治疗(光照强度为0.5 w,光照时长为2 min/次),另一组则注射同样量的PC-Tmab@A-Ge1,不进行光照处理。注射PBS溶液小鼠作为对照组。每组均在治疗第0,7,14天置于小动物活体成像仪下观察肿瘤生物发光,并每隔2 d记录肿瘤体积大小及动物体重。第14天治疗结束后,视为一个完整的治疗周期,根据动物伦理相关规定,结束动物实验。
1.9 统计学分析
实验数据采用SPSS 13.0统计软件进行统计学分析,实验结果以均数±标准差表示,组间差异采用单因素方差分析,P<0.01判定为差异有统计学意义。
2 结果
2.1 Ce6-PC-Tmab及Ce6-PC-Tmab@A-Ge1的表征检测
本研究制备的Ce6-PC-Tmab为墨绿色粉末,溶于PBS后为均匀浅绿色悬液,Ce6-PC-Tmab@A-Ge1为浅绿色凝胶状,对照组为乳白色凝胶(图1A),使用注射剂抽吸具有良好剪切效应,凝胶注入水中具有显著的附着性及稳定性(图1A),SEM观察到的Ce6-PC-Tmab@AGe1为带有孔隙和附着有微小颗粒的片层海绵结构(图1B)。Ma1vern激光测径仪测得的Ce6-PC-Tmab平均粒径Size为(239.7±9.7)nm,电位Zeta为(-2.03±0.09)mV(表1)。紫外分光光度计测定可见样品Ce6-PC-Tmab在280 nm(Tmab)及416 nm(Ce6)处有明显特征峰(图1C)。流变分析仪测定Ce6-PC-Tmab@A-Ge1观察到良好的剪切效应及粘附性(图1D)。
2.2 药物包封率及载药量检测
根据紫外分光光度计检测,Tmab的最大吸收波长在280 nm。以浓度为横坐标,吸光度为纵坐标,得线性回归方程:y=0.0015x-0.0162,R2=0.9992;平均包封率(ER%)为(40.22±0.73)%,载药量(DL%)为(36.78±0.06)%(表1)。
2.3 Ce6-PC-Tmab@A-Ge1稳定性检测
分别在不同的pH外液环境(pH=7.4/6.25/5.5)下放置96 h,观察发现模拟接近肿瘤微环境的pH 环境下(pH=6.25),Ce6-PC-Tmab@A-Ge1稳定性更好,释放外液更加澄清(图2A),在缓慢释放24 h 内,外液pH 为6.25的情况下胶体药物释放量控制效果最好为(32.54±0.58)%(图2B),能达到缓释的实际效果,胶体剩余质量也同样证明肿瘤微环境pH中胶体损失最小,为(73.64±1.83)%(图2C)。
凝胶材料分别包载不同的水溶性成分,Tmab与罗丹明B(RhoB),得到合成物Ce6-PC-Tmab@A-Ge1 and Ce6-PC-RhoB@A-Ge1,在相同PBS 外液环境中放置96 h。由于Tmab和Ce6在π-π键的作用能够交联得更加紧密,在PBS外液环境中放置96 h后,能缓慢释放药物且能维持胶体完整结构,可见包载Tmab的组别胶体剩余质量大于包载RhoB 组别,分别为(87.34±2.57)%、(30.13±1.80)%(图3A),包载Tmab组胶体外观更加牢固,附壁性更优,稳定性更加显著(图3B,P<0.01)。
包载不同浓度水溶性成分时(w=10%/20%/30%),在相同PBS外液中放置96 h后,胶体外观可见w=30%时胶体最为稳固,胶体剩余质量也是最大的为(92.21±2.05)%(图4A)。可见当包载治疗材料浓度为30%时胶体稳定性最好(图4B)。
2.4 近红外光控释药物试验
体外近红外光(670 nm)光控释药时发现,Ce6-PCTmab@A-Ge1中Tmab的释放量有随光照强度的增加和光照时间的延长而增多的趋势,控制光照时间为2 min,随着光照功率增大(0.1 w/0.2 w/0.5 w),Tmab释放率显著增加(图5A),而且当光照作用时间为2 min,光照功率为0.5 w 时,放置120 h 后Tmab 的释放率可达到(84.54±0.54)%。控制光照功率为0.5 w,随着光照时间增加(60 s/120 s/180 s),释放率也稳步增加,在光照180 s时,Tmab的释放率达到(10.36±0.49)%(图5B)。
2.5 体外抑制SK-BR-3增殖实验
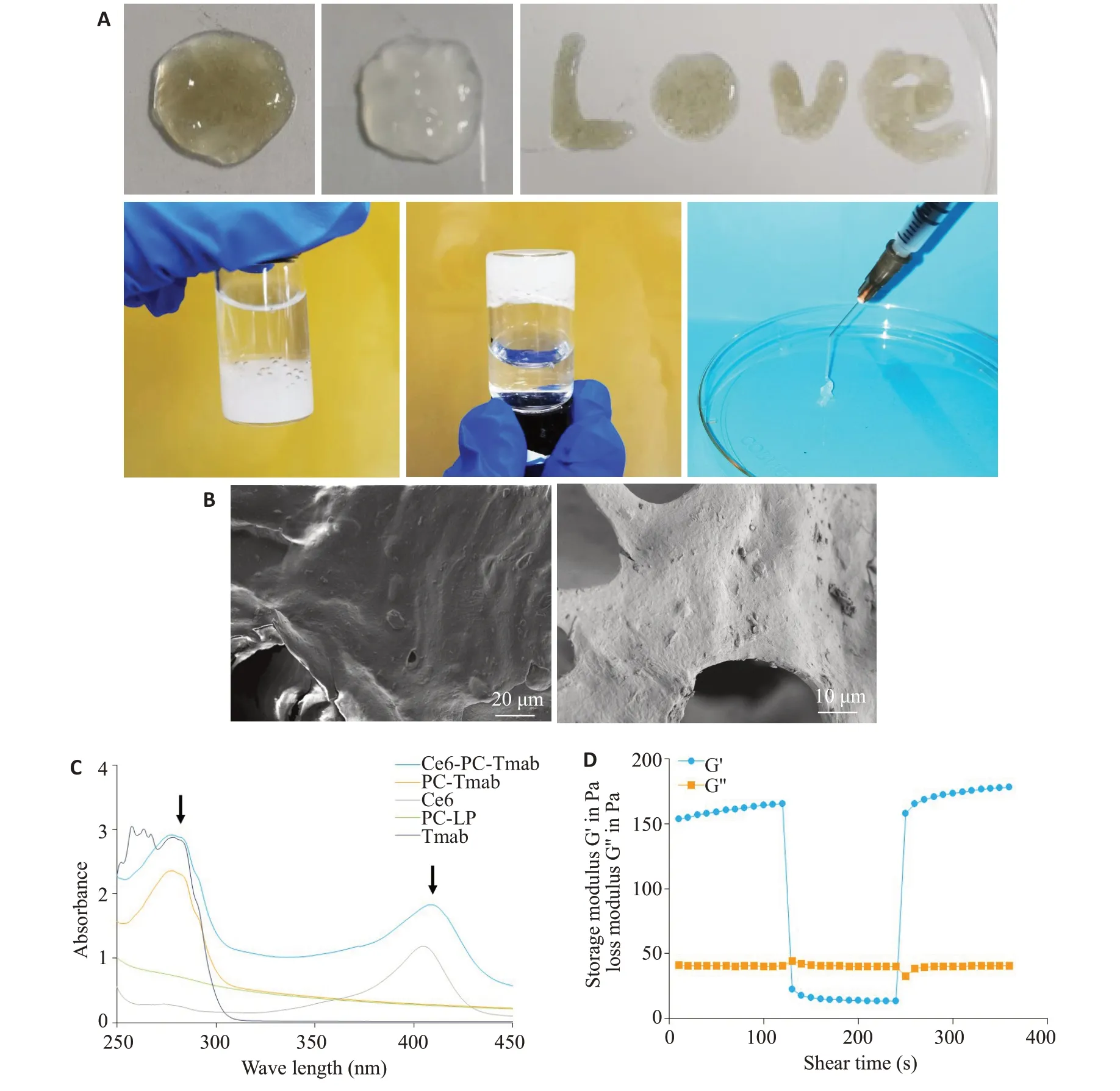
图1 Ce6-PC-Tmab及Ce6-PC-Tmab@A-Ge1的表征Fig.1 Characterization of Ce6-PC-Tmab and Ce6-PC-Tmab@A-Gel.A:Shear,adsorption and stability of Ce6-PC-Tmab@A-Gel in water.B:SEM image of Ce6-PC-Tmab@A-Gel(Phosphotungstic acid staining,original magnification:×500 and 1000). C: Ultraviolet spectrogram of Ce6-PC-Tmab, PC-Tmab, PC-LP,Ce6(416 nm)and Tmab(280 nm).D:Change of storage modulus(G)and loss modulus(G")with time of Ce6-PC-Tmab@A-Gel.

表1 Ce6-PC-Tmab脂质体的一般性质表征Tab.1 Characterization of Ce6-PC-Tmab
通过观察对照组及各实验组抑制SK-BR-3增殖实验发现,光响应载体接受光照刺激组(a:Ce6-PC-Tmab+1aser,光照1,2,3,4 min)、光响应载体不接受光照刺激组(b:Ce6-PC-Tmab)、非光响应载体接受光照刺激组(c:PC-Tmab+1aser)以及PBS组(d),各组间SK-BR-3存活率分别为(31.37±1.73)%、(66.19±1.12)%、(79.51±1.27)%、(98.31±0.70)%。Ce6-PC-Tmab@A-Ge1联合近红外光治疗组抑制SK-BR-3细胞增殖作用最强,差异有统计学意义(P<0.01,图6A)。经近红外光刺激后,固定光照功率为0.5 w,随着光照时间的增加(0,1,2,3,4 min),各组产生ROS 增量分别为(5.03±0.07)%、(9.41±0.30)%、(22.09±0.91)%、(22.60±0.17)%、(22.36±0.11)%,光照2 min后与初始组差异有统计学意义(P<0.01,图6B)。
2.6 体内抑制SK-BR-3增殖实验
在小鼠乳腺癌皮下移植瘤模型中,活体成像下通过生物发光(图7A)直接判断肿瘤大小(图7B),记录各组小鼠肿瘤体积大小及体质量变化(图7C),在第14天治疗完成后,结束实验,测量肿瘤质量(图7D)。可见联合治疗组(Ce6-PC-Tmab@A-Ge1+1aser)在治疗第7天、第14天即有显著抑瘤效果,肿瘤得到有效抑制直至完全消融,非光照组(Ce6-PC-Tmab@A-Ge1)和对照组(PBS)肿瘤体积呈持续增大的趋势。
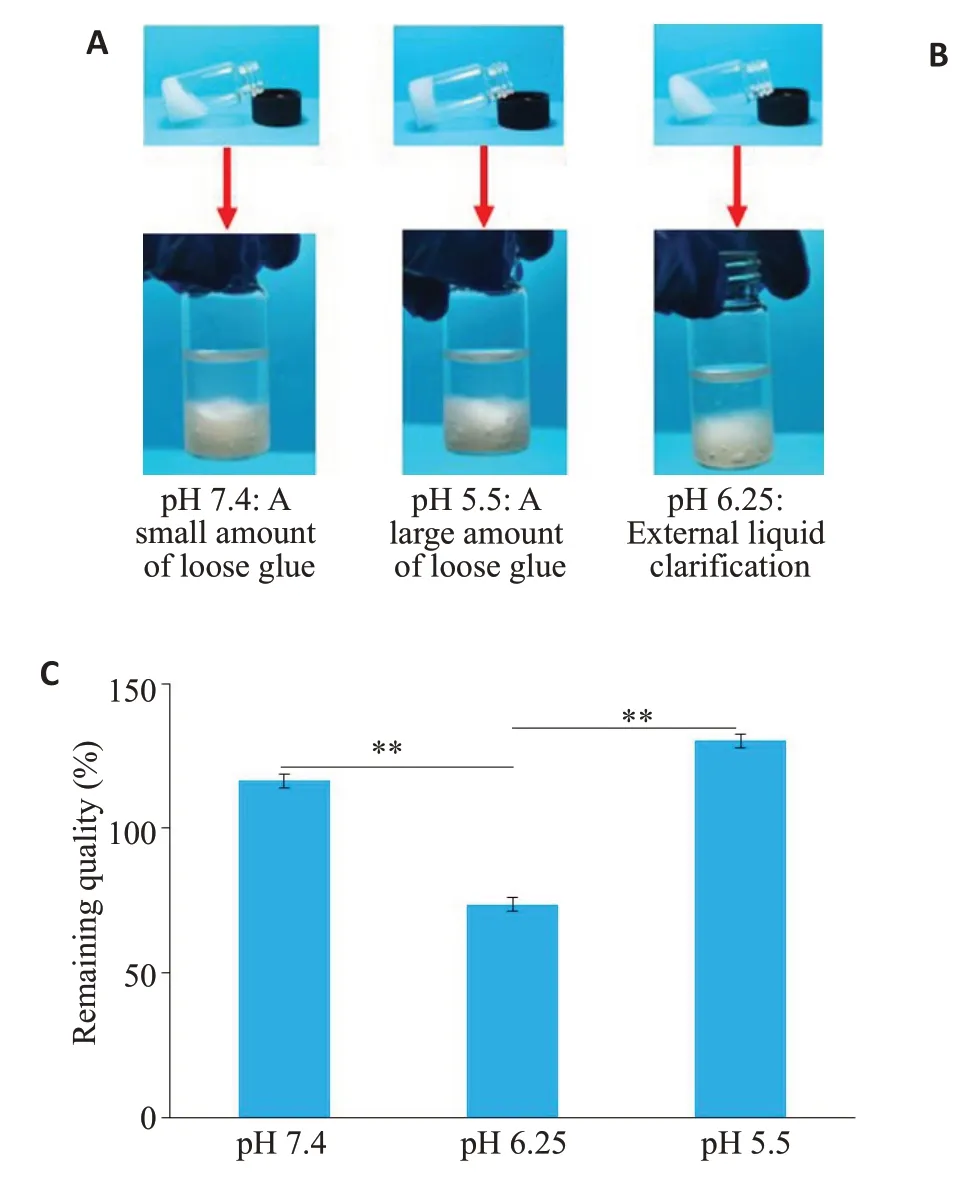
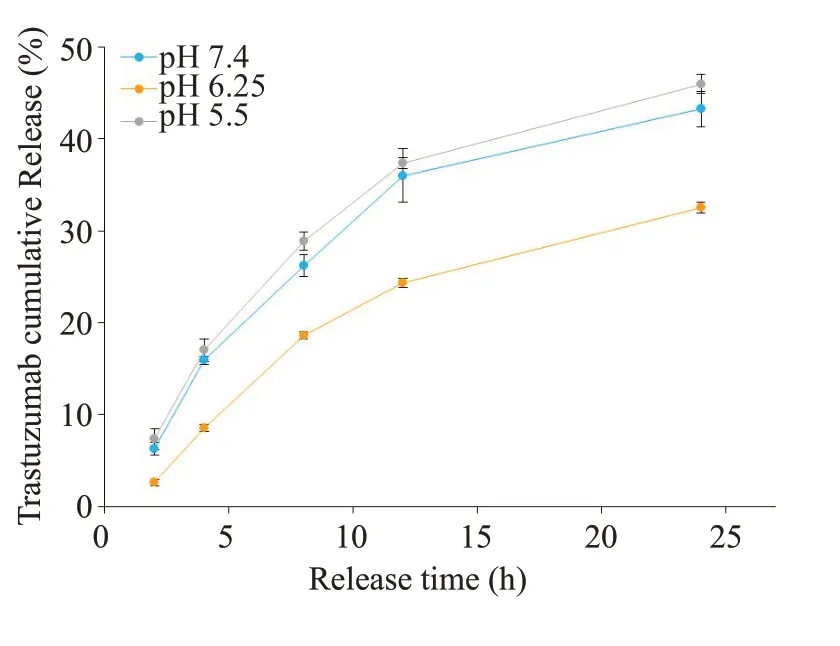
图2 Ce6-PC-Tmab@A-Ge1在不同的pH外液环境(pH=7.4/6.25/5.5)下的稳定性Fig.2 Stability of Ce6-PC-Tmab@A-Gel under different pH conditions (pH=7.4/6.25/5.5). A:Appearance stability.B:Release rate of Tmab.C:Residual mass percentage of Ce6-PC-Tmab@AGel.**P<0.01.
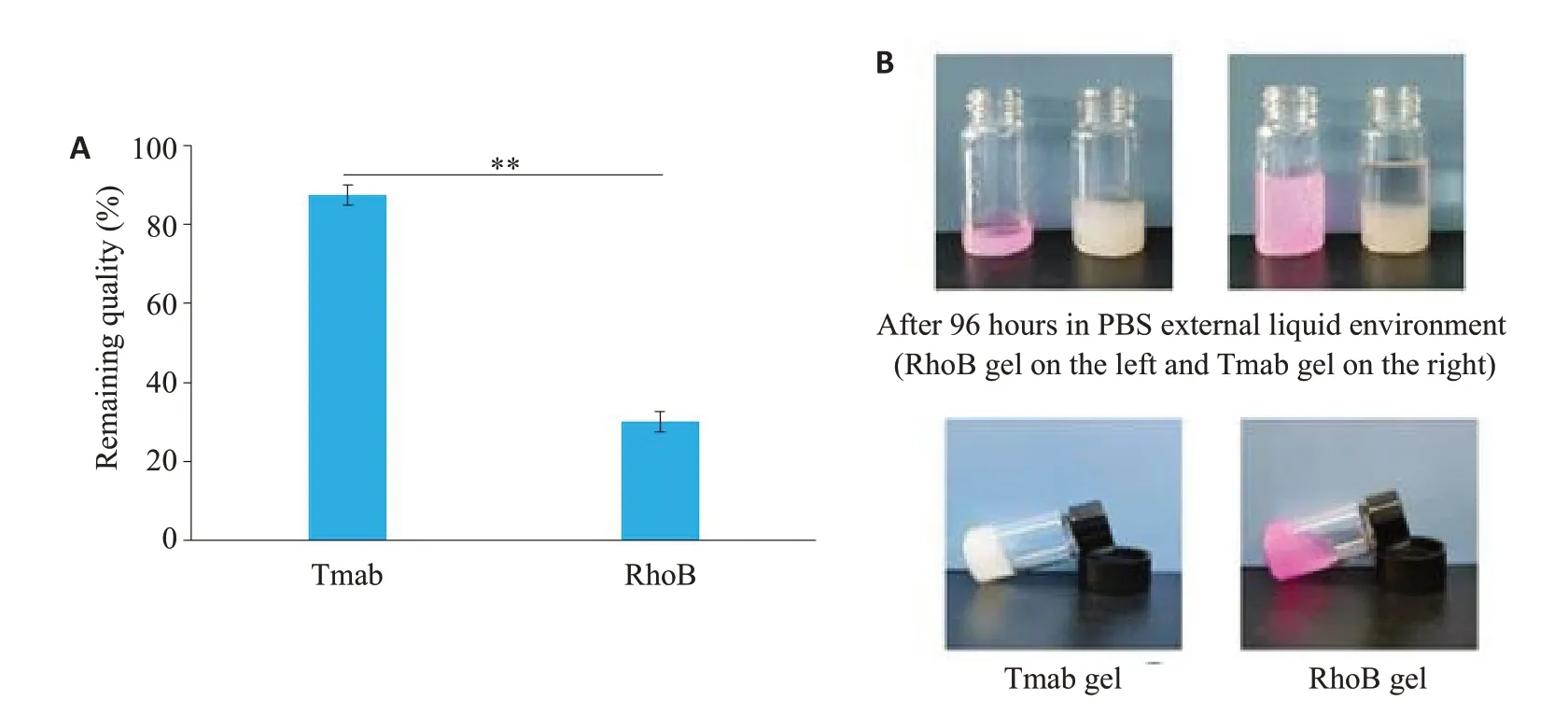
图3 Ce6-PC@A-Ge1分别包载不同的水溶性成分Tmab与RhoB的稳定性Fig.3 Stability of Ce6-PC@A-Gel loaded with Tmab and RhoB.A:Residual mass percentage of Ce6-PC-Tmab@A-Gel and Ce6-PC-RhoB@A-Gel,**P<0.01.B:Appearance changes after 96 h storage.

图4 Ce6-PC-Tmab@A-Ge1包载不同浓度水溶性成分时(w=10%/20%/30%)的稳定性Fig.4 Stability of Ce6-PC-Tmab@A-Gel containing different concentrations(10%,20%,or 30%)of water-soluble components.A:Residual mass percentage,**P<0.01;B:Appearance changes after 96 h storage.
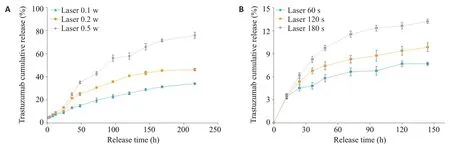
图5 体外近红外光(670 nm)控释药物试验性Fig.5 Release test controlled by near-infrared light (670 nm) in vitro. A: The release rate of Tmab increased significantly with the increase of light power(0.1,0.2,and 0.5 W)when the illumination time was 2 min.B:With the increase of illumination time(60 s/120 s/180 s)the release rate increased steadily.
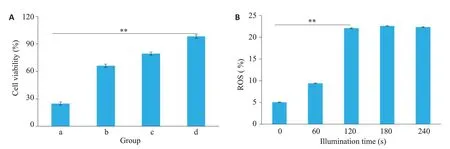
图6 体外抑制SK-BR-3增殖实验Fig.6 In vitro inhibition of SK-BR-3 cells.A,B:Survival rate of SK-BR-3 and ROS increment among groups(a:Ce6-PCTmab+laser;b:Ce6-PC-Tmab;c:PC-Tmab+laser;d:PBS),**P<0.01.
3 讨论
HER2+乳腺癌的治疗在乳腺癌治疗中占有重要地位,Tmab作为新辅助化疗药物的使用带来曙光的同时也带来很多值得思考的问题,药物的耐药性导致治疗效果不佳[10]以及药物本身的心脏毒副作用[11],使得Tmab的临床应用面临巨大挑战。纳米材料包裹药物能有效解决药物本身带来的全身毒性问题,有效降低心脏毒副作用[12];同时具备刺激响应释药功能的纳米载体,能精准调控药物释放,靶向治疗病灶,提高药物有效性[13]。
本课题中设计的药物载体为脂质体凝胶,纳米级脂质体粒径为(239.7±9.7)nm,脂质体膜材中掺杂不饱和磷脂成分,使载体具有ROS响应释放性能。SEM结果显示本课题中制备的脂质体凝胶材料为疏松多孔结构,这有利于在植入部位进行内外物质交换,使从纳米载体中释放的治疗成分可通过凝胶基质中的孔洞快速扩散并发挥药效。水溶性大分子药物的包载和体内递送一直都是载体设计中的难题,水溶性大分子药物,尤其是大分子蛋白类物质的包载率远远低于脂溶性小分子药物。Xie等[14]采用纳米载体包裹紫杉醇和Tmab进行联合给药,遗憾的是,单抗负载量低于25%(w/w)。在本课题设计中,充分考虑了药物本身的结构特点,利用多肽药物可以通过结构中的π-π共轭效应实现较高载药量的特点[15],通过光敏剂Ce6结构中羧基(-COOH)与Tmab形成氢键作用来实现药物高效共载,双药共载体系中Tmab载药量提高到(36.78±0.06)%(w/w)。同时考虑到抗体结构易变性,为确保抗体活性,在制备阶段保证Ce6-PC-Tmab的制备在-4 ℃的冰浴环境中进行,之后取用透析手法去除可能因物理操作产生的抗体游离碎片,保证包载抗体的结构完整性及活性。利用紫外分光光度计检测制备完成的Ce6-PC-Tmab的结构峰分布,Tmab特征峰明显(280 nm),并与同浓度游离Tmab对比,证明包载抗体结构完整(图1C)。在体内外治疗实验中,分组a(Ce6-PC-Tmab@A-Ge1+1aser)表现出比分组c(Ce6-PC@A-Ge1+1aser)显著增强的治疗效果(图6A),证明该抗体药物被包裹到载体后,仍然保留完整结构和高度活性。
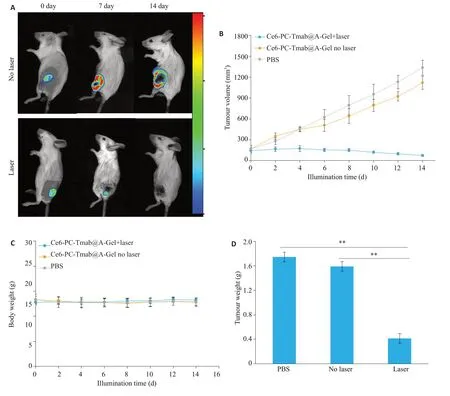
图7 Ce6-PC-Tmab@A-Ge1联合近红外光治疗荷瘤小鼠模型Fig.7 Treatment of tumor-bearing mice model with near-infrared light by Ce6-PC-Tmab@A-Gel.A:Tumor morphology and volume shown by in vivo imaging. B, C: Changes of tumor volume and body-weight of mice during treatment. D: Tumor weight at the end of treatment,**P<0.01.
将可植入凝胶用于肿瘤治疗,有助于在植入部位更好地发挥疗效,极大地降低对其他脏器的毒副作用,因此受到研究人员广泛关注。Luo等[16]采用含有一个聚乙二醇嵌段和两个多肽嵌段的功能性三嵌段共聚物制备植入凝胶用于药物递送。这类凝胶体系对纳米药物的结合方式多为物理包埋,在包载及释药过程中存在诸多的不稳定因素。考虑到纳米载体与凝胶材料结合的稳定性,本研究采用醛化修饰黄原胶作为凝胶基质,与脂质体中富含氨基的磷脂成分之间形成具有剪切响应性的席夫碱(-RC=N-)化学连接键[17]。得到的可注射脂质体凝胶Ce6-PC-Tmab@A-Ge1经流变力学测试,具有优良的剪切响应性,在模拟肿瘤微环境的PBS缓冲液中,保持良好的成胶性和稳定性。这一性质不仅有利于该凝胶材料在病灶部位的局部注射成型,也保证了在体内水环境中的载体稳定性,有效避免药物泄露和毒副作用。
可注射脂质体凝胶Ce6-PC-Tmab@A-Ge1中的脂质体的膜材采用不饱和磷脂掺杂,并同时负载光敏剂Ce6和靶点药物Tmab。由于光敏剂的存在,该脂质体在接受近红外光照射下,会产生大量细胞毒性ROS成分,ROS与膜材中不饱和磷脂发生氧化反应[18],破坏脂质体完整结构,进一步导致Tmab释放。随着光照强度和光照时间的增加,Tmab释放速率明显加快。这一发现提示我们,本研究中近红外光响应释药脂质体在一次性局部注射后,通过调整诱导条件相关参数,对药物释放速率可控调节,对于临床灵活调整给药方案有十分重要的意义
从载体释放出来的Tmab在发挥肿瘤治疗作用时,常常由于异常活化、HER家族成员间的相互作用等原因导致耐药,造成治疗效率低下。已有研究表明,PI3KAKT 通路异常活化是引起Tmab 耐药的重要原因之一[19]。而ROS被报道可有效降低低氧诱导因子-1(HIF-1α),从而调节信号通路PI3K/AKT/mTOR[20],从而逆转HER2+乳腺癌患者的Tmab耐药[21]。本研究中将可产生大量ROS的PDT疗法与Tmab联用,通过逆转Tmab耐药,增强靶向药物疗效,实现协同治疗作用。在细胞水平和动物水平上,协同治疗组Ce6-PC-Tmab+1aser和Ce6-PC-Tmab@A-Ge1+1aser与单一Tmab靶向治疗组相比,表现出更优越的抑制肿瘤细胞增殖和抑制肿瘤生长的能力,从另一方面证明了该体系对Tmab耐药性逆转的潜力。
本研究设计的凝胶给药体系在临床中有显著突出的应用价值。在实际的临床环境中,癌症患者的治疗方案通常需要根据实际病情对药物剂量及方案进行灵活调整[22],本研究设计的近红外光刺激响应释放凝胶体系,可以根据患者的实际需求,调整相关的参数如光照强度、时间、光照次数、光敏剂载量、药物贮存量等,来实现药物的不同释放速率和释放治疗量;同时也可根据患者治疗方案的调整,更换或增加包载药物内容,实现“一平台多药多重治疗”。另外,患者在以往的治疗过程中,常常涉及中心静脉导管等的建立和维护,长期使用会带来导管通道的治疗效果下降、弃用等情况,长期滞管还会带来感染的风险,且一定量患者存在天生血管畸形而不适宜建立[23]。我们研究设计的凝胶体系有着低风险、低损伤、高舒适度的优点,肿瘤旁注射贮存药物凝胶,体外光照刺激响应,实现无创便捷释药治疗;并且由于凝胶的可贮药性和缓释型,我们能实现“一次给药、多次光照治疗”的效果,有效降低患者新一轮治疗的感染风险、提高治疗舒适度。结合我们前面已经提及的逆转耐药机制、降低原药毒性的特质,我们设计的凝胶给药体系在临床应用中拥有不可小觑的应用价值。
该凝胶给药体系在研究肿瘤生物学行为方面亦有显著的价值。在针对不同分型的乳腺癌诊治中,我们可以借用此凝胶给药平台,包载不同的治疗药物,如Basa1-1ike型(表现为ER和/或PR-,HER2-)[24],考虑包载免疫靶向药物PD-L1等治疗;HER2过表达型(ER和/或PR-,HER2+)[24],考虑包载曲妥珠单抗或帕妥珠单抗治疗。同时针对肿瘤常见的转移和扩散等生物学行为,我们可以利用该凝胶给药平台,建立多种体内给药研究模型:如针对肿瘤转移治疗模型,进行原位瘤旁凝胶注射治疗,观察对肺转移或肝转移的疗效;再如针对肿瘤复发再治疗模型,可再次光照原贮存凝胶,实现药物释放,观察对于复发瘤的疗效。可见,该凝胶给药体系在研究肿瘤的异型性、扩散转移等生物学行为方面有着可观的临床前景。
综上所述,本研究所构建的多功能纳米载体Ce6-PC-Tmab@A-Ge1,不仅能够实现近红外光控响应释药,还能集光动力治疗与靶向治疗为一体,缓释药物同时实现长效治疗,有效逆转Tmab的耐药性、降低心脏毒副作用。本研究为进一步构建集控释、诊断、靶向治疗于一体的多功能载药平台奠定研究基础,也为后续诊疗不同分型乳腺癌、构建个性化治疗方案提供新的思路。
