富心方通过调控c-Fos-NR4A1-p38通路改善人动脉血管内皮细胞缺氧引起的损伤
2021-02-27史嘉炜蔡欣玲黄盛娜
徐 俊,史嘉炜,蔡欣玲,黄盛娜,李 刚,徐 燕
1上海中医药大学附属曙光医院,上海200021;2上海市浦东新区中医医院罗山分院,上海200136
动脉粥样硬化(AS)是一种高度特异性的细胞分子反应为特征的炎症进程[1]。脂质代谢紊乱、炎症反应、内皮细胞凋亡、血流剪应力异常、氧化应激等多种和动脉粥样硬化有关的致病因素都会造成冠脉的内皮细胞的损伤,产生炎症-纤维增生性反应[2]。早期研究表明,丝裂素活化蛋白激酶(MAPK)家族之一p38丝裂原活化蛋白激酶(p38MAPK)通路与内皮细胞损伤关系密切,是参与炎症反应的细胞内的重要通路[3]。p38MAPK通过非磷酸化转化为磷酸化状态进而促进下游底物的磷酸化来快速实现信号传递,与核因子κB(NF-κB)共同促进炎性介质分泌(如:白介素-18、白介素-17、肿瘤坏死因子-α),介导炎症因子对内皮细胞的损伤,引发斑块破裂、细胞凋亡,直接或间接损伤血管内皮细胞,导致血管内皮细胞功能失调从而参与AS形成和冠状动脉粥样硬化性心脏病的发生[4-6]。但是,p38MAPK信号通路活化及上游调控机制尚不清楚
目前临床服用富心方的冠心病心绞痛患者经过长期随访发现,与对照组比较,服药患者的动脉血管内皮损伤得到改善,各项临床症状也逐渐好转,富心方疗效明显,并且血清白介素-17、白介素-18表达下降,炎症反应受抑、与斑块稳定、临床症状缓解等有关[7]。但是尚不清楚富心方是否是通过p38MAPK非磷酸化转化为磷酸化状态从而调控下游的炎性因子白介素-17和白介素-18,同时富心方是否也是通过调控p38MAPK上游的基因的表达从而减缓内皮细胞的损伤。
有研究通过孤儿核受体(NR4A1)敲除基因裸鼠的建立,发现NR4A1是调节单核细胞和巨噬细胞炎症表型的新靶点,提出可能对动脉粥样硬化的发生很重要的观点[8],验证了NR4A1 的表达和NF-κB 的激活有关。而之前的研究已经明确p38MAPK通过非磷酸化转化为磷酸化状态可促进下游底物的磷酸化来快速实现信号传递,启动NF-κB,近期报道的NR4A1的过度表达限制了脂多糖对于小鼠肺内内皮屏障的破坏的研究[9],进一步提示调控炎性介质分泌有关的NF-κB的上游因子NR4A1与p38MAPK之间有一定相关性,期待在本研究中得到解释。
因此,本研究通过建立人动脉血管内皮祖细胞(HAECs)缺氧模型,以模拟受缺氧应激活化后内皮细胞受到的的损伤并还原缺氧内皮细胞对冠心病的影响[10-12]。然后结合高通量测序及蛋白验证技术进行靶基因筛选,确定和内皮细胞损伤有关的基因,且这些基因和动脉粥样硬化有关,并验证富心方作用于缺氧内皮细胞以后和缓解或者修复内皮细胞损伤有关的基因的表达,比如NR4A1和p38MAPK及其相关的基因,并利用近年来开发的软件找到分析富心方对改善内皮细胞损伤的疗效和作用的靶基因,以探究中药富心方治疗冠心病动脉粥样硬化的作用机制,为进一步阐明内皮细胞损伤和修复机制奠定基础。
1 材料和方法
1.1 实验动物与材料
1.1.1 实验动物 雄性SD大鼠13只,SPF级,购自上海斯莱克实验动物有限责任公司,生产许可号:SCXK(沪)2017-0005,体质量180±20 g。
1.1.2 细胞 人动脉血管内皮祖细胞(HAEC,ATCC)。
1.1.3 药物 富心方:包含黄芪、三七、山楂、水蛭、姜半夏等药物,所有药物均采用免煎颗粒剂,相当于生药剂量57 g/帖,由江阴天江药业有限公司生产提供(批号:18020311)。
1.1.4 试剂 蛋白预染(批号:SM1811, Marker Fermentas);丽春红S(批号:BYL40635);NC膜(批号:HATF00010, mi11ipore);PBS 磷酸盐缓冲液(批号:BYL40657);发光液(批号:WBKLS0100,Mi11ipore);抗体P38(批号:#9212)、p-P38(批号:#4511)、GAPDH CST(批号:#5174,CST);羊抗兔HRP标记二抗(批号:A0208)、羊抗鼠HRP标记二抗(批号:A0216,碧云天);Human c-c-Fos ELISA Kit(批 号:CSB-E09261h);Human NR4A1 ELISA Kit(批 号:MBS9340514);Human mitogen activated protein kinase(MAPK)ELISAKit(批号:CSB-E09147h,CUSABIO)。
1.1.5 仪器 MK3酶标仪(芬兰雷勃);Tanon-5200成像系统(Tanon);Agi1ent高通量测序仪(Agi1ent)。
1.2 方法
1.2.1 药物血清制备 13只雄性SPF级SD大鼠,随机分成含药血清组(8 只)与普通血清组(5 只),适应性饲养3 d后,含药血清组开始灌胃给药,1次/d,连续灌胃7 d,普通血清组采用等量生理盐水灌胃,1次/d,连续灌胃7 d。采血前禁食12 h,末次灌胃1 h后进行麻醉,腹主动脉取血,4 ℃静置4 h,3000 r/min 离心15 min分离血清,于56 ℃恒温水浴锅中30灭活血清,最后用微孔滤膜过滤除菌,-20 ℃分装保存备用。动物给药剂量的换算公式:临床用药量×动物等效剂量系数×培养基内血清稀释度[13]。
1.2.2 细胞培养与分组干预 参照文献方法[14],HAEC细胞,然后放入37 ℃,5%CO2,常氧(21%)的细胞培养箱中培养至3代(P3),然后随机分成常氧培养的HAECs及缺氧培养的HAECs。对缺氧培养的HAECs进行缺氧处理,即放入37 ℃,5%CO2,缺氧(2%)的细胞培养室按照设定的不同时间点进行培养。然后将培养好的细胞分成对照组(常氧培养的HAEC细胞+正常大鼠血清)、缺氧模型组(缺氧培养的HAEC细胞+正常大鼠血清)及给药组(缺氧培养的HAEC细胞+富心方含药血清),供高通量测序实验用。另将培养好的细胞分成下列各组供蛋白验证实验用:A组:常氧培养的HAEC细胞+正常大鼠血清;B组:常氧培养的HAEC细胞+1%富心方含药血清;C组:常氧培养的HAEC细胞+10%富心方含药血清;D组:缺氧培养的HAEC细胞+正常大鼠血清;E组:缺氧培养的HAEC细胞+1%富心方含药血清;F组:缺氧培养的HAEC细胞+10%富心方含药血清。
1.2.3 高通量RNA测序筛选差异基因 对各组样品提取RNA,反转录成cDNA,构建文库,产生DNA簇,采用Agi1ent高通量测序仪上机测序,进行数据分析。对得到的差异表达基因(DEGs)进行GO功能、京都基因与基因组百科全书数据库(KEGG)分析,确定富心方作用的靶基因及相关信号通路。基于AmiGO和String数据库筛选出已确认作用于内皮细胞损伤修复的DEGs,分析相互作用,并用于ELISA法和Western b1ot法对这些基因在各组的蛋白表达水平验证实验中。
1.2.4 ELISA 法测定c-Fos、NR4A1、p38MAPK 含量将各组HAECs以5×106/mL的密度接种于96孔板中,A组:常氧培养的HAEC细胞+正常大鼠血清;B组:常氧培养的HAEC细胞+1%富心方含药血清;C组:常氧培养的HAEC细胞+10%富心方含药血清;D组:缺氧培养的HAEC细胞+正常大鼠血清;E组:缺氧培养的HAEC细胞+1%富心方含药血清;F组:缺氧培养的HAEC细胞+10%富心方含药血清,各组持续观察处理24、48 h。收集各组上清液,按照ELISA试剂盒说明操作,检测各组HAEC细胞培养液上清中c-Fos、NR4A1、p38MAPK的表达。
1.2.5 Western b1ot法测定p38,p-p38蛋白表达 将需要抽提的蛋白的细胞洗涤、裂解、加热、离心后取上清;置于酶标板中测定吸光度并换算浓度;将蛋白转移至膜上并封闭后,加入第一抗体(p-p38 1∶1000、p38 1∶1000、GAPDH 1/2000),室温孵育2 h,用TBST洗涤3次,加入1∶1000稀释HRP标记的二抗,与膜37 ℃孵育1 h。用TBST 洗涤3 次,5 min/次。配制ECL 发光液,根据用量,取ECL发光液A和B等量混匀,加在膜的正面暗室避光5 min。倒掉显色液,用纸小心吸取显色液,在上面盖上一层平整的透明纸。将其放入成像系统中进行扫描、观察、分析p38,p-p38蛋白含量变化。
1.3 统计学处理方法
采用SPSS24.0统计软件进行数据分析,定量资料以均数±标准差表示,采用单因素方差分析,组间比较使用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析富心方改善内皮细胞损伤的靶点基因
2.1.1 通过高通量基因筛选和富心方作用有关的基因与对照组比较,缺氧模型组共有7134 个DEGs(1og2(fo1dchange)>1,P<0.05);与模型组比较,富心方给药组共有762个DEGs(1og2(fo1dchange)>1,P<0.05,表1);从二者交叉部分筛选出682个DEGs。对缺氧HAECs使用富心方后,缺氧条件下发生变化又能受到富心方调控的DEGs中既存在显著差异的上调基因也存在显著差异的下调基因。
2.1.2 GO富集分析 GO 分析显示,682个缺氧条件下发生变化又能受到富心方调控的DEGs中,缺氧作用可下调其中273个DEGs,且该273个DEGs在富心方作用后上调,这些DEGs涉及到522项GO-terms,其中生物学过程402项、细胞组成成分49项、分子功能71项,上述DEGs参与的各组基因功能中富集程度前20项(图1);缺氧作用下上调其中409个DEGs,且该409个DEGs在富心方作用后下调,这些DEGs 涉及到347 项GOterms,其中生物学过程222项、细胞组成成分30项、分子功能95项,上述DEGs参与的各组基因功能中富集程度前20项(图2)。

表1 高通量测序所得差异基因筛选结果Tab.1 Screening results of DEGs from high-throughput sequencing
2.1.3 通过KEGG分析与基因功能筛选富心方作用的靶基因 基于AmiGO(amigo.geneonto1ogy.org)和String(https://string-db.org/)数据库及文献检索对上述DEGs进行筛选,综合考虑DEGs的差异表达水平及现有对其与动脉粥样硬化相关程度的研究,确定了与动脉粥样硬化相关的73 个靶点基因(表2)。基于KEGG 数据库(https://www.kegg.jp),将73个靶点DEGs进行KEGG通路分析发现,其中大多数基因主要富集于MAPK信号通路(图3)及其关联通路,推测富心方调控内皮细胞损伤与MAPK信号通路有关,选择通路中差异表达水平最高的c-Fos、NR4A1、p38MAPK进行后续研究。


图1 GO富集分析显示受到缺氧作用下调后经富心方作用上调的DEGs 主要作用的生物学过程(A)、细胞组成成分(B)及分子功能(C)的GO-termsFig.1 Go enrichment analysis shows that BP(A),CC(B) and GO terms of MF (C) are the main effects of DEGs down-regulated by hypoxia and up-regulated by Fuxinfang. BP: Biological processes; CC:Composition of the cell;MF:Molecular functions.
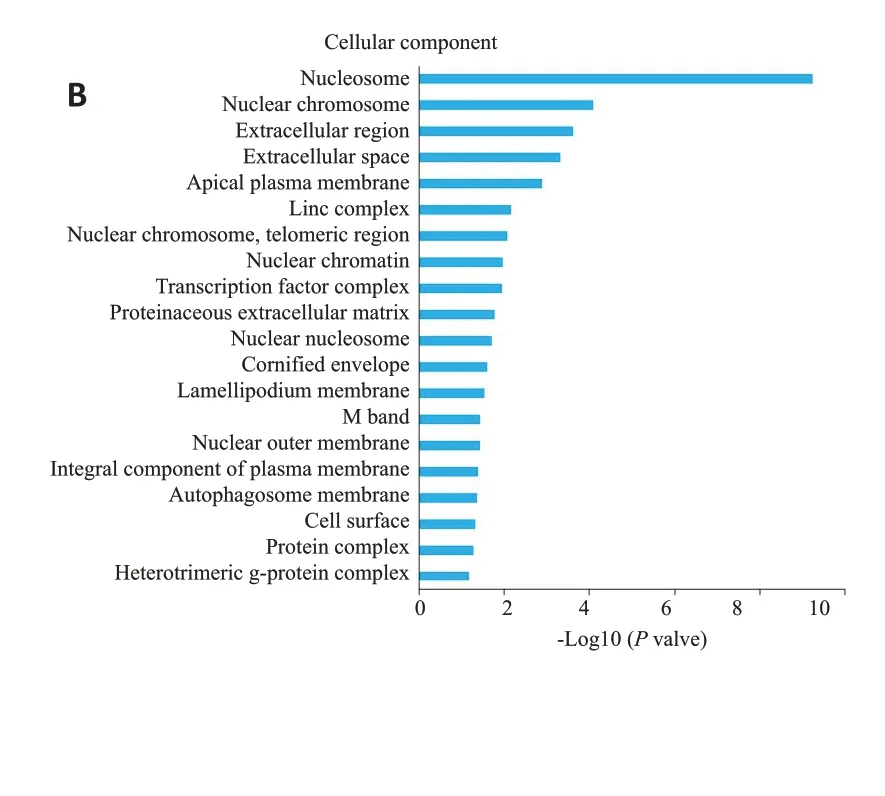
图2 GO富集分析显示受到缺氧作用上调后经富心方作用下调的DEGs主要作用的生物学过程(A)、细胞组成成分(B)及分子功能(C)的GO-termsFig.2 GO enrichment analysis shows that BP(A),CC(B)and go terms of MF(C)are the main effects of DEGs upregulated by hypoxia and down-regulated by Fuxinfang.BP: Biological processes; CC: Composition of the cell;MF:Molecular functions.
缺氧条件下的动脉内皮细胞中的c-Fos、NR4A1、p38MAPK的基因表达明显上调并和MAPK信号通路(图3)有关,然而富心方加入后这些缺氧处理过的内皮细胞中的c-Fos、NR4A1、p38MAPK基因表达出现明显下调(P<0.05)。
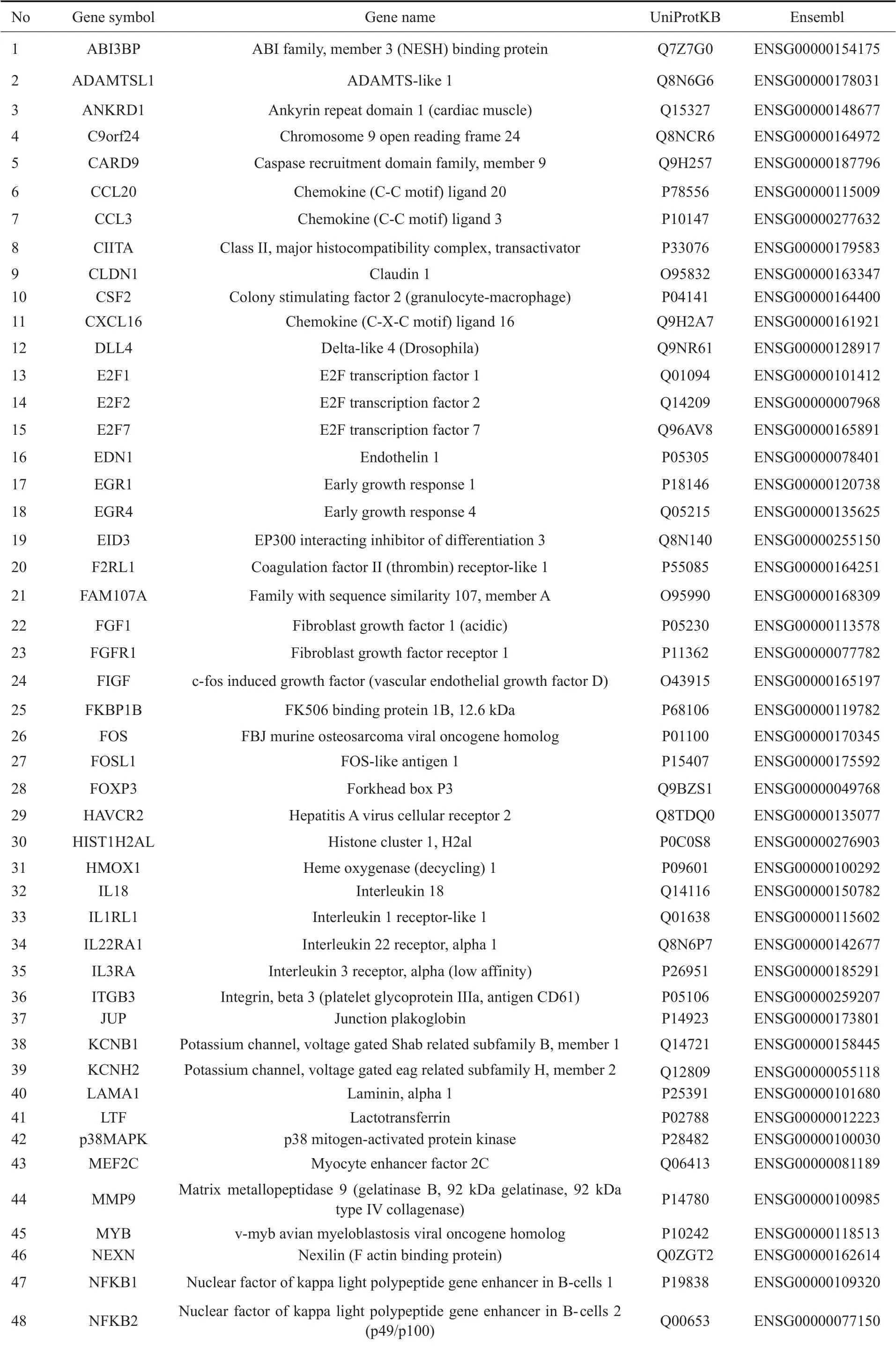
表2 高通量基因筛选所得与富心方逆转缺氧对内皮细胞损伤作用的靶基因Tab.2 Target genes screened by high-throughput gene screening involved in Fuxinfang-induced reverse of hypoxia damage in endothelial cells
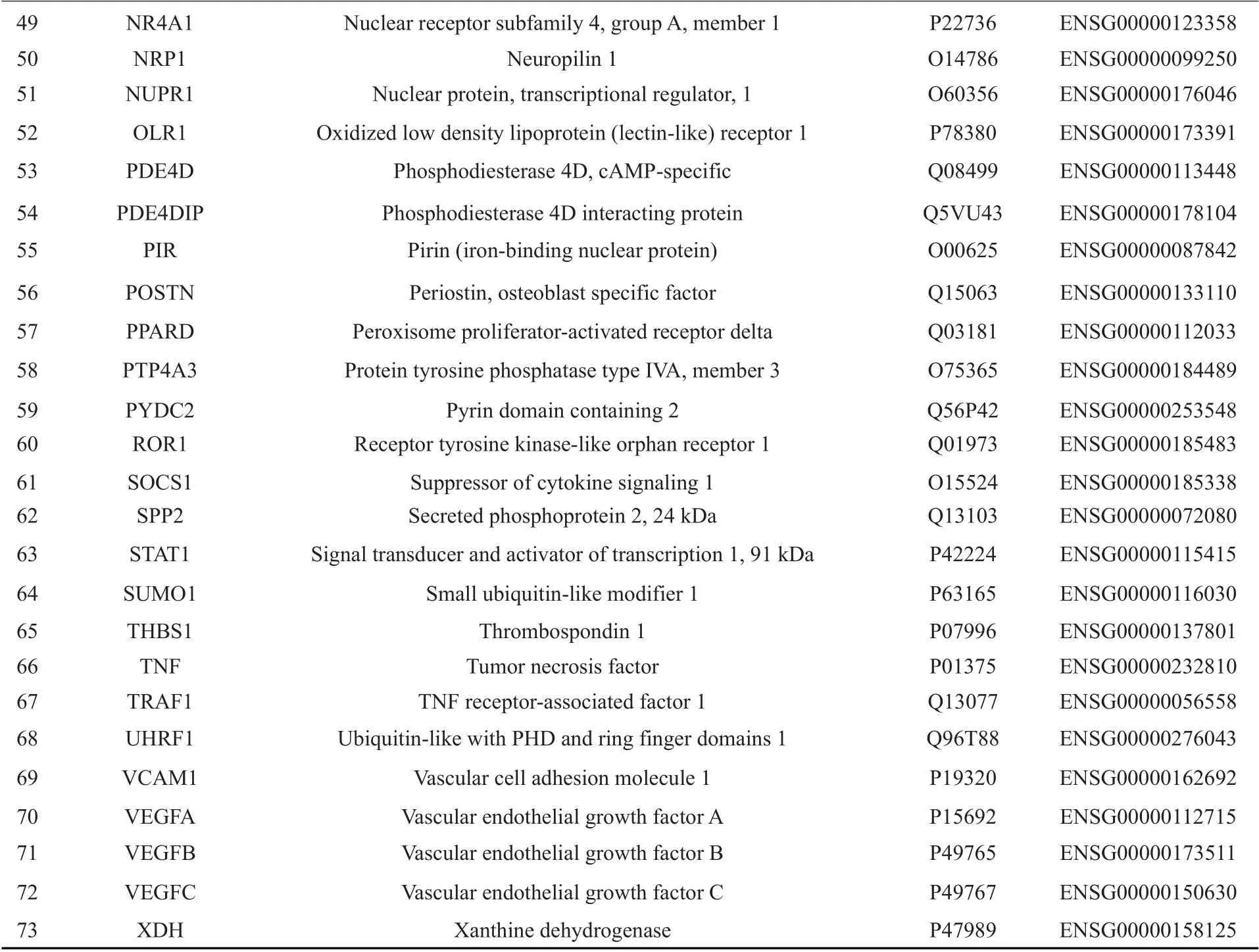
续表2

图3 MAPK信号通路图中c-Fos(AP-1)、NR4A1(Nur77)、p38MAPK基因主要参与的环节(红色标记)Fig.3 Key links(red)involving c-Fos(AP-1),NR4A1(Nur77)and p38MAPK genes in MAPK signal pathway.
将上述与富心方改善内皮细胞损伤相关的DEGs上传String数据库,通过Cytoscape v3.6.1软件构建蛋白质之间相互作用网络(PPI网络),分析富心方作用下HAECs中c-Fos、NR4A1及p38MAPK彼此相关性,及与其他DEGs 的相互作用(图4)。结果显示,c-Fos、NR4A1及p38MAPK显示最强的相关性(粉色),在这三色粉色的圆圈外围又有14个紫色的圆圈,其中包含很多和血管增生,血管损伤修复相关的基因的相关性。
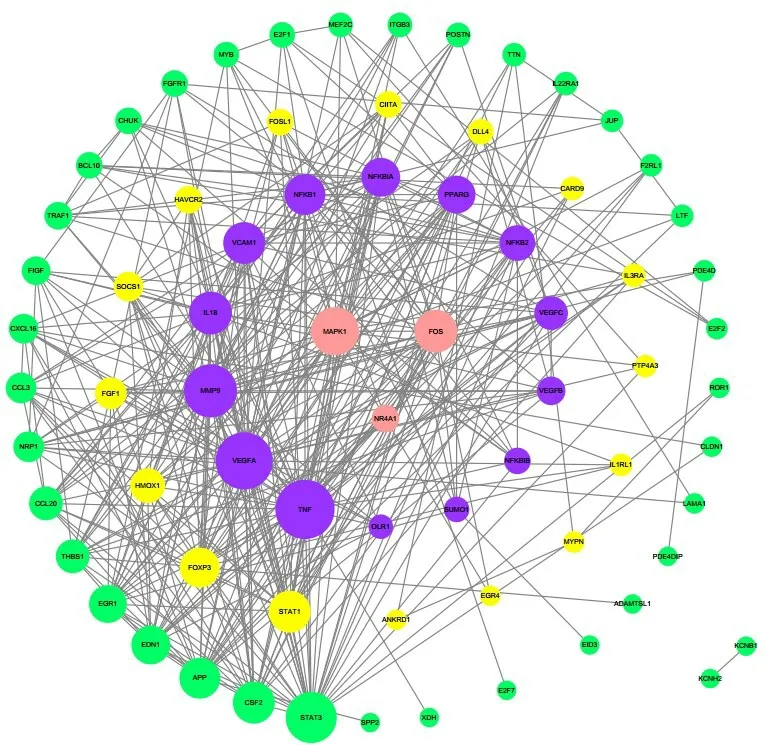
图4 富心方治疗后的差异基因的PPI网络Fig.4 PPI network of different genes after Fuxinfang treatment.The pink nodes are p38 (MAPK1), NR4A1 and c-Fos genes, and the purple,yellow and green nodes identify other important genes.
2.2 富心方对c-Fos-NR4A1-p38通路作用的体外实验验证
2.2.1 富心方对c-Fos、NR4A1、p38MAPK蛋白表达的影响 与对照组A组比较,B、C两组内c-Fos、NR4A1、p38MAPK蛋白表达水平未见明显变化,差异无统计学意义,而缺氧作用下HAECs中c-Fos、NR4A1、p38MAPK的表达显著升高(P<0.05,图5);与缺氧模型组比较,富心方含药血清干预2%O2缺氧处理的HAECs 24 h后,10%富心方含药血清能明显下调缺氧诱导的HAECs中c-Fos、p38MAPK的表达(P<0.05);富心方含药血清干预48 h后,1%、10%富心方含药血清均能明显下调缺氧诱导的HAECs中c-Fos、NR4A1、p38MAPK的表达(P<0.05)。与缺氧模型组比较,在相同给药时长下,10%富心方含药血清给药组中c-Fos、NR4A1、p38MAPK蛋白表达水平降低程度较1%富心方含药血清给药组更明显(P<0.05);在相同给药浓度下,给药48 h c-Fos、NR4A1、p38MAPK蛋白表达水平降低程度较给药24 h更明显(P<0.05)。
2.2.2 富心方对p38,p-p38蛋白表达的影响 与对照组A组比较,B、C两组内p38MAPK、p-p38MAPK蛋白表达水平未见明显变化,差异无统计学意义,而缺氧诱导HAEC细胞后p38MAPK磷酸化蛋白(p-p38)的表达水平显著增高(P<0.05,图6);与缺氧模型组比较,10%富心方含药血清剂量组能明显降低缺氧诱导的HAEC细胞p-p38MAPK蛋白的表达水平(P<0.05);与缺氧模型组比较,1%富心方含药血清剂量组内p-p38MAPK蛋白表达水平未见明显变化,差异无统计学意义;但是各组间p38MAPK蛋白表达未见明显变化,且差异无统计学意义。


图5 富 心 方 含 药 血 清 对c-Fos(A)、NR4A1(B)、p38MAPK(C)的影响Fig.5 Effect of Fuxinfang serum on c-Fos (A), NR4A1 (B),and p38MAPK (C) expressions. A: HAECs in normal culture. B: HAECs in normoxia treated with 1% Fuxinfang containing serum.C:HAECs in normoxia treated with 10%Fuxinfang containing serum.D:HAECs in hypoxic culture.E: HAECs in hypoxic culture treated with 1% Fuxinfang containing serum. F: HAECs in hypoxic culture treated with 10% Fuxinfang containing serum. *P<0.05 vs A;▲P<0.05 vs D.

图6 富心方含药血清对HAECs 中p38MAPK(A、C)、pp38MAPK(B、D)蛋白表达的影响Fig.6 Effect of Fuxinfang serum on c-Fos(A),NR4A1(B),and p38MAPK (C) expressions. A: HAECs in normal culture. B:HAECs in normoxia treated with 1% Fuxinfang containing serum. C: HAECs in normoxia treated with 10% Fuxinfang containing serum.D:HAECs in hypoxic culture.E:HAECs in hypoxic culture treated with 1% Fuxinfang containing serum.F: HAECs in hypoxic culture treated with 10% Fuxinfang containing serum.*P<0.05 vsA;▲P<0.05 vs D.
缺氧损伤后c-Fos、NR4A1、p38MAPK、p-p38MAPK表达上调,而不同浓度的富心方含药血清作用48 h后均可抑制缺氧造成的上调,与模型组比较具有统计学差异(图7)。
3 讨论
AS是一种慢性的复杂的炎性过程,过程中伴随着内皮细胞损伤[15]。目前公认AS是引起冠心病的主要原因,而内皮细胞损伤相关的一系列病变则被认为是AS的加剧因素[16-17]。c-Fos与NR4A1可以介导p38MAPK引发内皮细胞损伤、破坏内膜完整性,继发炎性反应、平滑肌细胞增生、泡沫细胞形成等各种病变,这些都会加速冠状动脉粥样硬化发生[18-19]。冠心病基本病机为“本虚标实”,本虚以心气亏虚,心血不足为主,标实以血瘀、痰浊为主[20]。冠心病的病情与动脉粥样硬化的程度直接相关。本研究所用“富心方”为海派中医丁氏内科第四代主要传承人、上海中医药大学附属曙光医院徐燕教授传承发扬流派特色,结合现代疾病谱变化,创制的临床治疗冠心病心绞痛的有效验方,该方具有补气活血、化痰通络的功效。本方以黄芪、三七为君,补气以行血,血行以载气;细辛、水蛭、降香三药为臣,分别发挥散寒通脉、破血逐瘀、化瘀理气之功效,以助君药活血化瘀止痛之效。本方气、血、痰同治,扶正、祛邪兼顾,共奏补气行血,消痰化瘀止痛之效。
之前关于p38MAPK与动脉粥样硬化的研究往往只观察p38MAPK对动脉粥样硬化与内皮细胞损伤的独立影响[21-23],而本次研究则率先发现了富心方介导c-Fos-NR4A1-p38通路对内皮细胞损伤作用的可能性。因此,为了验证本研究的假设,在我们建立的缺氧诱导HAECs损伤模型中,初步探讨了缺氧与内皮细胞损伤之间的关系,以及加入富心方后的对c-Fos-NR4A1-p38通路的调控作用,说明了富心方改善受损HAECs的作用机制。

图7 富心方在HAECs中介导c-Fos-NR4A1-p38通路的细胞通路示意图Fig.7 Schematic diagram of c-Fos-NR4A1-p38 pathway mediated by Fuxinfang in HAECs.Fuxinfang can improve HAECs injury by inhibiting the expression of c-Fos and affecting the regulation of NR4A1 by p38MAPK.
实验结果提示c-Fos、NR4A1、p38MAPK在缺氧条件下明显上调,富心方则可以逆转缺氧诱导的上调。既往研究发现,c-Fos受缺氧应激调控与活化的c-Jun氨基末端激酶(JNK)形成复合物AP-1[24-25],AP-1结合到位于NR4A1 启动子上的AP-1 反应元件,提高NR4A1在转录水平的表达[26-28]。与AP-1结合后的NR4A1可以通过影响NF-κB 及其激酶IκB 激酶i(IKKi)、NF-κB 诱导激酶(NIK)的表达发挥调控p38MAPK促内皮损伤的能力[29-30]。该作用可以催生易破裂的新生血管、促进脂质及各种炎细胞浸润、诱发斑块内出血、破坏内膜完整性,造成内皮细胞损伤,从而促进动脉粥样硬化病变的发展[19,31-33]。有验证实验表明使用MAPK抑制剂可以抑制c-Fos-NR4A1-p38通路对内皮细胞损伤作用的[34-35]。所以我们推测,受缺氧应激诱导,c-Fos-NR4A1-p38通路活化促进内皮细胞损伤,加重冠状动脉粥样硬化,并提出富心方可以通过有效抑制c-Fos-NR4A1-p38通路改善内皮细胞损伤的假设。
内皮细胞损伤是一个复杂的过程,c-Fos-NR4A1-p38通路在这其中发挥了重要作用[36]。为验证富心方对内皮细胞的保护作用是否涉及到c-Fos-NR4A1-p38通路,我们检测了各组c-Fos、NR4A1、p38MAPK、p-p38MAPK的蛋白表达,发现缺氧损伤后c-Fos、NR4A1、p38MAPK、p-p38MAPK表达上调,而不同浓度的富心方含药血清作用48 h后均可抑制缺氧造成的上调,与模型组比较具有统计学差异,提示富心方可能通过c-Fos-NR4A1-p38通路抑制缺氧诱导的内皮细胞损伤。
其次,不同浓度、给药时间造成的药效改变也是必须考虑的因素。给药24 h情况下,仅10%富心方含药血清组下调的缺氧诱导的c-Fos、p38MAPK表达有统计学差异,且该组c-Fos、p38MAPK表达抑制的程度较48 h 10%富心方含药血清组更小,推测富心方调控c-Fos-NR4A1-p38通路的作用存在时间依赖性;在给药48 h情况下,1%富心方含药血清逆转的缺氧诱导的c-Fos、NR4A1、p38MAPK、p-p38MAPK蛋白表达程度较10%富心方含药血清的效果更小,推测富心方调控c-Fos-NR4A1-p38通路的作用存在浓度依赖性。
富心方含药血清虽然对p38MAPK的直接影响不强,但p38MAPK是经由磷酸化为p-p38MAPK来实际发挥对内皮细胞的损伤作用,故而抑制p-p38MAPK的表达才可以切实的改善内皮细胞损伤[37]。本实验结果也证实富心方含药血清可以抑制p38MAPK磷酸化为p-p38MAPK,阻止p38MAPK对内皮细胞的损伤。从c-Fos和NR4A1表达量改变趋势看,符合推论。另一方面,本研究尚未对“富心方调控c-Fos-NR4A1-p38通路”假设进行更详细的求证研究,包括阻断c-Fos表达是否可以观察到富心方改善内皮细胞损伤作用的下降等。此外,本研究首次验证了富心方具有的多靶点作用和介导c-Fos-NR4A1-p38通路作用于缺氧受损的内皮细胞。
综上所述,缺氧应激可诱导HEAC细胞的c-Fos、NR4A1、p-p38MAPK基因及蛋白表达,从而促进血管内皮细胞损伤。验证了富心方对c-Fos-NR4A1-p38通路的影响,说明了富心方对于冠心病动脉粥样硬化患者的内皮修复作用,至少是通过c-Fos-NR4A1-p38改善内皮细胞的缺氧损伤,为在临床上广泛应用此方防治冠心病提供了理论支持。