榄香烯对人肺癌A549 细胞系耐顺铂细胞株多药耐药的改善作用及机制研究
2021-02-27李全志刘志强赵玉霞孙太振
李全志 刘志强 赵玉霞 孙太振
1.开封市肿瘤医院 河南,开封 475000 2.河南大学淮河医院 3.河南省肿瘤医院
目前肺癌仍是全球性的健康问题, 每年约210万人被确诊为肺癌,约180万人死于肺癌[1]。 肺癌治疗包括手术、放化疗、靶向治疗和支持治疗等方法,化疗已经成为临床治疗肺癌的主要手段, 其中顺铂(cisplatin,DDP)是肺癌化疗中最常用的药物[2-3]。 然而,化疗药物耐药是肺癌治疗过程中的一个严重问题,往往导致患者生存期缩短,生存质量降低[4]。 因此,研究肺癌耐药机制,寻找抑制和减少肿瘤细胞多药耐药产生的药物成为目前肺癌研究中亟待解决的问题。
榄香烯(elemene,ELE)是姜科植物温莪术(郁金)的萜烯类有效活性成分, 主要包括β-ELE、γ-ELE和δ-ELE 3种成分,其中β-ELE已被证明具有较强的抗癌活性,ELE注射液已被广泛应用于恶性肿瘤的辅助治疗,取得了较好的治疗效果[5-6]。研究证明,ELE对肿瘤细胞化疗及放疗耐药性具有一定的抑制作用,但其作用机制尚不清楚[7]。 磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,AKT)信号通路与肿瘤细胞的生长增殖、代谢和耐药性的产生有着紧密联系, 研究认为调节该信号通路关键蛋白的表达可能成为治疗肿瘤的新途径[8]。因此,本研究以PI3K/AKT信号通路为切入点,观察ELE对人肺癌A549细胞系耐药性的改善作用,初步探究其作用机制。
1 材料和方法
1.1 细胞 人肺癌A549/DDP耐顺铂细胞株购于中科院上海细胞库。 细胞培养在含有10%胎牛血清的洛斯维尔帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基中,培养条件为5%CO2、37℃。每2~3d传代一次,取对数生长期的细胞用于实验。
1.2 试剂与仪器 ELE注射液购于大连华立金港药业有限公司(批号:1009171);DDP购于美国Sigma-Aldrich公司(批号:P4394);RPMI 1640培养基、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)染色试剂盒、Transwell小室、基质胶、结晶紫染液、胎牛血清、青链霉素混合液(100×)、胰蛋白酶-乙二胺四乙酸(ethylene diamine tetra acetic acid,EDTA) 消化液、苯甲基磺酰氟(phenylmethyl sulfonyl fluoride,PMSF)、脱脂奶粉、 聚偏氟乙烯(polyvinylidene fluoride,PVDF) 转印膜均购于北京索莱宝科技有限公司(批号:31800、M1020、3422、356234、G1062、11011-8611、P1400、T1300、P0100、D8340、ISEQ00010);RevertAidTMfirst Strand cDNA Synthesis Kit 购于美国Thermo Scientific公司(批号:K1622);B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X,Bax)、肺耐药相关蛋白(lung resistance-related protein,LRP)、 磷酸化磷脂酰肌醇-3-激酶(phosphorylated-phosphatidylinositol-3-kinase,p-PI3K)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 兔源单克隆抗体均购于美国Invitrogen 公 司( 批 号:MA5-11757、33-6400、MA5-31959、PA5-104853、PA1-16777); 多药耐药基因1(multidrug resistance gene 1,MDR1)、磷酸化蛋白激酶B(phosphorylated-protein kinase B,p-AKT)兔源单克隆抗体购于美国CST公司(批号:13342、4060);羊抗兔二抗购于达文生物有限公司(批号:DW-GAR007)。IX53显微镜为日本奥林巴斯公司产品;G:BOX多功能凝胶成像系统购于美国Syngene公司。
1.3 方法
1.3.1 MTT法检测不同浓度ELE对A549/DDP细胞增殖能力的影响 收集对数生长期的A549/DDP细胞,以3×103个/孔的浓度接种于96孔板中, 继续培养24h后换液。 将细胞分为A549/DDP组(正常培养基培养)和ELE组(含有10、20、40、80、160μg·mL-1ELE的培养基培养),每组设有5个复孔。 孵育24、48、72h后,加入5mg·mL-1MTT溶液20μL,37℃孵育4h后弃去上清液,加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μL,充分振荡混匀后在490nm波长下检测吸光度(optical density,OD),细胞增殖率(%)=(ODELE组-OD空白孔)/(ODA549/DDP组-OD空白孔)×100%。
1.3.2 MTT法检测不同浓度ELE对A549/DDP细胞化疗药物耐药性的影响 细胞收集处理同1.3.1,将细胞分为A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组。 A549/DDP+DDP组加入含DDP的培养基,DDP浓度为0、2、4、8、16、32μg·mL-1;A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组在加入上述浓度DDP的基础上,分别再加入含20μg·mL-1和40μg·mL-1ELE的培养基,每孔100μL,每组设有5个复孔,培养48h后加入MTT溶液37℃孵育4h,弃去上清液,加入DMSO 150μL充分振荡混匀,490nm波长下检测OD值, 计算各组细胞增殖率和药物半数抑制浓度(50%inhibiting concentration,IC50)。
1.3.3 ELE对A549/DDP细胞侵袭能力的影响 将细胞分为A549/DDP组、A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组。 A549/DDP组细胞以常规培养基培养,A549/DDP+DDP组以含4μg·mL-1DDP的培养基培养,A549/DDP+DDP+20μg·mL-1ELE组以含4μg·mL-1DDP和终浓度为20μg·mL-1ELE的培养基培养,A549/DDP+DDP+40μg·mL-1ELE组以含有4μg·mL-1DDP和终浓度为40μg·mL-1ELE的培养基培养。 培养48h后,收集各组细胞,按照2×104个/孔的浓度接种于铺有基质胶的Transwell上室,每孔200μL,下室加入600μL的RPMI 1640完全培养基,继续培养12h,取出上室,以甲醇固定20min, 棉签擦掉上室残余细胞,1%结晶紫染色15min,磷酸盐缓冲溶液(phosphate buffered solution,PBS)冲洗2遍,置于显微镜下观察,选取4个高倍视野进行细胞计数,取平均值。
1.3.4 逆转录聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR)法检测A549/DDP细胞中Bax和Bcl-2 mRNA的表达水平 细胞分组和处理同1.3.3。 收集各组细胞,加入适量Trizol裂解液提取细胞总RNA, 使用RevertAidTMfirst Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA,作为荧光定量模版。 引物由日本Takara 公司设计合成,引物序列见表1。 反应体系:dNTPs 0.5μL+5×Buffer 5μL+Taq酶0.3μL+MgCl21.5μL+cDNA模板2μL+上下游引物各1μL,加去离子水至总体积25μL。反应条件为:95℃预变性5min,95℃变性30s、62℃退火30s、72℃延伸30s,共40个循环, 最后72℃延伸10min,4℃5min终止反应,实验重复3次。 采用2-△△CT法计算目的基因mRNA相对表达水平。
1.3.5 Western blot检测A549/DDP细胞中MDR1、LRP和PI3K/AKT信号通路相关蛋白表达水平 细胞分组和处理同1.3.3。 收集各组细胞,加入蛋白裂解液冰上裂解20min,离心取上清液,以二辛可酸(bicinchoninicacid,BCA)法测定蛋白浓度,电泳、转膜后,以脱脂奶粉封闭,封闭结束加入MDR1、LRP、p-PI3K、p-AKT一抗稀释液(稀释比例均为1∶2 000),4℃过夜, 洗涤3次,加入羊抗兔二抗孵育2h(稀释比例为1∶1 000),洗涤3次,滴加电化学(electrochemiluminescence,ECL)发光液,置于凝胶成像系统显影。 以Image J软件分析各个蛋白对应的灰度值, 计算蛋白相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
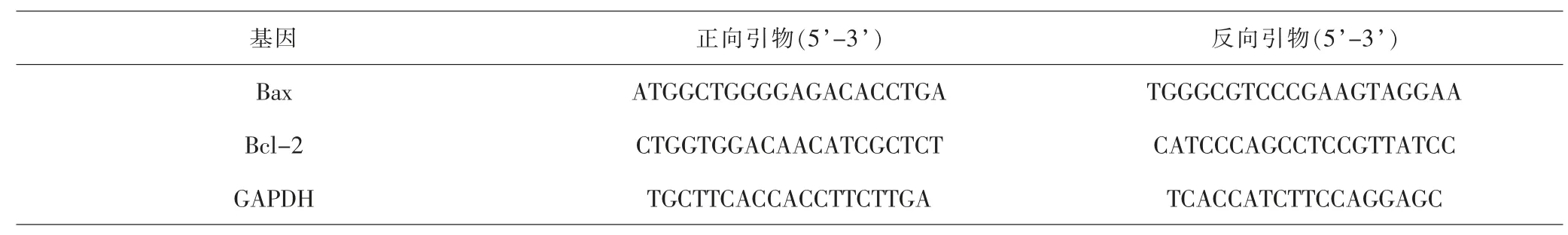
表1 引物序列Tab.1 Primer sequences
1.4 统计学分析 应用SPSS 25.0统计软件进行统计学分析,以GraphPad Prism 8.0作图。计量资料以x±s表示,多样本比较采用单因素方差分析,两样本比较采用纽曼-科伊尔斯检验(Student-Newman-Keuls,SNK-q)。 以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较 ELE处理24h后,与A549/DDP组比较,10、20μg·mL-1ELE组细胞增殖能力差异无统计学意义(均P>0.05),40、80、160μg·mL-1ELE组细胞的增殖能力降低(均P<0.05),呈剂量依赖性。 处理48h后,与A549/DDP组比较,10μg·mL-1ELE组细胞增殖能力差异无统计学意义(P>0.05),20、40、80、160μg·mL-1ELE组细胞增殖能力呈剂量依赖性降低(均P<0.05)。 处理72h后,与A549/DDP组比较,10、20、40、80、160μg·mL-1ELE组细胞的增殖能力呈剂量依赖性降低(均P<0.05)。 采用10μg·mL-1ELE处理A549/DDP细胞,处理24、48、72h的增殖能力差异无统计学意义(均P>0.05);采用20μg·mL-1ELE处理细胞,48h时细胞增殖能力低于24h,72h时增殖能力低于24h,但差异均无统计学意义(均P>0.05),72h时细胞的增殖能力显著低于24h(P<0.05); 采用40μg·mL-1ELE处理细胞,48h时细胞的增殖能力低于24h, 但差异无统计学意义(P>0.05),72h时细胞的增殖能力显著低于24h和48h(均P<0.05);采用80和160μg·mL-1ELE处理细胞,48h时细胞的增殖能力显著低于24h(均P<0.05),72h时细胞的增殖能力显著低于24h和48h(均P<0.05)。 见表2。
2.2 各组细胞化疗药物耐药性比较 DDP对A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞的IC50分别为(17.63±1.04)μg·mL-1、(10.65±0.78)μg·mL-1、(4.13±0.89)μg·mL-1。 与A549/DDP+DDP 组 比 较,DDP 对A549/DDP+DDP+20μg·mL-1ELE 组 和A549/DDP+DDP+40μg·mL-1ELE 组 细 胞 的IC50均 降 低(均P <0.05);与A549/DDP+DDP+20μg·mL-1ELE组比较,DDP对A549/DDP+DDP+40μg·mL-1ELE组细胞的IC50降低(P<0.05)。 随着DDP浓度的增加,DDP对A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞的增殖抑制作用增强,差异均有统计学意义(均P<0.05)。在相同浓度DDP作用下, 与A549/DDP+DDP组比较,A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞的增殖抑制能力增强,细胞增殖率下降,而且A549/DDP+DDP+20μg·mL-1ELE组细胞增殖率低于A549/DDP+DDP+40μg·mL-1ELE组(均P<0.05)。 见表3。
表2 不同时间点各组细胞的增殖率比较(±s,%)Tab.2 Comparison of cell proliferation rates of each group at different time points (x±s, %)
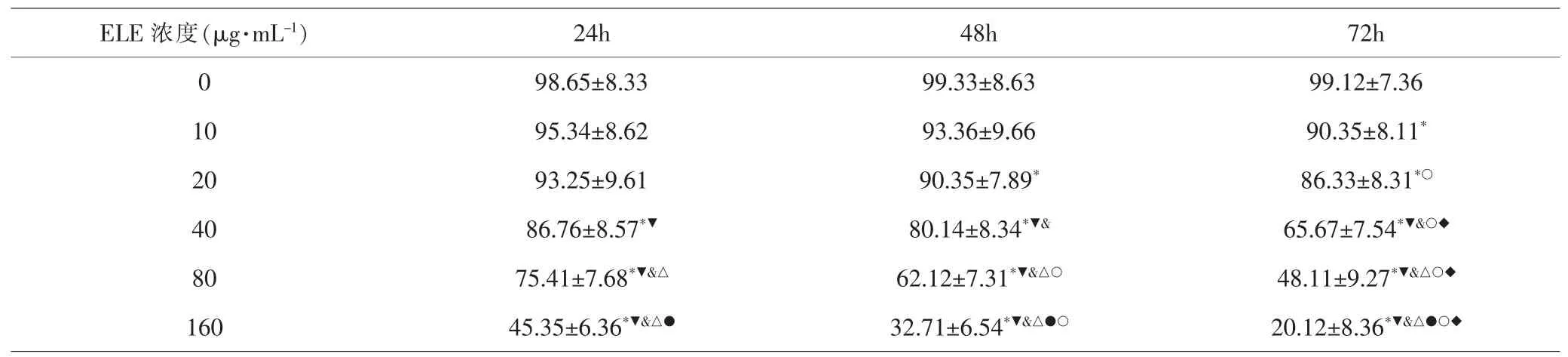
表2 不同时间点各组细胞的增殖率比较(±s,%)Tab.2 Comparison of cell proliferation rates of each group at different time points (x±s, %)
注:与A549/DDP组(ELE浓度0μg·mL-1)比较,*P<0.05;与10μg·mL-1 ELE组比较,▼P<0.05;与20μg·mL-1 ELE组比较,&P<0.05;与40μg·mL-1 ELE组比较,△P<0.05;与80μg·mL-1 ELE组比较,●P<0.05;与相同浓度24h比较,○P<0.05;与相同浓度48h比较,◆P<0.05Note: Compared with A549/DDP group(concentration of ELE was 0μg·mL-1), *P<0.05; compared with 10μg·mL-1 ELE group, ▼P<0.05;compared with 20μg·mL-1 ELE group, &P<0.05; compared with 40μg·mL-1 ELE group, △P<0.05; compared with 80μg·mL-1 ELE group, ●P<0.05;compared with the same concentration of 24h, ○P<0.05; compared with the same concentration of 48h, ◆P<0.05
ELE 浓度(μg·mL-1) 24h 48h 72h 0 98.65±8.33 99.33±8.63 99.12±7.36 10 95.34±8.62 93.36±9.66 90.35±8.11*20 93.25±9.61 90.35±7.89* 86.33±8.31*○40 86.76±8.57*▼ 80.14±8.34*▼& 65.67±7.54*▼&○◆80 75.41±7.68*▼&△ 62.12±7.31*▼&△○ 48.11±9.27*▼&△○◆160 45.35±6.36*▼&△● 32.71±6.54*▼&△●○ 20.12±8.36*▼&△●○◆
2.3 各组细胞侵袭能力比较 与A549/DDP组比较,A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞的穿膜数量均减少(P<0.05,P<0.05,P<0.01);与A549/DDP+DDP 组 比 较,A549/DDP+DDP+20μg·mL-1ELE 组 和A549/DDP+DDP+40μg·mL-1ELE组细胞的穿膜细胞数量显著减少(P<0.05,P<0.01), 其中A549/DDP+DDP+40μg·mL-1ELE组细胞的穿膜细胞数量低于A549/DDP+DDP+20μg·mL-1ELE组(P<0.05)。 见图1、2。
2.4 各组细胞中Bax和Bcl-2 mRNA表达水平比较 与A549/DDP 组 比 较,A549/DDP+DDP 组、A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE 组 细 胞Bax mRNA 表 达 水 平 升 高(均P<0.05),Bcl-2 mRNA 表 达 水 平 降 低(均P<0.05); 与A549/DDP+DDP组比较,A549/DDP+DDP+20μg·mL-1ELE组 和A549/DDP+DDP+40μg·mL-1ELE 组 细 胞Bax mRNA表达水平升高(均P<0.05),Bcl-2 mRNA表达水平降低(均P<0.05);进一步比较,A549/DDP+DDP+40μg·mL-1ELE组细胞Bax mRNA表达水平高于A549/DDP+DDP+20μg·mL-1ELE组(P<0.05),Bcl-2 mRNA表 达 水 平 低 于A549/DDP+DDP+20μg·mL-1ELE 组(P<0.05)。 见表4。
表3 不同浓度DDP处理后各组细胞的增殖率比较(±s,%)Tab.3 Comparison of cell proliferation rates in each group after treatment with different concentrations of DDP(±s,%)
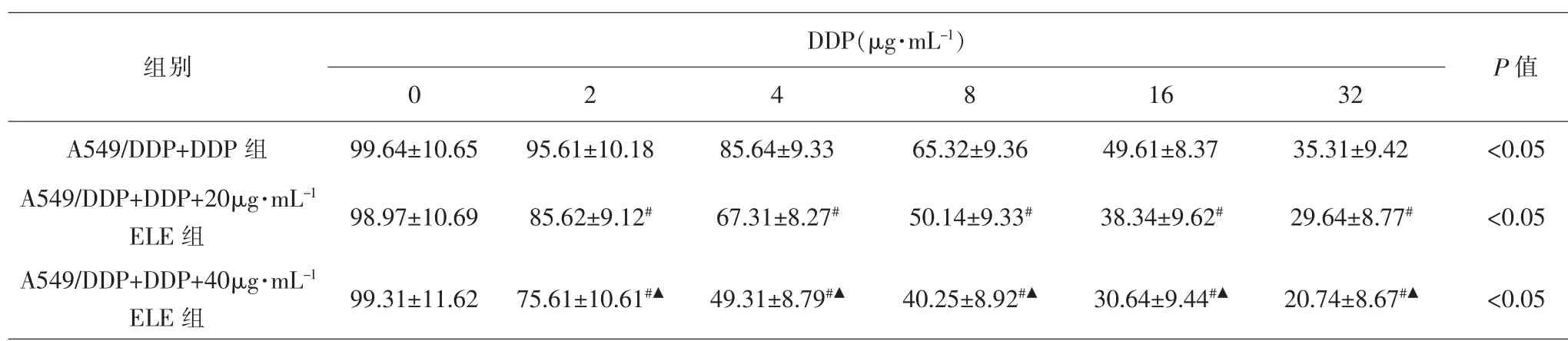
表3 不同浓度DDP处理后各组细胞的增殖率比较(±s,%)Tab.3 Comparison of cell proliferation rates in each group after treatment with different concentrations of DDP(±s,%)
注:与A549/DDP+DDP组比较,#P<0.05;与A549/DDP+DDP+20μg·mL-1 ELE组比较,▲P<0.05Note: Compared with A549/DDP+DDP group, #P<0.05; compared with A549/DDP+DDP+20μg·mL-1 ELE group,▲P<0.05
DDP(μg·mL-1)组别16 32 A549/DDP+DDP 组 99.64±10.65 95.61±10.18 85.64±9.33 65.32±9.36 49.61±8.37 35.31±9.42 <0.05 A549/DDP+DDP+20μg·mL-1 ELE 组A549/DDP+DDP+40μg·mL-1 ELE 组0 2 4 8 P 值98.97±10.69 85.62±9.12#67.31±8.27#50.14±9.33#38.34±9.62#29.64±8.77#<0.05 99.31±11.62 75.61±10.61#▲49.31±8.79#▲40.25±8.92#▲30.64±9.44#▲20.74±8.67#▲<0.05
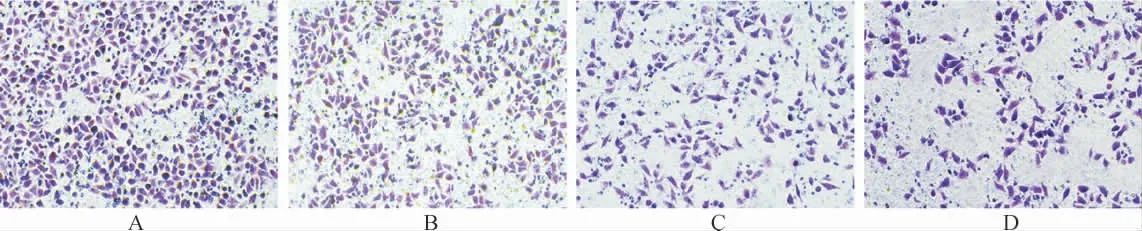
图1 Transwell法检测ELE对A549/DDP细胞侵袭能力的影响(结晶紫染色,400×)Fig.1 Transwell method to detect the influence of ELE on the invasion ability of A549/DDP cells(crystal violet staining,400×)

图2 各组细胞侵袭能力的比较Fig.2 Comparison of cell invasion ability in each group
2.5 各组细胞MDR1、LRP及PI3K/AKT信号通路蛋白表达比较 与A549/DDP组比较,A549/DDP+DDP组、A549/DDP+DDP+20μg·mL-1ELE 组 和A549/DDP+DDP+40μg·mL-1ELE组细胞中MDR1、LRP、p-PI3K和p-AKT蛋白相对表达水平显著降低(均P<0.05);与A549/DDP+DDP组比较,A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞中MDR1、LRP、p-PI3K和p-AKT蛋白相对表达水平显著降低(均P<0.05);进一步比较,A549/DDP+DDP+40μg·mL-1ELE组细胞MDR1、LRP、p-PI3K和p-AKT蛋白相对表达水平低于A549/DDP+DDP+20μg·mL-1ELE组(均P<0.05)。 见图3、表5。
表4 各组细胞Bax和Bcl-2 mRNA表达水平比较(±s)Tab.4 Comparison of Bax and Bcl-2 mRNA expression levels in each group(x±s)
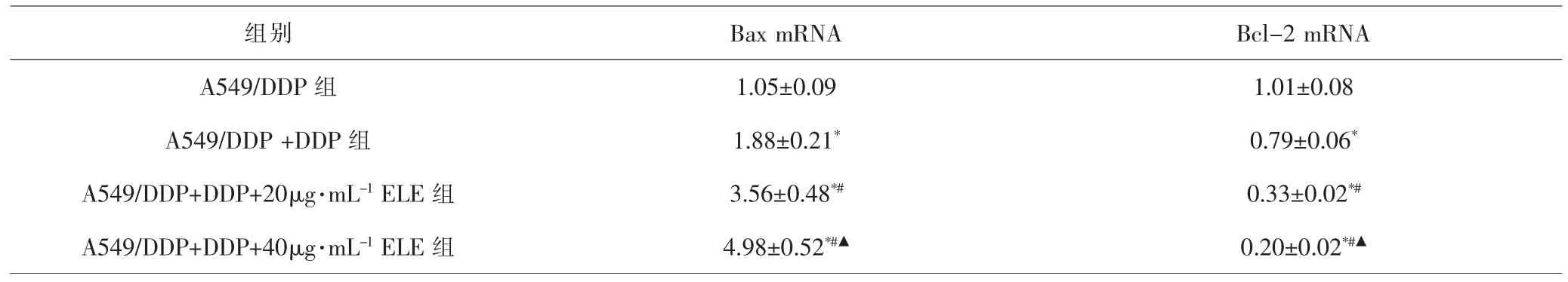
表4 各组细胞Bax和Bcl-2 mRNA表达水平比较(±s)Tab.4 Comparison of Bax and Bcl-2 mRNA expression levels in each group(x±s)
注:与A549/DDP组比较,*P<0.05;与A549/DDP+DDP组比较,#P<0.05;与A549/DDP+DDP+20μg·mL-1 ELE组比较,▲P<0.05Note: Compared with A549/DDP group, *P<0.05; compared with A549/DDP+DDP group, #P<0.05; compared with A549/DDP+DDP+20μg·mL-1 ELE group, ▲P<0.05
组别 Bax mRNA Bcl-2 mRNA A549/DDP 组 1.05±0.09 1.01±0.08 A549/DDP +DDP 组 1.88±0.21* 0.79±0.06*A549/DDP+DDP+20μg·mL-1 ELE 组 3.56±0.48*# 0.33±0.02*#A549/DDP+DDP+40μg·mL-1 ELE 组 4.98±0.52*#▲ 0.20±0.02*#▲
3 讨论

图3 Western blot检测各组A549/DDP细胞MDR1、LRP及PI3K/AKT信号通路蛋白表达Fig.3 Western blot detection of MDR1, LRP and PI3K/AKT signaling pathway protein expression in each group
肺癌是最常见的恶性肿瘤之一,在过去的几十年中,尽管新的治疗方法和药物不断涌现,但肺癌患者的预后仍然不佳,5年生存率仅为15%,其主要原因是部分肿瘤细胞早期获得了化疗药物耐药性,耐药的原因包括药物吸收不良、细胞周期改变、细胞代谢相关基因失调等[9-10]。近年来研究发现,PI3K/AKT信号通路与肿瘤细胞的生长增殖、代谢和耐药性的产生有紧密联系,可通过其上下游分子水平的改变来调控多种细胞生物的过程,PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和PI3K/Akt/核因子-κB(nuclear factor-κB,NF-κB)等信号通路已被证明与肿瘤的增殖侵袭密切相关,下调AKT的表达水平可诱导肿瘤细胞凋亡, 而PI3K基因突变可导致肿瘤细胞对表皮生长因子受体(epithelial growth factor receptor,EGFR)抑制剂产生耐药性[11-12]。 温莪术(郁金)的主要活性成分ELE具有显著抗肿瘤作用,现已被广泛用于恶性肿瘤的临床治疗,其机制包括诱导细胞凋亡,阻滞细胞周期,抑制肿瘤血管新生和细胞迁移, 并可通过降低线粒体膜电位激活细胞内氧化还原系统,增加细胞对放化疗的敏感性,逆转多药耐药[13-15]。目前,虽已有研究报道ELE对人肺癌A549细胞多药耐药性具有抑制作用,但其逆转多药耐药性的作用机制尚不清晰, 因此本研究以PI3K/AKT信号通路为切入点,观察不同浓度ELE对人肺癌A549细胞系多药耐药的改善作用,并初步探究其作用机制。
本研究结果显示, 采用不同浓度的ELE处理A549/DDP细胞, 与A549/DDP组比较,10、20、40、80、160μg·mL-1的ELE作用24、48、72h后,A549/DDP细胞的增殖能力均降低,呈显著剂量依赖性。 作用48h后,20μg·mL-1和40μg·mL-1ELE组A549/DDP细胞的增殖率分别为(90.35±7.89)%和(80.14±8.34)%,因此本研究选择对细胞抑制率不超过20%的20μg·mL-1和40μg·mL-1浓度进行后续实验。 结果显示,与A549/DDP组比较,20μg·mL-1和40μg·mL-1ELE分别联合DDP处理细胞 后,A549/DDP+DDP+20μg·mL-1ELE 组 和A549/DDP+DDP+40μg·mL-1ELE组细胞对DDP的敏感性显著增加,提示ELE可以降低A549/DDP细胞对DDP的耐药性。 为了观察ELE对A549/DDP侵袭能力的影响,采用Transwell法检测细胞的侵袭能力。 结果显示,与单独使用DDP比较,A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞的穿膜细胞数量显著减少,其中40μg·mL-1ELE与DDP联合比20μg·mL-1ELE与DDP联合对细胞侵袭能力的抑制作用更强,表明ELE还可以增加DDP对A549/DDP细胞侵袭能力的抑制作用。
表5 各组细胞蛋白相对表达水平比较(±s)Tab.5 Comparison of relative protein expression levels of cells in each group(x±s)
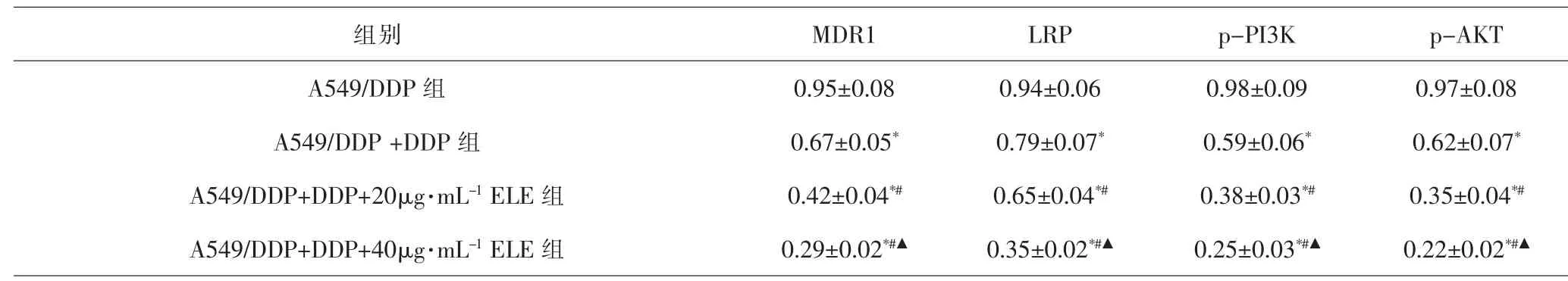
表5 各组细胞蛋白相对表达水平比较(±s)Tab.5 Comparison of relative protein expression levels of cells in each group(x±s)
注:与A549/DDP组比较,*P<0.05;与A549/DDP+DDP组比较,#P<0.05;与A549/DDP+DDP+20μg·mL-1 ELE组比较,▲P<0.05Note: Compared with A549/DDP group, *P<0.05; compared with A549/DDP+DDP group, #P<0.05; compared with A549/DDP+DDP+20μg·mL-1 ELE group, ▲P<0.05
组别 MDR1 LRP p-PI3K p-AKT A549/DDP 组 0.95±0.08 0.94±0.06 0.98±0.09 0.97±0.08 A549/DDP +DDP 组 0.67±0.05* 0.79±0.07* 0.59±0.06* 0.62±0.07*A549/DDP+DDP+20μg·mL-1 ELE 组 0.42±0.04*# 0.65±0.04*# 0.38±0.03*# 0.35±0.04*#A549/DDP+DDP+40μg·mL-1 ELE 组 0.29±0.02*#▲ 0.35±0.02*#▲ 0.25±0.03*#▲ 0.22±0.02*#▲
肺癌细胞的凋亡受到多种基因的调控,Bcl-2和Bax是调控细胞凋亡的关键基因,Bax过表达可促进细胞凋亡,而Bcl-2可与Bax形成二聚体,抑制Bax基因的表达,从而抑制细胞凋亡[16-17]。 RT-PCR结果显示,与A549/DDP+DDP组比较,A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞Bax mRNA表达水平均升高,Bcl-2 mRNA表达水平降低,其 中A549/DDP+DDP+40μg·mL-1ELE 组 细 胞Bax mRNA 表 达 水 平 高 于A549/DDP+DDP+20μg·mL-1ELE组, 而Bcl-2 mRNA表达水平则低于后者, 表明ELE可以促进DDP诱导的A549/DDP细胞凋亡。
PI3K/AKT信号通路贯穿于非小细胞肺癌的发生发展过程,该信号通路的活化可激活下游多种信号通路,促进肿瘤的发展和耐药性的产生[18]。 Western blot检测结果显示,与A549/DDP+DDP组比较,A549/DDP+DDP+20μg·mL-1ELE组和A549/DDP+DDP+40μg·mL-1ELE组细胞MDR1、LRP、p-PI3K和p-AKT蛋白相对表达水平显著降低, 进一步比较提示A549/DDP+DDP+40μg·mL-1ELE组细胞MDR1、LRP、p-PI3K和p-AKT蛋白相对表达水平低于A549/DDP+DDP+20μg·mL-1ELE组,表明ELE可以逆转A549/DDP细胞对DDP的耐药性,同时能够抑制PI3K/AKT信号通路的活化。
综上所述,ELE可显著改善人肺癌A549细胞系的多药耐药现象, 增加其耐药株A549/DDP细胞对DDP的敏感性,逆转多药耐药蛋白的表达,抑制其侵袭能力并促进凋亡, 其作用机制与抑制PI3K/AKT信号通路的活化有关。
