桑叶多糖的分离纯化及其抑菌活性研究
2021-02-26孙伟叶润蔡静王锐丽
孙伟,叶润,蔡静,王锐丽
(信阳农林学院生物与制药工程学院,河南 信阳 464000)
桑叶,又名神仙叶、铁扇子,是桑科落叶乔木桑(Morus alba L.)的干燥叶子,在我国分布广泛。《中国药典》记载桑叶具有疏风散热、润肺清燥、清肝明目等功效,主要用来预防和祛除风热感冒、燥咳肺热、头痛头晕和目赤昏花等病症[1]。研究发现,桑叶具有独特的药用价值,如抗病毒、抗衰老、抗疲劳、抗血栓、降血压、抗肿瘤以及降血糖血脂等作用[2-4]。多糖作为桑叶的主要成分之一,具有抗凝血、抗氧化、降血糖等多种作用[5-6],近年来对桑叶多糖的研究比较多,主要集中在桑叶多糖提取工艺的优化[7]、不同品种桑叶中多糖含量的比较[8]、不同时间段采摘的桑叶中多糖含量的比较[9]以及桑叶多糖提取分级及其抗辐射氧化胁迫作用[10]等,对桑叶多糖的纯化研究较少。
大孔树脂是一种稳定的极性、非极性或微亲水性聚合物,具有较高的吸附容量,较好选择性,可回收的吸附高分子聚合物,且成本相对较低,易于再生。目前,它们多用于植物中多糖、多酚、黄酮或者色素等的分离纯化[11-14],但尚未见桑叶多糖提取后利用大孔树脂纯化研究及抑菌活性评价的报道。
本文将桑叶多糖经超声-微波协同提取后,用AB-8、X-5、LS-8、HPD-100、DA-201、NKA-9、ADS-17、HP20这8种不同类型的大孔树脂,通过对桑叶多糖的比吸附量、吸附率及解吸率的测定,为桑叶多糖的制备与分离提供一种有效的方法,同时对桑叶多糖纯化前后的抑菌作用进行研究,为桑树及桑叶资源的深度开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
桑叶:2018年11月采摘于信阳农林学院,经信阳农林学院中药教研室梁丽香副教授鉴定为桑(Morus alba L.)的成熟叶片;葡萄糖标准品:合肥博美生物科技有限责任公司;蒽酮:上海展云化工有限公司;大孔树脂:山东鲁抗立科药物化学有限公司;浓硫酸、盐酸、氢氧化钠、乙醇(分析纯):武汉市中天化工有限责任公司;琼脂粉(分析纯):北京亚米生物科技有限公司;大肠杆菌、沙门氏菌、金黄色葡萄球菌:信阳农林学院微生物实验室;所有试验用水均为二次重蒸水。
1.2 仪器与设备
UV-1600型紫外-可见分光光度计:上海美普达仪器有限公司;ME104型电子分析天平:瑞士梅特勒公司;HG101-3A型电热鼓风干燥箱:南京卓鼎干燥设备厂;400Y型多功能粉碎机:永康市铂欧五金制品有限公司;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂;DKZ-2B型电热恒温振荡水槽:上海精宏实验设备有限公司;RWBC-08S型微波萃取反应仪:南京苏恩瑞实验仪器有限公司;JM-23D-40型超声波清洗器:深圳市洁盟清洗设备有限公司;SPX-70BE生化培养箱、XFS-280A型高压灭菌锅:上海力辰仪器科技有限公司;层析柱[20 mm(15 mm)×200 mm]:江阴市新辉层析设备有限公司。
1.3 试验方法
1.3.1 桑叶多糖的粗提
将干燥桑叶粉碎,过60目筛,取20 g置于500 mL烧杯中,加入400 mL蒸馏水,将混合液于80℃热水中浸提3 h后置超声波清洗器中,超声功率80 W,超声时间20 min,超声结束后进行微波萃取,微波功率140 W,微波时间3 min,冷却至室温(25℃)后过滤得提取液[15]。然后将提取液旋转浓缩,缓慢加入无水乙醇使最后乙醇体积分数为80%,搅拌混匀后4℃下静置40 min,离心10 min,收集沉淀物,干燥备用。
1.3.2 多糖含量测定
以葡萄糖为对照品,用常规的多糖含量测定方法:蒽酮-硫酸法[16],得线性回归方程 y=0.085 3x+0.049 1,相关系数R2=0.999 7。
1.3.3 大孔树脂的处理
将本试验选用的8种大孔树脂,先用重蒸水冲洗,接着以3倍柱体积的无水乙醇密封浸泡24 h,再用重蒸水反复冲洗至树脂无乙醇味;然后再分别先后用3倍柱体积质量浓度6%的NaOH溶液和6%的HCl溶液浸泡3 h,用大量重蒸水冲洗至中性,室温(25℃)沥干,备用[17]。
1.3.4 大孔树脂的筛选
以8种不同类型的大孔树脂AB-8、X-5、D-101、DM301、DA-201、NKA-9、LX-17 及 HP20 对桑叶多糖的比吸附量、吸附率及解吸率为考察指标进行综合对比,优选适宜纯化桑叶多糖的大孔树脂。
1.3.4.1 大孔树脂吸附试验
分别称取2.0 g处理过的8种不同类型的大孔树脂,放入250 mL具塞锥形瓶中,再加入40 mL质量浓度为3.0 mg/mL桑叶多糖溶液,将锥形瓶置于25℃恒温摇床上以100 r/min的转速振荡12 h,吸取上清液,根据“1.3.2”项中方法测定波长在625 nm下吸光度,并计算多糖的含量,计算比吸附量(Q)及吸附率(E),每组试验平行做3次,取其平均值。
Q/(mg/g)=(C0-C1)V/m
E/%=[(C0-C1)/C0]×100
式中:C0、C1为吸附前、后溶液中桑叶多糖的质量浓度,mg/mL;V为样品溶液的体积,mL;m为大孔树脂的质量,g。
1.3.4.2 大孔树脂解吸附试验
将充分吸附12 h后的8种不同类型的大孔树脂过滤并用重蒸水冲洗后置于250 mL的具塞锥形瓶中,再分别加入100 mL体积分数为65%的乙醇溶液,同样将锥形瓶置于25℃恒温摇床上以100 r/min的转速振荡12 h进行充分解吸附,根据“1.3.2”项中方法测定波长在625 nm下吸光度,并计算多糖的含量,计算解吸率(D),每组试验平行做3次,取其平均值。
D/%=[C2/(C0-C1)]×100
式中:C0、C1为吸附前、后溶液中桑叶多糖的质量浓度,mg/mL;C2为解吸液中桑叶多糖的含量,mg/mL。
1.3.4.3 AB-8树脂吸附与解吸动力学试验
按照“1.3.4.1”项中大孔树脂吸附试验中方法对AB-8型大孔树脂进行桑叶多糖的静态吸附,每隔0.5h,取样1 mL,测定桑叶多糖的质量浓度,计算其吸附率,绘制大孔树脂吸附时间与吸附率的动力学曲线。
按照“1.3.4.2”项中大孔树脂解吸试验中方法处理已吸附完成的AB-8型大孔树脂,进行解吸,同样每隔0.5 h,取样1 mL,测定桑叶多糖的质量浓度,计算对应时间的解吸率,绘制AB-8型大孔树脂的动力学解吸曲线。
1.3.5 AB-8型大孔树脂静态吸附与解吸条件考察
1.3.5.1 粗多糖上样液pH值和解吸液pH值
按照“1.3.4.1”项中方法配制粗多糖溶液,搅拌充分后用1 mol/L的盐酸调节上样液酸度,使pH值分别为 2.0、3.0、4.0、5.0、6.0、7.0,再将锥形瓶置于 25 ℃恒温摇床上以100r/min的转速吸附6h,取上清液,测定多糖含量,计算大孔树脂的吸附率与上样液pH值的关系。
按照“1.3.4.2”项中方法把已经吸附完成的树脂,在 pH 值分别为 2.0、3.0、4.0、5.0、6.0、7.0 的环境中解吸4 h,取上清液,测定多糖含量,计算大孔树脂的解吸率与解吸液pH值的关系。
1.3.5.2 上样液质量浓度
将1.3.1中制备的桑叶粗多糖配制成质量浓度为2.0、3.0、4.0、5.0、6.0、7.0 mg/mL 溶液各 40 mL 于 250 mL具塞锥形瓶中,各加入2.0 g处理过的AB-8型大孔树脂后密封,置锥形瓶于25℃恒温摇床上以100 r/min的转速振荡吸附6 h,取上清液,测定多糖含量,计算大孔树脂的解吸率与上样液质量浓度的关系。
1.3.5.3 解吸液乙醇体积分数
称取15.0 g处理过的AB-8型大孔树脂,放入500mL具塞锥形瓶中,再加入300 mL质量浓度为3.0 mg/mL桑叶粗多糖溶液,将锥形瓶置于25℃恒温摇床上以100 r/min的转速振荡6 h,过滤并用重蒸水冲去表面未吸附的多糖及其它杂质,沥干水分,从中称取6份均为2.0 g置于250 mL具塞锥形瓶中,依次加入100 mL体积分数为25%、35%、45%、55%、65%、75%、85%、95%的乙醇水溶液在同样的解吸条件下振荡解吸4h,按照“1.3.4.2”项中方法计算大孔树脂的解吸率与解吸液乙醇体积分数的关系。
1.3.6 AB-8型大孔树脂动态吸附与解吸附条件优化
1.3.6.1 上样流速
称取10.0 g处理过的AB-8型大孔树脂按湿法装柱装入Ф20 mm(15 mm)×200 mm的层析柱中,加入pH值为3.0,质量浓度为3.0 mg/mL相同体积的桑叶粗多糖溶液。分别以 0.5、1.0、1.5、2.0、2.5、3.0 BV/h 的流速上样。分段收集流出液,测定吸光度,计算大孔树脂的吸附率与上样流速的关系。
1.3.6.2 洗脱流速
根据1.3.6.1得到的最佳流速上样振荡吸附,吸附完成后用体积分数为65%的乙醇,分别以流速为0.5、1.0、1.5、2.0、2.5、3.0 BV/h 进行动态洗脱,分段收集流出液,测定吸光度,计算大孔树脂的解吸率与洗脱流速的关系。
1.3.6.3 动态洗脱曲线
按照以上试验确定的最佳纯化工艺条件:取Ф20mm(15 mm)×200 mm的玻璃色谱柱,装入10.0 g处理过的AB-8型树脂,以pH 3.0,质量浓度3.0 mg/mL的桑叶粗多糖溶液为上样液,并控制其上样流速为1.5 BV/h,进行吸附;吸附完成后先以2.0 BV的重蒸水冲洗树脂表面尚未被吸附粗多糖溶液,再以pH 6.0,体积分数65%的乙醇溶液进行洗脱,同时控制洗脱流速为1.5 BV/h,分段收集流出液,测定吸光度,计算各段流出液中的多糖浓度,绘制动态洗脱曲线。
1.3.7 多糖的抑菌试验
按牛津杯法进行抑菌活性测定[18],以大肠杆菌、沙门氏菌及金黄色葡萄球菌为受试菌,分别考察桑叶多糖粗提样、桑叶多糖纯化样、阳性对照青霉素溶液、阴性对照无菌水的抑菌活性。移取100 μL菌液(浓度为107cfu/mL)均匀涂布于琼脂培养基平板上,浅浅插入已灭菌牛津杯,并将200 μL不同浓度的药液加入牛津杯中,再将所有各样液平板放入培养箱中37℃恒温培养18 h后,测量抑菌圈直径大小,每组试验重复3次,取平均值。
1.3.8 数据统计分析
每组试验平行做3次,所得数据取平均值,单因素试验采用Excel 2007软件和SPSS19.0软件进行数据分析。
2 结果与分析
2.1 大孔树脂的筛选
8种不同类型的大孔树脂对桑叶多糖的吸附与解吸效果如表1所示。

表1 8种不同类型的大孔树脂的吸附与解吸效果分析Table 1 Adsorption and desorption effects of 8 different types of macroporous resins
适宜的纯化树脂对桑叶多糖不仅有好的比吸附量和吸附率,还要有较好的解吸率。大孔树脂NKA-9比吸附量最大,但其解吸率最低;HPD-100和AB-8树脂吸附效果相差不大,均有85%以上的吸附率,HPD-100树脂的比吸附量和吸附率比AB-8高均不到3%,而AB-8树脂的解吸率比HPD-100高约33%,可以使其吸附的桑叶多糖很好地被洗脱。因此,AB-8树脂是桑叶多糖的吸附与解吸试验适宜的树脂。
2.2 AB-8树脂吸附与解吸动力学试验
AB-8型大孔树脂对桑叶粗多糖的静态吸附与解吸附曲线如图1所示。
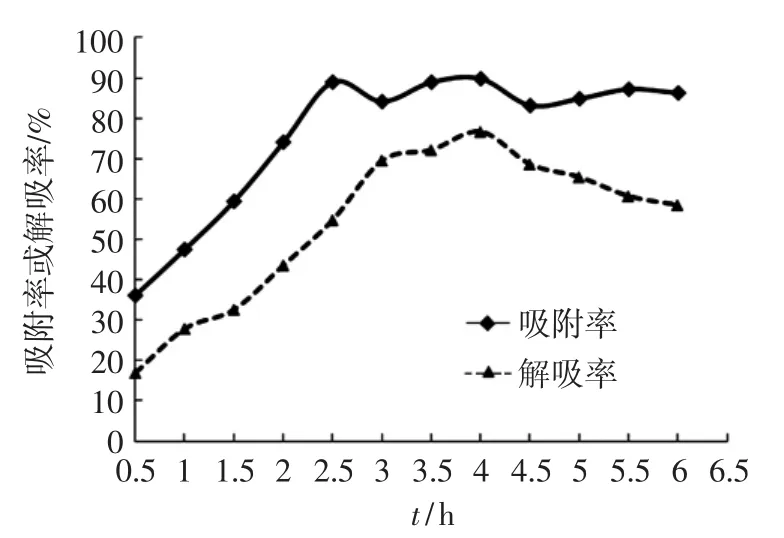
图1 AB-8型树脂静态吸附与解吸附动力学曲线Fig.1 Static adsorption and desorption kinetics curves of AB-8 resin
在0~2.5 h区间内AB-8型树脂对桑叶多糖的吸附率呈匀速上升趋势,在2.5 h达到吸附的最大值。继续延长吸附时间,吸附率有起伏,但基本趋于稳定。通过解吸曲线可看出,在0~3 h内,AB-8型树脂对桑叶多糖的解吸率上升较快,在4 h解吸率达到最大值76.64%。但在之后解吸率随时间逐渐降低,应该是洗脱液逐渐饱和所引起的。
2.3 AB-8树脂静态吸附与解吸附影响条件分析
2.3.1 上样液pH值和解吸液pH值
pH值对吸附和解吸效果的影响见图2所示。
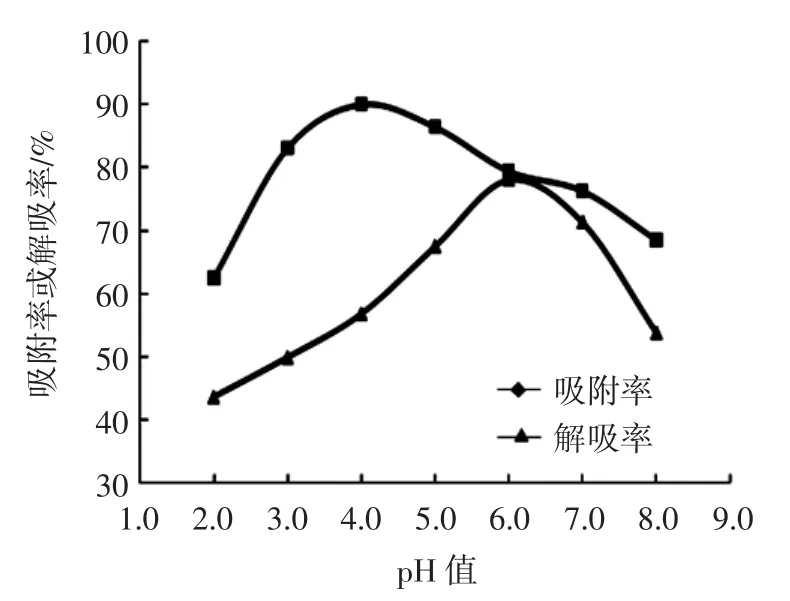
图2 pH值对吸附和解吸效果的影响Fig.2 Effect of pH on adsorption and desorption
如图2所示,上样液pH值为4.0时AB-8型树脂对桑叶多糖的吸附率最高,为90.06%,当上样液pH值低于3.0或高于5.0时,多糖在相对偏酸或偏碱的溶液中溶解度较差,不利于树脂的吸附,因此最佳上样液pH值为4.0。在解吸液pH值为6.0时AB-8型树脂对桑叶多糖的解吸率最高,为78.11%;在pH值小于6.0时,解吸率随酸性增加而降低;而在pH值大于6.0的中性和弱碱性环境中,解吸率呈降低趋势,所以最佳解吸液pH值为6.0。这可能因为桑叶中多糖类物质多数显弱酸性[19],在pH 3.0~5.0的溶液中呈稳定的分子状态被吸附,而在pH值为6.0的环境多呈游离态,不利于吸附而被洗脱下来。
2.3.2 上样液质量浓度
上样液浓度对吸附效果的影响见图3所示。
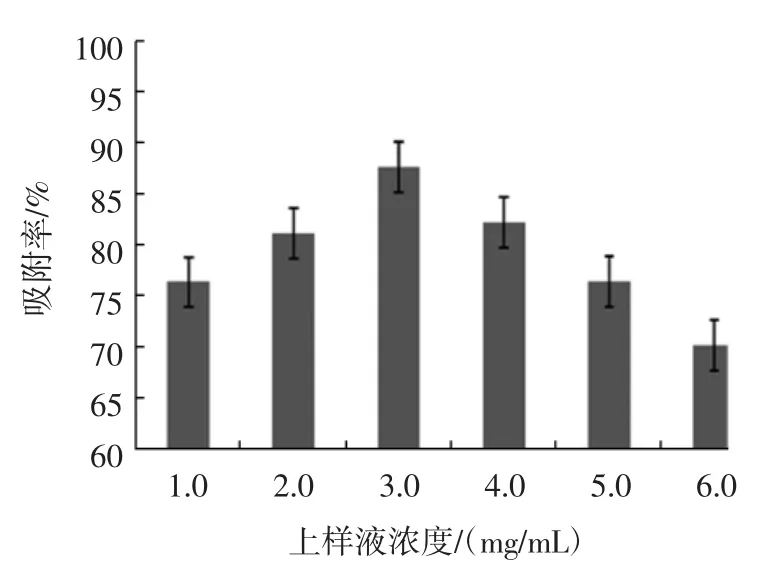
图3 上样液浓度对吸附效果的影响Fig.3 Effect of concentration of sample solution on adsorption effect
如图3所示,上样液浓度小于3.0 mg/mL时,随着上样液浓度的增大,AB-8型树脂的吸附率逐渐增大。上样液浓度为3.0 mg/mL时,AB-8型树脂的吸附率最高,上样液浓度大于3.0 mg/mL时,AB-8型树脂的吸附率却逐渐降低,形成这种现象原因可能是随着多糖质量浓度的升高,溶液的黏度也在增大,直接影响树脂孔道内多糖分子的扩散运动,引起树脂对桑叶粗多糖的吸附率下降[20]。而且,上样液浓度过高,杂质也会与多糖分子同时竞争吸附,甚至会产生沉淀堵塞树脂孔道,阻碍大孔树脂对多糖分子的吸附[21]。所以,桑叶多糖适宜的上样液浓度为3.0 mg/mL。
2.3.3 解吸液乙醇体积分数
解吸液乙醇体积分数对解吸效果的影响见图4所示。
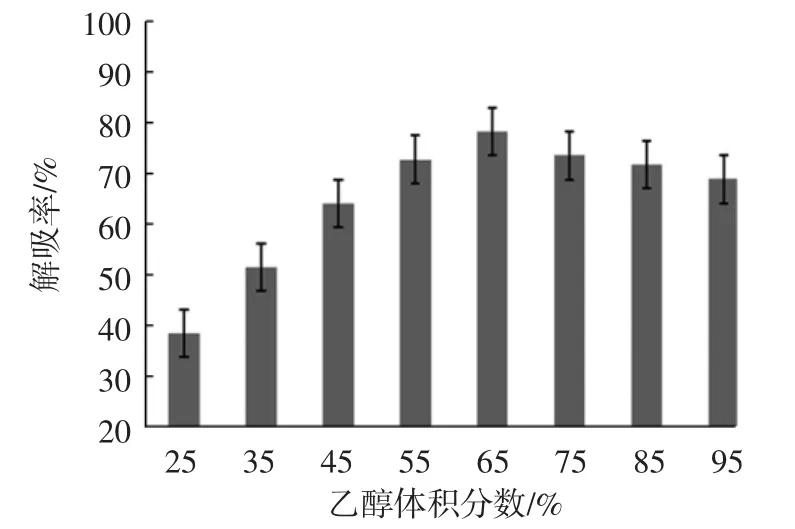
图4 解吸液乙醇体积分数对解吸效果的影响Fig.4 Effect of desorption concentration on desorption effect
由图4可知,解吸液乙醇体积分数在25%~65%之间,AB-8型树脂对桑叶多糖的解吸率随乙醇体积分数的增大而升高;但当乙醇体积分数从65%递增到95%时,解吸率却呈下降趋势。这可能是因为当乙醇体积分数偏大时,会引起解吸液中一些大分子物质如蛋白质等的溶解度减小而使沉淀析出,进而阻碍树脂中多糖分子的扩散[22],所以,应以体积分数为65%乙醇水溶液作为桑叶多糖适宜的解吸液。
2.4 AB-8型大孔树脂动态吸附与解吸条件分析
2.4.1 上样流速
上样流速对吸附效果的影响见图5所示。

图5 上样流速对吸附效果的影响Fig.5 Effect of loading velocity on adsorption effect
由图5可知,桑叶粗多糖溶液的上样流速为1.0 BV/h时,AB-8型树脂对桑叶多糖的吸附率最大,随着上样流速增大吸附率却在逐渐下降,而当流速为1.5 BV/h时吸附率仅比1.0 BV/h时低2.24%,但可以缩短试验时间和生产周期。所以,综合考虑吸附效果和工作效率,选择1.5 BV/h为最佳上样流速。
2.4.2 洗脱流速
洗脱流速对解吸效果的影响见图6所示。
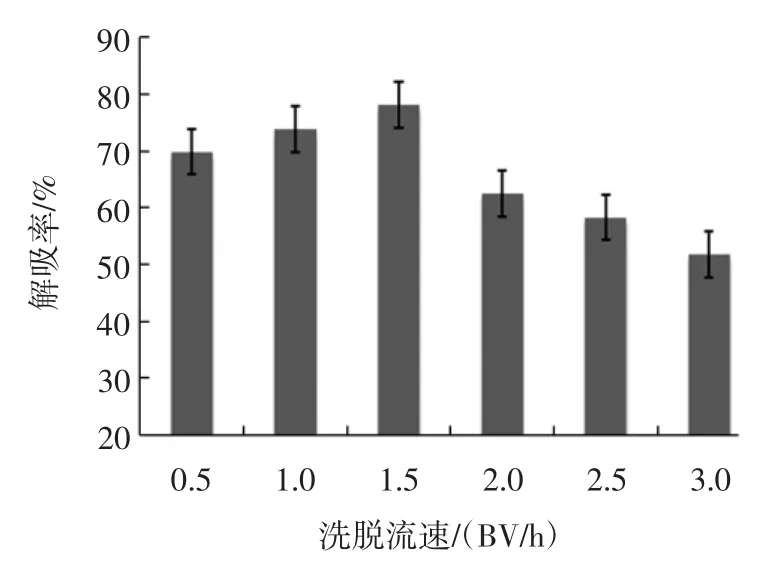
图6 洗脱流速对解吸效果的影响Fig.6 Effect of elution velocity on desorption effect
由图6可知,洗脱流速对桑叶多糖解吸率影响显著,流速为1.5 BV/h时解吸率最大,解吸率为78.42%,继续增大洗脱流速,解吸率减小。较慢的洗脱速度使洗脱液与树脂接触较充分,有利于多糖的解吸,若流速过慢,解吸出的多糖分子可能重新被吸附,影响解吸效果;若流速过快,会造成洗脱液与树脂接触不充分,不能将多糖全部置换出来,就快速流出,同时也会影响解吸效果[23]。因此洗脱流速选1.5 BV/h为佳,且在吸附结束变换为解吸时不用转动旋塞。
2.4.3 动态洗脱曲线
多糖的动态洗脱曲线见图7所示。

图7 多糖的动态洗脱曲线Fig.7 Dynamic elution curve of polysaccharides
由图7可知,动态洗脱时,吸附饱和的AB-8型大孔树脂上吸附的桑叶多糖比较容易被洗脱出来,5 mL洗脱液就可洗脱出桑叶多糖,当流出液体积在35 mL左右时,流出液中桑叶多糖浓度最大。当流出液体积为60 mL时,多糖含量不到0.1 mg/mL;当流出液体积为90 mL(3.0 BV)时,流出液中桑叶多糖的含量已经很少,不到0.02 mg/mL,桑叶多糖基本被洗脱完全。该曲线说明,动态条件下AB-8型大孔树脂吸附的桑叶多糖解吸效果好,且洗脱剂用量少。
2.5 工艺验证试验
为验证最佳工艺的试验效果,根据已优选的最佳纯化参数:上样液浓度为3.0 mg/mL,pH 4.0,流速为1.5 BV/h;解吸液乙醇体积分数为65%,pH 6.0,流速为1.5 BV/h,洗脱体积为90 mL(3.0 BV),对桑叶多糖进行动态吸附与解吸,进行3次平行试验,洗脱液进行浓缩并低温干燥,即得精品桑叶多糖。经检测计算得桑叶多糖的回收率和纯度,结果桑叶多糖回收率为87.14%(RSD=1.96%),纯度为 57.46%(RSD=2.11%),而1.3.1中桑叶粗多糖纯度为11.34%,提高了4.07倍。表明在上述工艺条件下AB-8型树脂对桑叶多糖的富集纯化稳定,且多糖的回收率和纯度均较高,适合工业化生产。
2.6 抑菌活性试验结果
桑叶多糖纯化前后的抑菌效果见表2所示。
由表2可知,浓度大于1.0 mg/mL桑叶多糖对大肠杆菌、沙门氏菌、金黄色葡萄球菌的活性都存在不同程度的抑制作用,且纯化后抑菌作用显著增强。其中,纯化后的桑叶多糖对金黄色葡萄球菌的抑制作用最强,抑菌圈直径与青霉素相差不大,且对大肠杆菌的抑菌作用也强于青霉素,但对沙门氏菌抑制效果相对较差。

表2 桑叶多糖纯化前后的抑菌效果Table 2 Antibacterial effect of polysaccharides in mulberry leaves before and after purification
3 结论
1)在所选的8种极性不同的大孔树脂中,AB-8型树脂对桑叶多糖的比吸附量、吸附率和解吸率均较高,且为快速平衡型树脂,适宜分离纯化桑叶多糖。
2)AB-8型树脂桑叶多糖的最佳工艺参数:上样液浓度为3.0 mg/mL,pH 4.0,流速为1.5 BV/h;解吸液乙醇体积分数为65%,pH 6.0,流速为1.5 BV/h,洗脱剂体积为90 mL(3.0 BV)。此工艺可将桑叶多糖粗品的纯度由11.34%提高到57.46%,提高了4.07倍,为桑叶多糖的分离纯化提供了一种新方法。
3)用牛津杯法进行抑菌试验,结果表明:浓度大于1.0 mg/mL桑叶多糖对大肠杆菌、沙门氏菌及金黄色葡萄球菌的活性均存在不同程度的抑制作用,且纯化后抑菌作用显著增强。
