油茶多酚提取物对SD大鼠降血脂和抗氧化作用的影响
2021-02-26石浩何小娥丁仁惠王文龙黄谦游静
石浩,何小娥,丁仁惠,王文龙,黄谦,游静*
(1.湖南应用技术学院农林科技学院,湖南 常德 415100;2.湖南农业大学园艺学院,湖南 长沙 410128;3.岳阳市食品质量安全监督检验中心,湖南 岳阳 414000)
油茶(Camellia oleifera Abel.),别名:茶子树、茶油树,为多年生木本粮油作物[1]。油茶适合生长在山区丘陵地带,尤其适合在有机质含量丰富的土壤中,是我国山区丘陵地区分布及栽培的主要经济林树种之一[2]。茶油营养丰富,含有多种不饱和脂肪酸、天然维生素及多种人体所需的微量元素,且茶油产业经济效益十分可观[3]。最近几年我国的油茶产业得到快速的发展,在产量和种植面积方面领先世界,尤其是在湖南、浙江、广西、江西和贵州等地,产量和面积居全国前列。随着油茶产业的发展,其副产物油茶粕也随之增加,我国每年有超过70万吨油茶粕的产出[4]。油茶粕中含有大量的糖类、皂苷类、蛋白质、多酚类和黄酮类物质[5-6]。对油茶粕中功效物质的开发与利用,可有效地提高油茶果的附加值,提高种植户的经济效益。近些年来随着人民生活水平的提高,现代饮食方式和饮食结构发生了较大的变化,同时因工作、生活压力的增加,导致体内氧自由基(freeradical,FR)的快速增加[7],易引起高血压、高血脂、动脉血管硬化、癌症、早衰等,且相关疾病也越来越“年轻化”,因此如何通过食疗来预防上述疾病已成为近年来的研究热点[8-9]。据相关研究表明多酚具有改善血液循环、软化血管、降血脂[10]、清除氧自由基、预防肥胖、保肝护肝、抗菌、抗辐射和预防诱变的作用[11-12]。本研究以大鼠、油茶多酚提取物为材料,采用多指标深入分析油茶多酚对高脂日粮大鼠降血脂及抗氧化能力的效果,并探索其相关作用机理,为今后油茶多酚类物质降血脂、保肝护肝、抗氧化等保健食品、药品的开发与利用提供一定理论依据。
1 材料和方法
1.1 材料与试剂
油茶饼粕:油茶基地油茶果经压榨所得产物;基础饲料、高脂饲料、SPF级雄性 SD大鼠[体质量(125±5)g]:湖南斯莱克景达实验动物有限公司;血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、谷丙转氨酶(alanine aminatransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)测定试剂盒:深圳迈瑞医疗电子有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)测试盒:南京建成生物工程研究所;阿托伐他汀:北京北大维信生物科技有限公司;焦碳酸二乙酯(diethy pyrocarbonate,DEPC)、Trizol试剂、核糖核酸(ribonucleic acid,RNA)反转录试剂盒:全式金生物技术有限公司;引物:上海生物工程技术有限公司合成;AB-8大孔吸附树脂、木瓜蛋白酶(120万U/g):上海索莱宝生物科技有限公司;乙醇、钨酸钠、钼酸钠、氢氧化钠(均为分析纯):国药集团化学试剂有限公司。
1.2 设备与仪器
BS-200全自动生化分析仪:深圳迈瑞生物医疗电子股份有限公司;JB-P5组织包埋、JJ-12J自动脱水机:俊杰电子有限公司;Wonbio-48R全自动样品快速研磨仪:上海净信实业发展有限公司;SUNRISE全自动酶标仪:TECAN公司;GDS8000凝胶成像系统:Syngene Gene Genius;Qiagen Rotor-Gene 7500 荧光定量PCR仪:北京北嘉美仪生物科技有限公司;Bio-Rad Power Pac 2000电泳仪:美国伯乐公司;SW-CJ-2D双人单面超净工作台:上海书培实验设备有限公司;ZW1105051705紫外可见分光光度计:上海光谱仪器有限公司;Thermo Savznt冷冻干燥仪:上海智岩科学仪器有限公司;DR-1001旋转蒸发仪:郑州长城科工贸有限公司;SB-3200D超声仪:宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 油茶多酚供试材料的制备
参照李嘉伟等[13]的方法,略有修改。取100 g油茶粕粉末于2.5 L的大烧杯中,并加入2 L 40%的乙醇和2 mL 1%的木瓜蛋白酶浸泡1 h,然后在90℃的温度下水浴超声1.5 h,将提取液进行抽滤后采用旋转蒸发仪去除溶剂,直至无明显醇味。将浓缩液调pH值至4,以3 BV/h的流速上柱(3.0 cm×70 cm、AB-8大孔吸附树脂),先用蒸馏水洗脱至无色,再采用5 BV体积、60%乙醇、3 BV/h的流速进行洗脱,每30 mL为一流分收集洗脱液。洗脱液经显色后合并,浓缩去除洗脱液。将浓缩液冷冻干燥至粉末。通过标样采用钨酸钠-钼酸钠显色法测定其纯度达74.53%。
1.3.2 动物实验及分组
健康雄性大鼠60只,体重(125±5)g,适应性喂养一周后,按照体重随机分为6组,分别为基础饲料组:基础饲料+10 mL/kg BW生理盐水;高脂饲料组:高脂饲料+10 mL/kg BW生理盐水;阿托伐他汀处理组:高脂饲料+10 mL/kg BW阿托伐他汀;油茶多酚处理组:高脂饲料+2.5、7.5、15 mL/kg BW油茶多酚。其中阿托伐他汀和油茶多酚浓度均为1 mg/mL。每天上午9∶00左右处理组灌胃药剂一次,其余时间均自由饮水进食,连续灌胃6周,最后一次给药后禁食12 h(不禁水)。饲养结束后,取血液和组织测定相应酶活指标和基因表达水平。动物饲料:分笼喂养,采用基础饲料及高脂饲料饲喂小鼠。高脂饲料配方为:74.8%基础饲料、4%胆固醇、6%蛋黄粉、5%白糖、10%猪油、0.2%胆盐。放于4℃冰箱冷藏保存。饲养条件:室温(22℃~25℃,湿度40%~70%),12 h周期明暗交替,自由采食饮水,保持良好通风,垫料隔天一换,每2周对笼具清洗并消毒1次。
1.3.3 大鼠体况变化的测定
每天观察SD大鼠的毛色、活动、饮食状态、精神状况等,每周称体重一次,记录。肝体比计算:肝体比(肝系数)/%=肝重(g)/体重(g)×100。
1.3.4 血清生化指标的测定
谷丙转氨酶、谷草转氨酶、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇水平,按照试剂盒说明书用BS-200全自动生化分析仪进行测定。
1.3.5 肝脏匀浆中抗氧化指标的测定
将制备好的10%匀浆液用高速冷冻离心机4 000 r/min,离心10 min,取上清液,测定肝脏超氧化物歧化酶和谷胱甘肽过氧化物酶活性及丙二醛含量。SOD、GSH-Px、MDA分别采用WST-1法、比色法、硫代巴比妥酸(thibabituric acid,TBA)法测定。严格按照南京建成生物工程研究所试剂盒说明书进行测定。
1.3.6 RNA提取与实时荧光定量PCR分析
实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction,qPCR)分析,采用 Trizol试剂盒说明方法提取RNA,RNA逆转录成互补脱氧核糖核酸(complementary deoxyribo nucleic acid,cDNA),然后以cDNA为模板进行PCR扩增,引物序列见表1。反转录 PCR(reverse transcription-PCR,RT-PCR)反应体系:10 μL SYBR Green qPCR SuperMix,1 μL 模板,1 μL 上游引物(10 nmol/L),1 μL 下游引物(10 nmol/L),灭菌后的双重蒸馏水补充至20 μL。反应条件:94℃条件下预变性30 s,94℃条件下变性5 s,60℃条件下退火15 s,荧光检测15 s,循环40次。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,参照Schmittgen[14]的方法,相对定量2-ΔΔCt分析法计算样品中各基因的相对表达量。

表1 荧光定量PCR引物序列信息Table 1 Primer sequences used in qPCR analysis
1.3.7 数据处理
采用WPS 2018软件对数据进行处理及制图,采用Statistix 8.0统计软件进行统计学分析,所有指标数据均采用平均值±标准差(mean±SD)表示,并用最小显著极差法(least significant difference,LSD)对数据进行显著性差异检验。
2 结果与分析
2.1 对高脂日粮大鼠体重影响测定结果
油茶多酚或阿托伐他汀处理对高脂日粮大鼠体重影响的测定结果见表2。
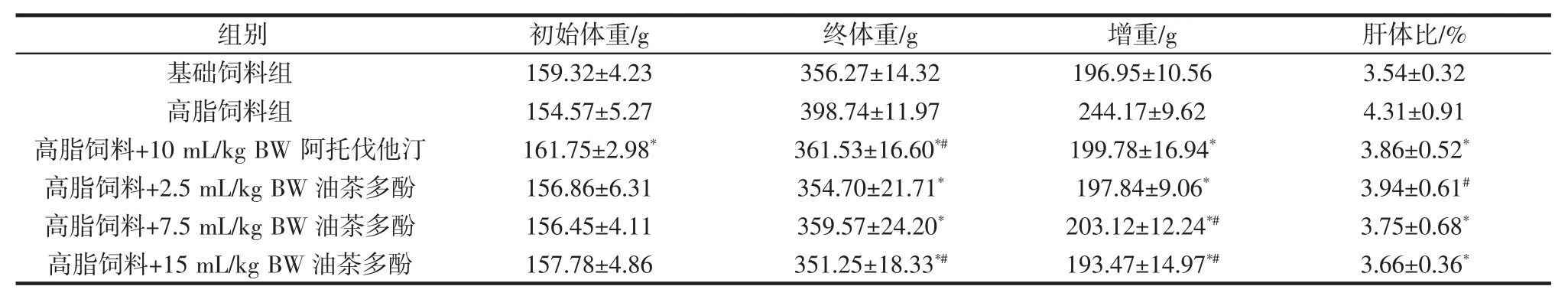
表2 对高脂日粮大鼠体重影响效果Table 2 Effects on body weight of high-fat diet rats
由表2可知,各组大鼠初始体重基本保持在150 g~160 g之间。各组大鼠经过6周不同饲料喂养,以及阿托伐他汀或油茶多酚处理后,各组大鼠间的体重具有较大的差异,其中高脂饲料组大鼠体重及肝体比均最大,分别达到了398.74 g、4.31%,除与2.5 mL/kg BW油茶多酚组大鼠肝体比不具有极显著性差异外,高脂饲料组与其它处理组均有极显著性差异(P<0.01),说明各处理均有一定的效果。经过阿托伐他汀、油茶多酚处理后高脂日粮大鼠的体重有了一定量的减少,且油茶多酚处理组效果略好于阿托伐他汀处理组,15mL/kgBW油茶多酚处理的效果最好。
2.2 对高脂日粮大鼠血脂及相关酶活性的影响
油茶多酚或阿托伐他汀处理对高脂日粮大鼠血脂及相关酶活性影响的测定结果见表3。

表3 对大鼠血脂及相关酶活性的影响Table 3 Effects on serum lipid levels and related enzyme activities of rats
由表3可知,总胆固醇含量除了2.5 mL/kg BW油茶多酚处理组与高脂饲料组(3.02 mmol/L)不具有极显著性差异外,其余处理组均有较大程度的降低(P<0.01),且阿托伐他汀处理组和15 mL/kg BW油茶多酚处理组效果较好,与基础饲料组不具有极显著性差异(P>0.01)。各组大鼠经阿托伐他汀或油茶多酚处理后甘油三酯的含量均远低于高脂饲料组,但都高于基础饲料组(P<0.01),说明有一定降低甘油三酯的效果,但相对基础饲料组不能完全清除。除15 mL/kg BW剂量油茶多酚处理组高密度脂蛋白(1.62 mmol/L)相对于高脂饲料组具有极显著性升高外,其余处理组均不具有极显著性。阿托伐他汀和油茶多酚处理组低密度脂蛋白均低于高脂饲料组,且均具有极显著性差异。高脂饲料组大鼠血清中谷丙转氨酶、谷草转氨酶的活性最高,分别达到了77.42 U/L、121.36 U/L,说明高脂饲料组大鼠肝脏受损最为严重。各处理组大鼠经过阿托伐他汀或油茶多酚处理后,2种酶的活性均有较大程度的降低,较高脂饲料组均具有极显著性差异(P<0.01)。但除了15 mL/kg BW剂量处理组谷丙转氨酶活性与基础饲料组不具有极显著性差异外,其余处理组谷丙转氨酶活均远高于基础饲料组,且各处理组大鼠谷草转氨酶活性均远高于基础饲料组。说明阿托伐他汀或油茶多酚处理可缓解及修复高脂日粮对大鼠肝脏的损伤,但不能完全阻止其损伤。
2.3 对高脂日粮大鼠肝脏脂质代谢相关基因表达的影响
油茶多酚或阿托伐他汀处理对高脂日粮大鼠肝脏脂质代谢相关基因表达影响的测定结果见表4。
由表4可知,ACAT1是导致游离胆固醇向胆固醇酯转化的关键性酶。ACAT1的过量表达将导致肝脏酯化胆固醇和总胆固醇的含量增加。高脂饲料组大鼠ACAT1的相对表达量非常高(1.51),阿托伐他汀组含量最低,仅为高脂饲料组的64.24%,且低于油茶多酚处理组。DGAT2可催化甘油二酯合成TG并促进脂滴(neutrallipids,LDs)的形成。高脂饲料组大鼠DGAT2的相对表达量最高(1.45),阿托伐他汀组和15 mL/kg BW多酚处理组相对表达量较低,分别为1.10、1.12。LCAT是一种固醇酰基转移酶,可加强HDL对外周组织胆固醇的清除能力。高脂饲料组大鼠LCAT的相对表达量最低(0.52),阿托伐他汀或油茶多酚处理后LCAT的相对表达量均有较大程度的升高(P<0.01)。
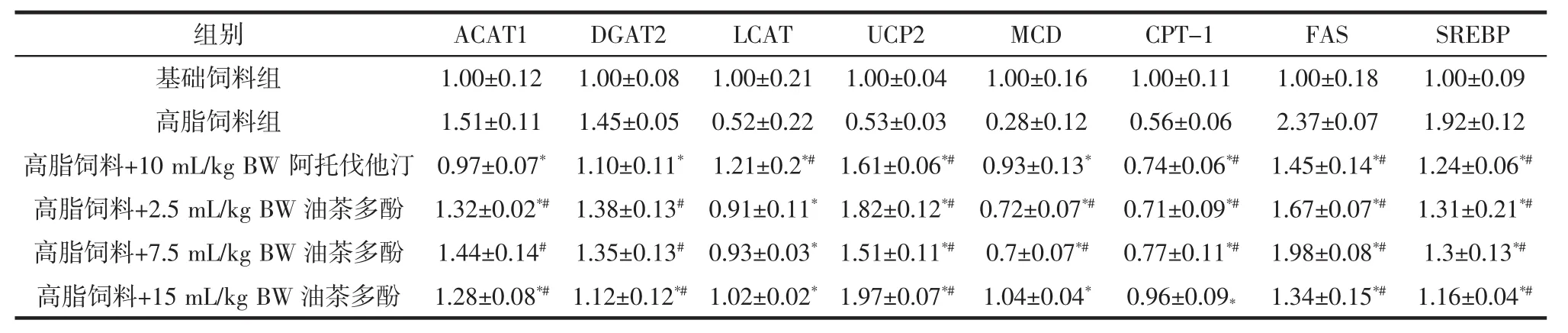
表4 对大鼠肝脏脂质代谢相关基因相对表达量的影响Table 4 Effect on relative expression of the genes involved in lipid metabolism in rats livers
解偶联蛋白UCPs是哺乳动物特有的、存在于线粒体内膜上的一种具有调节质子跨膜转运作用的转运蛋白,可提高机体能量消耗。高脂饲料组大鼠UCP2的相对表达量最低(0.53),阿托伐他汀或油茶多酚处理后UCP2的相对表达量均有较大程度的升高(P<0.01)。MCD丙二酰辅酶A脱羧酶是调节脂肪酸氧化的重要因子,上调MCD基因的表达将有利于减少体内游离脂肪酸(free fat acid,FFA)和肝脏中甘油三酯(TG)的含量。高脂饲料组大鼠MCD的相对表达量最低(0.28),阿托伐他汀或油茶多酚处理后MCD的相对表达量均有较大程度的升高(P<0.01)。CPT-1肉碱棕榈酰转移酶在脂肪氧化的初期起到了催化作用,同时对脂肪氧化的整个过程起着调节作用。高脂饲料组大鼠CPT-1的相对表达量最低(0.56),阿托伐他汀或油茶多酚处理后CPT-1的相对表达量均有较大程度的升高(P<0.01)。FAS是脂肪酸合成的关键酶之一,FAS的基因表达的下调,则能减少脂肪合成。高脂饲料组大鼠FAS的相对表达量最高(2.37),阿托伐他汀或油茶多酚处理后FAS的相对表达量均有较大程度的降低(P<0.01),其中15 mL/kg BW剂量茶多酚处理组表达量仅为高脂饲料组的56.54%。SREBP是脂质代谢调控因子,其基因表达量的减少,可降低细胞内总胆固醇含量。高脂饲料组大鼠SREBP的相对表达量最高(1.92),阿托伐他汀或油茶多酚处理后SREBP的相对表达量均有较大程度的降低(P<0.01)。其中15 mL/kg BW剂量茶多酚处理组表达量仅为高脂饲料组的60.41%。
2.4 对高脂日粮大鼠肝脏匀浆抗氧化指标的测定结果
油茶多酚或阿托伐他汀处理对高脂日粮大鼠肝脏匀浆抗氧化指标影响的测定结果见表5。
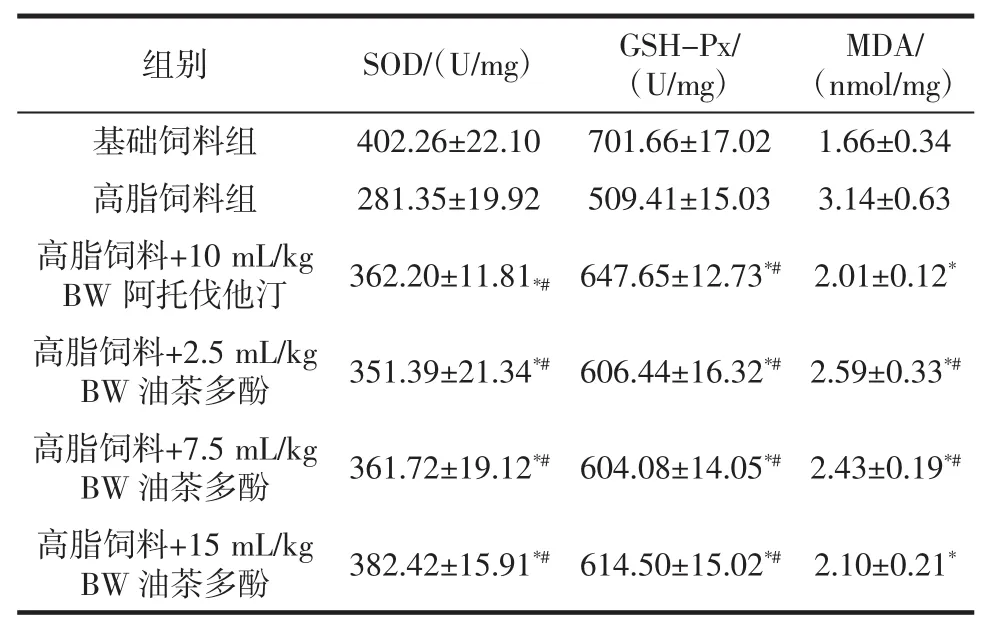
表5 对高脂日粮大鼠肝脏匀浆抗氧化指标的影响Table 5 Effect on antioxidant index of high-fat diet rat liver homogenate
由表5可知,高脂饲料组中SOD、GSH-Px酶活性均最低,分别仅为281.35、509.41 U/mg,大鼠经阿托伐他汀或油茶多酚处理后,相应的酶活性均有较大程度的提高,相对于高脂饲料组均具有极显著性差异(P<0.01),且15 mL/kg BW茶多酚处理组SOD酶活性增加最多,阿托伐他汀处理组GSH-Px酶活性增加最多。但是阿托伐他汀或油茶多酚处理组SOD、GSH-Px两指标均低于基础饲料组。高脂饲料组中MDA的含量最高,达到了3.14 nmol/mg,大鼠经过阿托伐他汀或油茶多酚处理后MDA的含量有了较大程度的降低,且阿托伐他汀药物处理组和15 mL/kg BW茶多酚处理组效果较好,其MDA含量接近了基础饲料组(P>0.01),可较大程度地减轻膜脂的过氧化损伤。
2.5 对高脂日粮大鼠肝脏组织中抗氧化基因表达量的影响
油茶多酚或阿托伐他汀处理对高脂日粮大鼠肝脏组织中抗氧化基因表达量影响的测定结果见表6。

表6 对大鼠肝脏组织中抗氧化基因表达水平的影响Table 6 Effects on the expression of antioxidant genes in rat livers
由表6可知,高脂饲料组SOD1基因的相对表达量最低,仅为0.56,经过阿托伐他汀或油茶多酚处理后,大鼠肝脏组织中SOD1基因的表达有极显著性增加(P<0.01),且15 mL/kg BW茶多酚处理组效果最好,相对于高脂饲料组增加了1.93倍。高脂饲料组CAT基因同样非常低,仅为0.41,此时阿托伐他汀处理组效果最好,相对于高脂饲料组增加了3.07倍。GPX-1调控着GSH-Px酶的活性,可阻断活性氧对机体造成的进一步损伤,高脂饲料组GPX1基因相对表达量也非常低,仅为0.68,此时15 mL/kg BW油茶多酚处理组效果最好,相对于高脂饲料组增加了1.36倍。谷氨酰半胱氨酸连接酶(glutamatecysteine ligase,GCL)是 GSH-Px生物合成的限速酶,各处理组GCLM基因的相对表达量都非常高,均远超高脂饲料组和基础饲料组,其中阿托伐他汀处理组效果最好(1.76),相对于基础饲料组提高了0.76倍。
3 结论与讨论
实验以油茶多酚和大鼠作为研究对象。大鼠经过高脂日粮喂食6周后,相对于基础饲料喂养大鼠体重有了较大程度的提高,同时肝体比也相对于基础饲料组增加了许多,说明经过高脂饲料饲养能让大鼠在短期时间内快速增重,高脂饲料处理效果较好。当采用油茶多酚对高脂日粮大鼠进行按时灌胃后,相对于高脂饲料组大鼠体重和肝体比有所下降。大鼠经过高脂日粮喂食后肝脏中谷草转氨酶(AST)、谷丙转氨酶(ALT)的活性均具有较大程度的提高,此时大鼠肝脏受到了一定程度的损伤,且含量越高,损伤越严重,大鼠经过油茶多酚处理后,相对于高脂饲料组两种酶活性均有较大程度的降低(P<0.01),说明油茶多酚具有一定保护肝脏的作用。同时经过油茶多酚喂养高脂饲料处理后的大鼠,大鼠体内总胆固醇TC、甘油三酯TG、低密度脂蛋白LDL-C的含量较高脂饲料组具有极显著水平的降低(P<0.01),而高密度脂蛋白HDL-C的含量具有一定程度的提高。
相对于高脂饲料组,油茶多酚处理组大鼠基因ACAT1、DGAT2、FAS、SREBP 的相对表达量具有明显的降低(P<0.01)。ACAT1是一种具有催化作用的多聚体变构酶,也是形成胆固醇酯的唯一性关键酶,ACAT1基因的下调表达将有利于总胆固醇TC含量的降低[15]。DGAT2可以促进肠道对脂肪的吸收作用,同时能够催化甘油二酯合成TG并促进LDs的形成,通过下调DGAT2基因的表达可以避免甘油三酯和胆固醇在肝脏中的大量形成与堆积[16]。SREBP是导致甘油三酯重新合成途径的重要转录调控因子,同时也是调控脂质代谢的重要转录因子,其基因表达量的减少,可有效降低细胞内胆固醇含量[17]。同时通过减少FAS基因的表达,可抑制肝脏中脂肪酸的合成,减少了脂质的聚集[18]。相对于高脂饲料组,油茶多酚处理组大鼠基因LCAT、UCP2、MCD、CPT-1 的相对表达量具有明显的升高(P<0.01)。LCAT基因使HDL表面游离胆固醇的酯化增加,LCAT基因的上调表达,可加强HDL对外周组织胆固醇的清除能力,降低胆固醇含量[19]。通过增强UCP2基因表达,可提高机体能量消耗,从而避免白色脂肪过度蓄积及肥胖的发生,这也可能是其具有或可增强减肥效果的原因之一[20]。MCD是调节脂肪酸氧化的重要因子,它能催化丙二酰辅酶A转变为乙酰辅酶A和二氧化碳,上调MCD基因的表达则有利于减少体内的游离脂肪酸(FFA)和肝脏中甘油三酯(TG)的积累[21]。CPT-1能够介导调控将长链脂肪酸从细胞质胞液运送至线粒体进行β-氧化,上调CPT-1基因的表达可提高脂肪酸在肝细胞中的氧化,降低细胞中脂质的积累[22]。
肝脏作为食物、药物甚至毒素的主要代谢器官,含有丰富的综合功能抗氧化酶。相对于高脂饲料组,茶多酚处理组大鼠肝脏体内SOD、GSH-Px酶活性极显著升高,MDA含量极显著降低。SOD和GSH-Px是抗氧化酶系统,具有较强清除自由基的作用。MDA是脂质氧化后的产物,可通过MDA含量的多少间接反映膜脂过氧化的程度。油茶多酚具有很好的抗氧作用,可提高体内抗氧化酶的活性,提高机体抗氧化能力。相对于高脂饲料组,油茶多酚处理组大鼠抗氧化基因SOD1、GPX1、CAT、GCLM的相对表达量具有明显的升高(P<0.01)。SOD 可将 O2-快速还原成 H2O2,从而达到清除超氧自由基的作用,同时H2O2再经过GSH-Px和CAT的作用还原成H2O[23]。GPX1是GSH-Px家族中存在最为广泛的一种酶,可有效地阻止活性氧对机体组织的损伤。谷氨酰半胱氨酸连接酶在GSH生物合成的过程中起到了限速酶的作用,同时GCL的调节亚基(GCLM)和催化亚基(GCLC)是一种重要的抗氧化蛋白酶[24],GCLM上调表达将有利于自由基的清除。
同时15 mL/kg BW油茶多酚和10 mL/kg BW阿托伐他汀对高脂日粮大鼠均具有较强降血脂和抗氧化的作用。目前本文对茶多酚降血脂、抗氧化的实验还处在大鼠动物实验阶段,后期可对灵长类动物代谢实验作进一步的研究。从而为今后相关降血脂、抗氧化功能产品的开发提供一定理论依据,以进一步的促进油茶资源开发、利用,提高其经济价值。
