西兰花萝卜硫苷提取物的抑菌及体外免疫活性探究
2021-02-26张睿于建丽宋璇闫媛媛李超
张睿,于建丽,宋璇,闫媛媛,李超,4*
(1.天津科技大学食品科学与工程学院,天津 300457;2.食品生物技术教育部工程研究中心(天津科技大学),天津 300457;3.天津市利民调料有限公司,天津 300308;4.天津食品集团有限公司,天津 300074)
西兰花素有“蔬菜皇冠”之美誉,其中富含人体所需的基本营养物质和多种活性成分,如硫代葡萄糖苷[1]、多酚[2]、维生素 C[3]等。硫代葡萄糖苷(硫苷)为含有硫和氮的阴离子的植物亲水性次生代谢产物,其结构如图1所示[4]。

图1 硫代葡萄糖苷结构Fig.1 The structure of glucosinolate
硫苷广泛存在于十字花科芸苔属植物中,在西兰花中尤为丰富,且主要以萝卜硫苷(glucoraphanin,GRA)的形式存在(相对丰度为55.5%)[5-6]。由于GRA具有抗氧化[7]、抑菌[8]、抗癌[9-10]以及免疫调节[11]等多种生物活性,是天然功能性产品的理想原料[12],因而受到国内外专家及学者的广泛关注。
近年来,随着我国农作物栽培技术的不断改进和提高,西兰花的单位产率逐年上升,当前种植面积已超过2万公顷[13]。但值得注意的是,西兰花的花茎和花蕾为主要食用部分,一个完整的西兰花在生产环节会有50%~80%的副产物产生[14]。然而,目前我国对于西兰花副产物的开发利用程度有限,除髙温堆闷腐熟成为有机肥料外,更多的处理方式则为就地掩埋和压土覆盖,由此造成了一定的资源浪费[15]。此外,由于西兰花副产物中的含硫化合物,如:二甲基二硫醚、异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯等,较易挥发,也会在一定程度上引起环境污染[6]。因此,对于西兰花副产物的综合加工利用成为亟待解决的问题。本研究以西兰花加工副产物为研究对象,采用水提法提取其中的天然活性物质(GRA),并分析其抑菌活性以及体外免疫调节活性,为西兰花副产物的综合加工利用提供理论基础和技术支持。
1 材料与方法
1.1 材料与试剂
西兰花:塘沽金元宝农贸市场;萝卜硫苷标准品(纯度:99.9%):上海源叶科技有限公司。RPMI-1640培养液、双抗(青霉素-链霉素)、胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲亚砜(dimethylsulfoxide,DMSO):美国Gibco生物科技公司;DMEM高糖培养液:美国Hyclone生物科技公司;胎牛血清(fetal bovine serum,FBS):天津市百赛斯生物科技有限公司;甲酸、甲醇:天津博欧特化工贸易有限公司;肉汤培养基(luria-bertain,LB):北京陆桥技术股份有限公司;细胞培养瓶、细胞培养皿:美国Corning公司;0.22 μm聚醚砜微孔滤膜:北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
LC-20ATVP高效液相色谱仪、Shim-pack GIST C18色谱柱(5 μm,4.6 mm×250 mm):日本岛津公司;IQuip 25 μL液相(平头)微量进样器:北京芯硅谷科技有限公司;MULTISKAN GO全波长酶标仪、150i型CO2细胞培养箱:美国Thermo公司;HF-safe900型超净台:上海力申科技有限公司。
1.3 方法
1.3.1 确定检测方法
参考李宁的方法[16],确定本试验的高效液相色谱(high performance liquid chromatography,HPLC)条件为流动相:0.01%甲酸水溶液:甲醇=95∶5;流速:1.0 mL/min;进样量:20 μL;采集时间:15 min;柱温:30 ℃。
1.3.2 检测方法的可靠性分析
1.3.2.1 重复性分析
平行制备6份相同浓度的GRA标准品(1 mg/mL),经0.22 μm聚醚砜微孔滤膜过滤后,按照1.3.1条件进行检测分析。根据测试结果的相对标准误差(relative standard deviation,RSD)值,分析 HPLC方法的可重复性。
1.3.2.2 精密性分析
将1 mg/mL的GRA标准品,经0.22 μm聚醚砜微孔滤膜过滤后,按照1.3.1条件进行检测分析,连续进样6次。根据测试结果的RSD值,分析HPLC方法的精密性。
1.3.2.3 稳定性分析
将1 mg/mL的GRA标准品,经0.22 μm聚醚砜微孔滤膜过滤后,按照 1.3.1 条件,分别于 0、2、4、6、8、10 h后进行测定分析,每组试验重复进样3次。根据测试结果的RSD值,分析HPLC方法的稳定性。
1.3.2.4 加标回收率分析
采用加标回收法对HPLC方法的回收率进行分析。吸取1 mL已知含量的GRA样品溶液(浓度分别为103.31、96.72、98.80 μg/mL),向其中分别加入 1 mL GRA 标准品溶液(100 μg/mL),经 0.22 μm 聚醚砜微孔滤膜过滤后,按照1.3.1条件进行检测分析,每次重复进样3次。根据测试结果的RSD值,分析HPLC方法的回收率[17],计算公式如式(1)所示。

1.3.3 西兰花中GRA的提取
西兰花样品主要前处理工艺过程,如图2所示。

图2 样品前处理工艺流程Fig.2 Sample pretreatment process
参考 Ishida、Grosser等的研究方法[18-19],西兰花茎、叶等经切分处理后立即进行沸水灭酶处理(30 s),随后置于热风干燥箱中(50℃~65℃)干燥至恒重,经粉碎机磨粉后过80目筛。采用水提法对西兰花粉中的GRA进行提取,以水作为提取剂,料液比1∶16(g/mL),提取温度62℃,提取时间10 min,提取次数2次。采用HPLC对提取液中的GRA含量进行检测。
1.3.4 萝卜硫苷提取物(glucoraphanin extract,GRAE)的制备
采用冷冻干燥法对GRA提取液进行干燥处理[20]。将GRA提取液置于平皿中,表面封保鲜膜并留孔,于-20℃预冻4 h至固体状态。然后,将预冻后样品转移至预冷-50℃的冻干机中,在冷阱温度-80℃的条件下,冷冻干燥至恒重,即得GRAE,再次称重。根据式(2)计算出GRAE的提取率。

1.3.5 主要成分分析
称取5 mg GRAE,制备为5 mg/mL的样品溶液,经0.22 μm聚醚砜微孔滤膜过滤后,采用外标法进行HPLC分析检测,以测定GRA的含量。采用苯酚-硫酸法测定GRAE中多糖含量,Folni-Ciocaltue法测定多酚含量,间羟基联苯比色法测定糖醛酸含量,Bradford法测定蛋白质含量。
1.3.6 抑菌活性分析
1.3.6.1 抑菌圈定性试验测定
采用滤纸片法分析GRAE对大肠杆菌、金黄色葡萄球菌和沙门氏菌的抑菌活性。吸取100 μL活化后的菌悬液,涂布于含LB固体培养基的培养皿中,静置30 min。随后将浸泡于GRAE样品溶液中(100、500、1 000 μg/mL)滤纸片(直径为5.5 mm)均匀分散于培养基上,先正置15 min,再于37℃条件下倒置培养18 h。以无菌水作为空白对照,硫酸卡那霉素溶液作为阳性对照(20 μg/mL),测量抑菌圈直径并拍照保存。
1.3.6.2 最小抑菌浓度测定
采用96孔板二倍稀释法,测定GRAE对大肠杆菌、金黄色葡萄球菌和沙门氏菌的最小抑菌浓度(minimum inhibitory concentration,MIC)值。取无菌96孔板,在孔板A~D行的第1个孔各加入100 μL的GRAE溶液(2 000 μg/mL),然后对其依次进行二倍稀释至最后一孔,并将最后一孔的样液吸弃100 μL。随后向每孔中加入稀释好的菌液100 μL,进行无菌密封,置于37℃恒温培养箱中静置培养24 h。以菌液作为阳性对照,LB培养基作为阴性对照,利用酶标仪测定600 nm处的吸光度值。
1.3.7 体外免疫调节活性分析
1.3.7.1 细胞增殖能力测定
采用 MTT 法,测定 GRAE(50、100、250、500、1 000 μg/mL)对巨噬细胞株(RAW264.7细胞)增殖能力的影响。首先,将 RAW264.7 细胞悬液(5×104个/mL)接种于 96 孔板(100 μL/孔),于 37℃、5% CO2浓度条件下培养6 h。吸弃上清液,并用磷酸缓冲盐溶液(phosphate bufter saline,PBS)缓冲液洗涤 2次,再向每孔中分别加入 100 μL 含不同浓度(50、100、250、500、1 000 μg/mL)GRAE 的 DMEM 细胞培养液,于相同条件下培养36 h。然后,向每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h。吸弃旧培养液,每孔加入150 μL的DMSO溶液,于酶标仪中振动孵育20 min。以DMEM培养液作为空白对照,脂多糖(lipopolysaccharide,LPS)作为阳性对照(1 μg/mL),测定 570 nm 处的吸光度值,按照式(3)计算细胞活度。
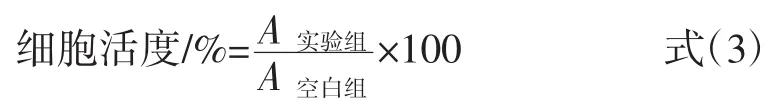
1.3.7.2 细胞吞噬能力测定
采用中性红法,测定GRAE对RAW264.7细胞吞噬能力的影响。首先,将RAW264.7细胞悬液(5×104个/mL)接种于 96 孔板(100 μL/孔),于 37℃、5% CO2浓度条件下培养6 h。吸弃上清液,并用磷酸盐(phosphate buffer solution,PBS)缓冲液洗涤2次,再向每孔中分别加入 100 μL 含不同浓度(50、100、250、500、1 000 μg/mL)GRAE 的 DMEM 细胞培养液,于上述相同条件下培养36 h。吸弃旧培养液后,于每孔中加入0.1%的中性红溶液(100 μL)。静置20 min后,再向每孔中加入细胞裂解液(200 μL),于酶标仪中振动孵育20 min。以DMEM培养液作为空白对照,脂多糖(LPS)作为阳性对照(1 μg/mL),测定 490 nm处的吸光度值。
1.3.8 数据处理
试验数据以平均值±标准偏差表示,每组试验重复3次,细胞试验至少设置5个复孔。图表绘制使用Origin Pro 8.0和Excel 2016软件;数据分析使用IBM SPSS 21.0 Statistics软件。
2 结果与讨论
2.1 HPLC检测方法的建立
2.1.1 HPLC检测方法的可靠性分析
2.1.1.1 重复性分析
平行制备6份GRA标准品溶液,按“1.3.1”项下色谱条件测定HPLC色谱图,分别计算相应峰面积的RSD值,结果如表1所示。

表1 HPLC检测方法的重复性测试Table 1 Repeatability test of HPLC detection method
由表1可知,6份待测样检测后峰面积的RSD值为1.04%(<2%),表明该HPLC法的重复性良好。
2.1.1.2 精密度分析
精密吸取100 μg/mL的GRA 标准液,按“1.3.1”色谱条件下连续进样6次,测定各待测品的峰面积,计算其RSD值,结果如表2所示。
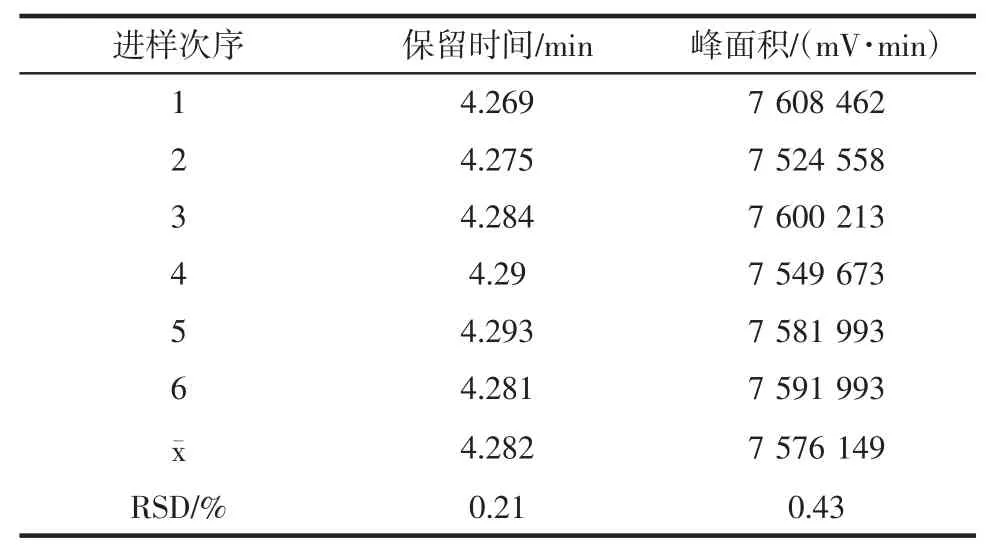
表2 HPLC检测方法的精密度测试Table 2 Precision test of HPLC detection method
由表2所示,6次进样峰面积的RSD值为0.43%(<2%),表明该HPLC检测方法的精密度较高。
2.1.1.3 稳定性分析
配制1 mg/mL的GRA标准品,按“1.3.1”色谱条件下分别于 0、2、4、6、8、10 h 后进行测定分析,得到相应的峰面积值,计算RSD值,结果如表3所示。

表3 HPLC检测方法的稳定性测试Table 3 Stability test of HPLC detection method
由表3可知,HPLC峰面积的RSD分别为1.90%(<2%),表明供试品在10 h内稳定性良好。
2.1.1.4 加标回收率分析
加标回收率值常用于评价分析方法是否适合被测基体,也可以反应分析人员的操作技术水平。取1 mL已知含量的GRA样品溶液(浓度分别为103.31、96.72、98.80 μg/mL),向其中分别加入 1 mL 的 GRA 标准品溶液(100 μg/mL),按“1.3.1”色谱条件下进行检测分析,将其结果扣除样品的测定值,而得到加入标准物质的回收率[17]。加标回收率结果及其RSD值,如表4所示。
由表4可知,GRA的平均回收率为96.47%(处于95%~105%的阈限范围内),RSD为1.50%(<2%)表明该HPLC方法适用于西兰花中GRA的含量测定。

表4 HPLC检测方法的加标回收率测试Table 4 Standard recovery test of HPLC detection method
综上所述,本试验建立的HPLC检测方法,前处理操作简便,分析时间短,加标回收率较高,重复性、精密度、稳定性良好,能够定量检测西兰花中GRA含量。
2.1.2 HPLC检测谱图
采用HPLC法对标准品与西兰花样品中的GRA进行检测,结果如图3所示。

图3 GRA的高效液相色谱图Fig.3 The high performance liquid chromatography of GRA
由图3可知,GRA标准品与西兰花样品的保留时间分别为4.351 min和4.317 min。以HPLC检测的出峰面积为纵坐标,以GRA标准溶液浓度为横坐标,绘制标准曲线,如图4所示。
由图4可知,GRA的标准曲线方程为y=10 535x+70 180,相关度R2=0.999 8。表明拟合程度较好,可用于西兰花中GRA含量分析[21]。
2.2 GRAE成分分析
参考王向阳等[22]研究,本试验对冷冻干燥制备所得的萝卜硫苷提取液(GRAE)中主要成分进行了初步鉴定,为后期进一步探讨其活性作用机制提供基础数据,其主要成分如表5所示。
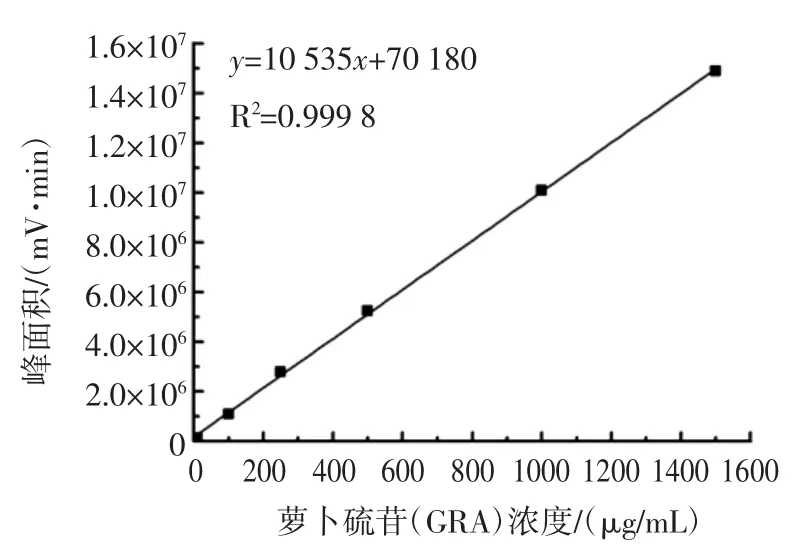
图4 GRA标准曲线Fig.4 The standard curve of GRA

表5 GRAE的化学成分Table 5 The chemical composition of GRAE
Ares等曾对近五年西兰花中的活性成分做一总结,其结果如下:多酚28%、多糖(硫代葡萄糖苷及其相关化合物)33%、蛋白质4%、脂肪13%、维生素14%、其它物质8%。其中,多酚与多糖含量与本试验结果基本一致,而蛋白质含量相差较大,这可能由于西兰花产地、提取物的制备方式及试验检测方式不同有关[23]。
2.3 GRAE的抑菌活性探究
2.3.1 抑菌圈试验测定
通常采用抑菌圈法对待测样品的抑菌活性进行定性分析,利用待测样品在培养皿中扩散,使其周围细菌的生长受到抑制,进而形成透明的抑菌圈,根据抑菌圈直径可以直观判定待测样品的抑菌效果。本试验采用滤纸片法对GRAE的抑菌活性进行定性分析,结果如图5及表6所示。

图5 抑菌圈试验结果图Fig.5 The results of bacteriostatic circle test
由表6可知,当GRAE作用浓度为1000μg/mL时,大肠杆菌、沙门氏菌、金黄色葡萄球菌的抑菌圈直径分别为(19.21±0.29)、(19.10±0.42)、(16.78±0.86)mm,表明3株致病菌对GRAE均呈现出高度敏感性,因而GRAE可以抑制3株致病菌的生长[24],且对大肠杆菌、沙门氏菌的抑制效果优于金黄色葡萄球菌。
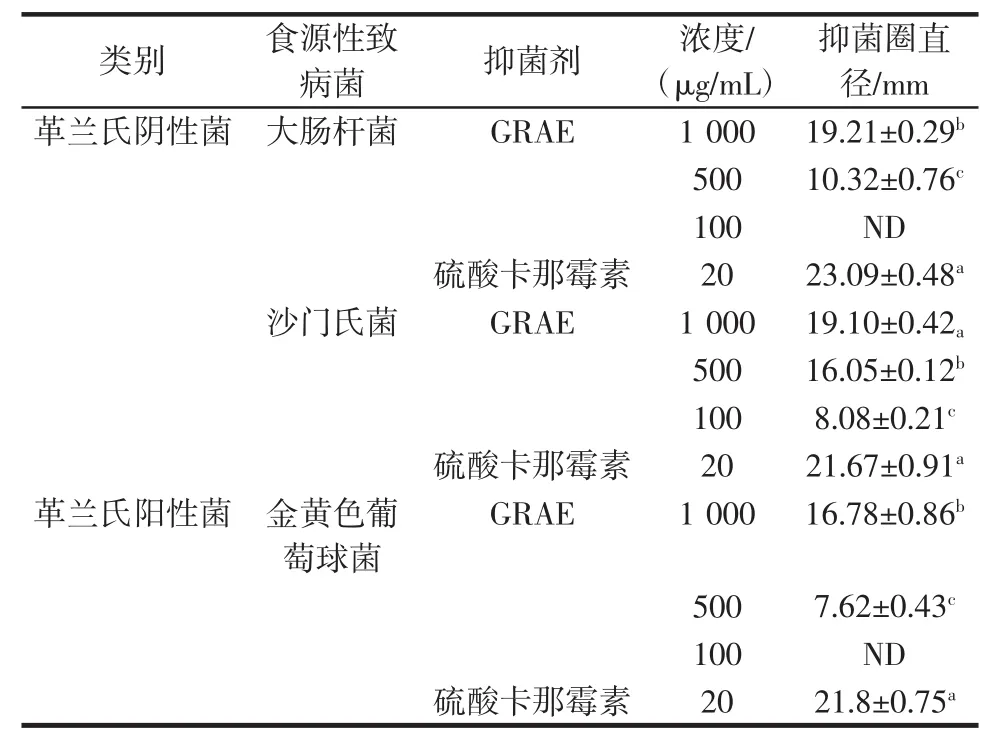
表6 抑菌圈试验结果汇总Table 6 The summary of bacteriostatic circle test results
2.3.2 最小抑菌浓度测定
最小抑菌浓度(minimum inhibitory concentration,MIC)是指在体外培养细菌一定时间后,可以抑制培养基内病原菌生长的最低作用浓度,是测量待测菌对抗菌药物敏感度大小的一个指标[25]。本试验结果表明GRAE对大肠杆菌、沙门氏菌和金黄色葡萄球菌的MIC值,分别为 62.5、31.25、250 μg/mL,说明 GRAE 可直接作用于致病菌并产生抑制作用,且对沙门氏菌和大肠杆菌的抑制效果优于金黄色葡萄球菌,该测定结果与抑菌圈试验结果具有一致性。这可能由于提取物中的GRA(相对分子质量:437.5)作为水溶性小分子[25],被待测菌株的外膜选择性透过,进而使细菌细胞膜渗透性提高,导致菌体因外环境水分渗入而膨胀裂解[26]。
2.4 免疫活性分析
2.4.1 增殖能力测定
巨噬细胞是机体中的一类免疫细胞,参与机体的特异性及非特异性免疫调节,起着中枢调节作用[27]。小鼠单核巨噬细胞株RAW264.7通常作为研究人体免疫功能的体外模型[16]。本研究采用MTT法测定GRAE对RAW264.7细胞的增殖影响,结果如图6所示。
由图6所示,随着GRAE作用浓度的增加,RAW264.7细胞的增殖能力呈现出先增加后减小的趋势。当GRAE的作用浓度为50 μg/mL和100 μg/mL时,RAW264.7细胞增殖能力达最大值,其细胞活度分别为(138.1±5.9)%和(157.6±3.5)%。与 LPS阳性组[1 μg/mL,细胞活度为(128.6±3.2)%]相比,具有显著性差异。这证明GRAE可以直接作用于巨噬细胞,使其增殖能力增强。当随着GRAE的作用浓度进一步增加时,RAW264.7细胞的增殖能力反而减弱。其原因可能是高浓度的GRAE被细胞识别为一种外源性抗原,细胞出于自我保护机制而发生了一种高度有序的自我吞噬过程,进而造成细胞数量的减小[28]。

图6 GRAE对RAW264.7细胞增殖的影响Fig.6 The effects of GRAE on proliferation activity of RAW264.7 cell
2.4.2 吞噬能力测定
巨噬细胞不仅可以通过直接吞噬杀伤肿瘤细胞和病原体而发挥非特异性免疫调节作用;还可通过间接产生一些具有杀伤肿瘤细胞和免疫调节作用的细胞因子,激活免疫球蛋白或其他免疫细胞,进而在机体内发挥免疫调节功能[29]。细胞吞噬活性的增强,可以增强机体的免疫调节功能,使机体更有效的处理并呈递抗原,也能更迅速地消灭内源或外源性病原菌[30]。因此,本试验通过中性红法探究了GRAE对RAW264.7细胞吞噬能力的影响,结果如图7所示。

图7 GRAE对RAW264.7细胞吞噬活性的影响Fig.7 The effects of GRAE on the phagocytic activity of RAW264.7 cell
由图7可知,随GRAE作用浓度的增大,RAW264.7细胞的吞噬能力呈现出先增强后减小的趋势。当作用浓度为50 μg/mL和100 μg/mL时,细胞吞噬能力达最大值,A490值分别为0.898±0.049和0.926±0.035。该结果显著高于空白组(A490为0.543±0.014)和LPS阳性组(A490值为 0.704±0.032),较空白组提高了约1.7倍。但当GRAE的作用浓度进一步增加至500 μg/mL~1 000 μg/mL 时,细胞的吞噬能力呈现下降趋势。这可能由于细胞自噬机制而造成细胞数量的降低,进而导致细胞的吞噬能力也随之下降[31]。
3 结论
本研究以将西兰花副产物高附加值化为宗旨,以高效液相色谱法为检测方法,以一种安全有效的方式提取西兰花中的萝卜硫苷。然后,通过冷冻干燥法制备萝卜硫苷提取物,其中含有GRA、多糖、多酚、糖醛酸以及蛋白质等活性成分。抑菌试验结果表明GRAE对大肠杆菌和沙门氏菌具有较强的抑制作用,对金黄色葡萄球菌的抑制作用稍弱。体外免疫活性试验结果显示,GRAE对巨噬细胞株RAW264.7的增殖和吞噬能力均具有一定的促进作用。综上,GRAE来源广泛且具有一定的抑菌及体外免疫调节活性,具有较大的开发及工业化应用前景。
