植酸掺杂聚苯胺对水中Cr(Ⅵ)的去除研究
2021-02-26魏治洋邹飞林赖竹林刘晓薇
魏治洋, 邹飞林, 赖竹林, 刘 骋, 刘 畅, 刘晓薇*
1.合肥工业大学资源与环境工程学院, 安徽 合肥 230009 2.合肥工业大学,纳米矿物与污染控制安徽普通高校重点实验室, 安徽 合肥 230009 3.安徽师范大学环境科学与工程学院, 安徽 芜湖 241000
Cr(铬)广泛应用于电镀、采矿、制革、炼油等行业,这些行业排放的废水中,主要以Cr(Ⅲ)和 Cr(Ⅵ)形态存在[1]. Cr(Ⅵ)具有较高毒性,生物体摄入后会引起呕吐和腹泻,并导致皮肤病,长时间暴露可能致癌[2-4]. 近年来,我国部分地表水体存在Cr(Ⅵ) 超标[5]. 因此,废水中Cr(Ⅵ)的有效去除对水生态环境安全具有重要意义. 吸附法是一种有效、经济的重金属处理方法[6-7],操作灵活、处理效果好. 传统吸附剂如活性炭、沸石、天然黏土等存在吸附量较低、难以回收等缺点[8]. 研究具有高吸附能力、结构稳定的吸附剂,对废水中重金属污染物的高效去除十分重要.
PANI(聚苯胺)是一种亚苯基聚合物,原料易得、价格低廉、环境稳定性好,其表面的胺基和亚胺基基团不仅对Cr离子具有很高亲和性,还可以将Cr(Ⅵ)还原为低毒的Cr(Ⅲ)[9]. PANI分子骨架结构上含有苯胺官能团,可以掺杂原子或离子调节表面属性,增加对水中离子的补获能力. 目前,一些研究者采用掺杂盐酸等无机酸的方式来提高PANI的性能[10-12]. WANG等[13]研究发现,盐酸等质子酸掺杂PANI对Cr(Ⅵ) 去除能力与PANI的质子化程度密切相关. PANI在酸性条件下质子化程度最高,能够大量还原Cr(Ⅵ)成Cr(Ⅲ),但在碱性条件下对Cr(Ⅲ)的吸附能力最大[14],因而在不同的反应条件会导致总Cr去除率较低. PA(植酸)作为一种从植物种籽中提取的有机磷酸类化合物,可作为掺杂剂来提高PANI结构稳定性[15],同时PA中的磷酸根基团具有更多的羟基和含氧官能团,会增加掺杂后PANI的吸附位点,使得PA掺杂的PANIPA复合材料对重金属离子具有更好的去除效果. 目前,PA掺杂PANI的吸附材料对Cr(Ⅵ)的吸附特征和机理尚不明确,有待进一步研究.
该研究采用PA掺杂的苯胺单体聚合反应,制备出一种结构稳定、吸附性能优良的三维多孔PANIPA吸附材料. 结合吸附动力学和热力学试验,探究PANIPA对Cr(Ⅵ)的吸附性能和吸附机理;在无机阴离子和其他重金属离子共存下,探讨PANIPA对Cr(Ⅵ)的选择吸附作用,为PANI吸附材料与Cr的相互作用提供依据.
1 材料与方法
1.1 试剂
用于配制Cr标准溶液和含Cr溶液的工作基准试剂重铬酸钾,购于天津市化学试剂研究所有限公司;苯胺,过硫酸铵、PA等化学试剂均为分析纯,购于国药集团化学试剂有限公司.
1.2 PANIPA复合材料的制备
该研究以过硫酸铵为氧化剂,制备不同浓度PA掺杂的PANIPA复合材料. 取2.790 g苯胺,缓慢加入到装有 1.034 8 g PA的烧杯中,超声波振荡60 min,然后在冰浴条件(0~5 ℃)下,缓慢滴加150 mL 0.2 molL的过硫酸铵溶液,在0~5 ℃下搅拌混合物6 h后,依次加入300 mL乙醇和 1 000 mL去离子水对混合物抽滤. 将得到的固体在60 ℃下真空干燥24 h,制得0.01 molL的PANIPA复合材料. 改变PA质量分别为 5.174 0 和 22.475 0 g,重复上述步骤,分别制得0.05 molL和0.20 molL的PANIPA复合材料. 3种PA掺杂的PANIPA复合材料浓度分别表示为PANI0.01-PA、PANI0.05-PA、PANI0.20-PA.
1.3 PANIPA复合材料的表征
利用SEM (扫描电子显微镜)(S4800,Hitachi,日本)对PANIPA复合材料的形貌特征进行表征. FTIR (傅里叶转换红外光谱分析)和XPS (X射线光电子能谱分析)分析分别采用FTIR仪(Vertex 70, Buker,美国)和XPS仪(ESCALAB 250Xi, Thermo Scientific,美国). PANIPA的零电荷点pH分析采用Zeta电位分析仪(ZetaPlus, Brookhaven,美国).
1.4 Cr(Ⅵ)的静态吸附试验
2 结果与讨论
2.1 材料表征
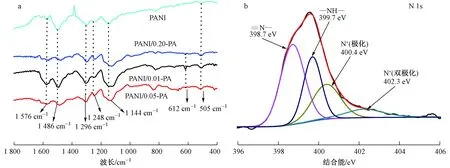
图1 3种浓度PA掺杂制备的PANIPA复合材料的红外光谱图和N1s XPS图谱Fig.1 FTIR of PANIPA adsorbents doped by phytic acid with three different concentrations and N1s XPS of PANIPA

图2 PANIPA复合材料的SEM图谱Fig.2 SEM image of PANIPA composites
2.2 不同浓度PA掺杂吸附剂和溶液pH对吸附量的影响

注: C0=50 mgL; T=298 K;接触时间为6 h. 图4 不同pH下PANIPA对Cr(Ⅵ)的吸附作用和电位变化Fig.4 Adsorption effect of Cr(Ⅵ) on the PANIPA composite and its potential change at different pH
不同浓度PA掺杂的吸附剂对Cr(Ⅵ)吸附效果如图3所示. 由图3可见,0.05 molL PA掺杂的PANIPA对Cr(Ⅵ)的吸附量最高,表明随着PA掺杂浓度升高吸附材料活性位点增加,然而过高掺杂量可能会占据PANI上氨基和亚胺基活性基团,降低吸附材料对Cr(Ⅵ)去除效果. 不同pH对材料吸附性能如图4(a)所示:PANIPA复合材料在酸性条件比在碱性条件下对Cr(Ⅵ)的去除效果好,pH为4时达到最大吸附容量. pH较低时,Cr(Ⅵ)主要以HCrO4-存在[19],PANIPA亚胺基团的氮原子优先被质子化,导致PANIPA表面带正电荷〔见图4(b)〕,促进了复合材料与HCrO4-的静电吸引作用. 同时,在酸性条件下,Cr(Ⅵ)的氧化电位较高,PANIPA具有大量还原作用的亚胺基团,可以将Cr(Ⅵ)还原成Cr(Ⅲ),也进一步降低Cr(Ⅵ)浓度;对Cr(Ⅵ)还原反应需消耗氢离子,酸性条件会促进还原反应发生. 然而,强酸性条件不利于Cr(Ⅲ)的螯合[20],引起pH在2~4之间材料对总Cr的吸附容量相对降低. 溶液pH为碱性时,主要以CrO42-形式存在[16],复合材料亚胺基团开始去质子化,PANIPA表面开始带负电荷〔见图4(b)〕,与CrO42-存在静电斥力作用,且OH-与CrO42-竞争复合材料上的吸附位点[21]导致复合材料对Cr(Ⅵ)的吸附能力急剧下降. 随着溶液pH升高,还原生成的Cr(Ⅲ)可以被PANIPA表面带负电的磷酸基团捕获,引起溶液中Cr(Ⅲ)浓度下降,然而高pH下Cr(Ⅵ)的氧化还原作用下降,对总Cr的去除效果也下降.
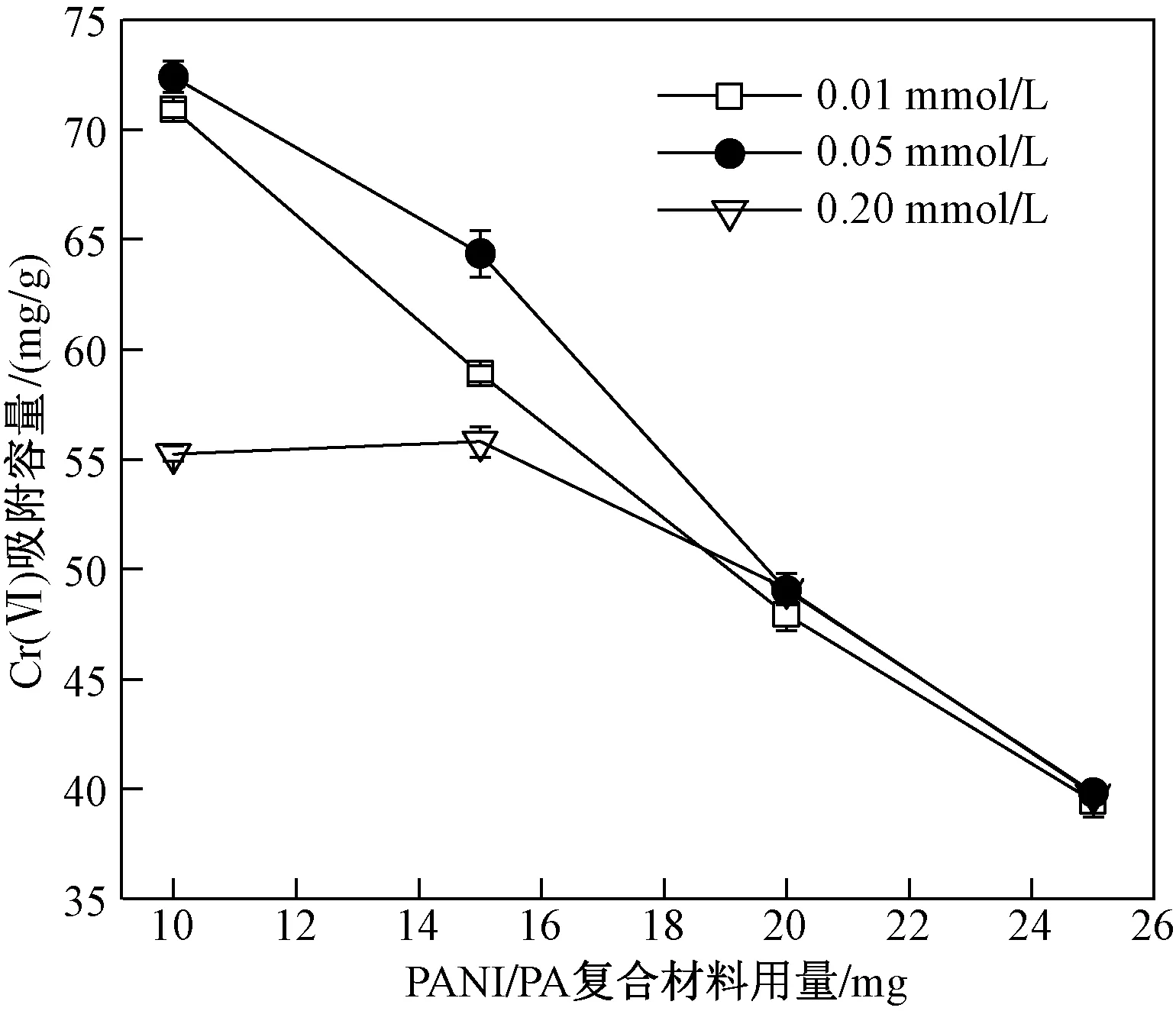
图3 3种PA掺杂的PANIPA复合材料浓度对Cr(Ⅵ)的吸附效果Fig.3 Adsorption capacities of Cr(Ⅵ) on the PANIPA composites doped by phytic acid with three different concentrations
2.3 吸附动力学

初始Cr(Ⅵ)浓度(mgL): 1—50; 2—75.图5 吸附时间对Cr(Ⅵ)吸附能力的影响Fig.5 Time dependent adsorption capacity of Cr(Ⅵ) on the PANIPA composite
利用准一级动力学模型、准二级动力学模型和Morris-Weber颗粒内扩散模型分别模拟PANIPA对初始浓度为50 mgL和75 mgL Cr(Ⅵ)溶液的吸附动力学过程〔见图5(b)(c)(d)〕. 由表1可见:准二级动力学模型对2种浓度的吸附动力学数据拟合相关系数(R2)均达到了0.999,且模拟吸附容量与试验的吸附容量较吻合,表明吸附剂和Cr(Ⅵ)间共享或者交换电子的化学吸附作用是限制PANIPA对Cr(Ⅵ)的吸附速率的关键机制[22]. 准二级动力学模型平衡速率常数(K2)随着Cr(Ⅵ)初始浓度的升高而下降,表明较高的初始浓度需要更长的时间达到平衡[23].
化学吸附作用并不能独立于物质传输过程来控制固液界面的反应过程,可见多种过程控制材料对Cr(Ⅵ)的吸附过程[12,24]. 因此,利用Morris-Weber颗粒内扩散模型来探讨Cr(Ⅵ)在吸附到复合材料上的质量传输过程. 分段线性回归显示:Cr(Ⅵ)被吸附的过程呈现3个阶段〔见图5(d)〕. 第1阶段受外部质量传输引起的薄膜扩散作用控制;第2阶段主要由于表面活性基团逐步被占据,Cr(Ⅵ)逐渐向内部扩散;第3阶段为颗粒内部扩散,趋于吸附平衡. 因此,颗粒内部扩散不是整个反应的速率唯一限制步骤[25],还存在其他反应过程限制速率[26].
表1 PANIPA对Cr(Ⅵ)吸附动力学拟合参数
Table 1 Fitting parameters for Cr(Ⅵ) adsorption kinetics on the PANIPA composite
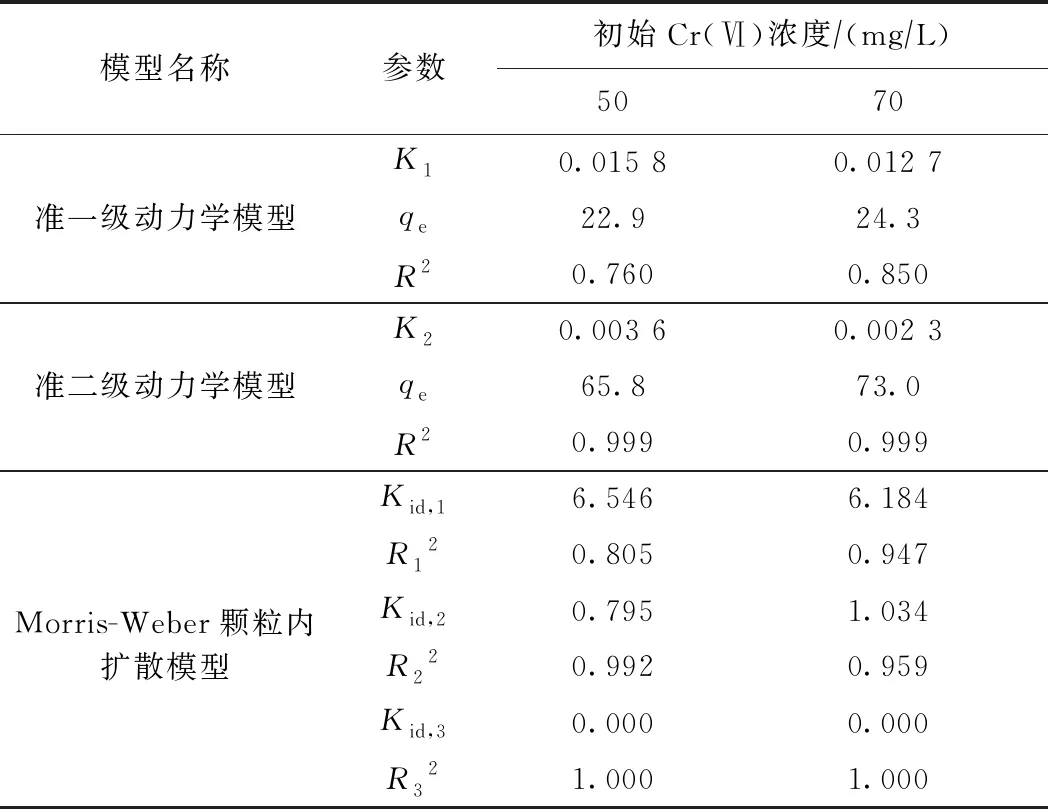
表1 PANIPA对Cr(Ⅵ)吸附动力学拟合参数
模型名称参数初始Cr(Ⅵ)浓度∕(mg∕L)5070K10.015 80.012 7准一级动力学模型qe22.924.3R20.7600.850K20.003 60.002 3准二级动力学模型qe65.873.0R20.9990.999Kid,16.5466.184R120.8050.947Morris-Weber颗粒内扩散模型Kid,20.7951.034R220.9920.959Kid,30.0000.000R321.0001.000
注: K1为准一级动力学模型平衡速率常数,min-1;K2为准二级动力学模型平衡速率常数,g(mg·min);Kid为Morris-Weber颗粒内扩散模型常数,g(mg·min2);qe为计算模拟得到的吸附平衡容量,mgg;R2为相关系数.
2.4 等温吸附模型和吸附热力学模型
在298、308和318 K下,Langmuir等温吸附模型、Freundlich等温吸附模型和D-R等温吸附模型拟合结果表明〔见图6(b)(c)(d)〕:Langmuir等温吸附模型拟合效果最好,相关系数(R2)接近1,表明该吸附过程主要是单分子层吸附[27]. 由表2可见:在298、308、318 K下,PANIPA对Cr(Ⅵ)的最大吸附容量分别达95.2、97.1、99.0 mgg,均高于PANI-聚乙二醇复合材料(68.9 mgg,pH=5)[28]、PANI-腐殖酸复合材料(29.0 mgg,pH=5,298 K)[29]和PANI-聚苯乙烯纤维(58.0 mgg,pH=4)[30]. 吸附容量和KL(Langmuir等温吸附模型常数)均随着温度升高而增加(见表2),表明该吸附是一个吸热过程.
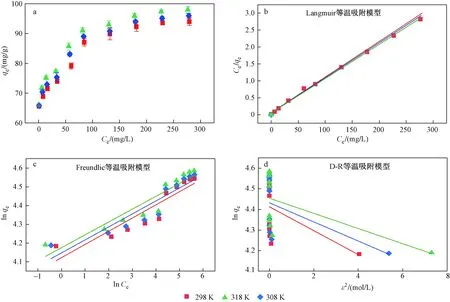
图6 PANIPA对Cr(Ⅵ)的等温吸附模型Fig.6 Adsorption isotherm fitting models of Cr(Ⅵ) adsorption on the PANIPA composite
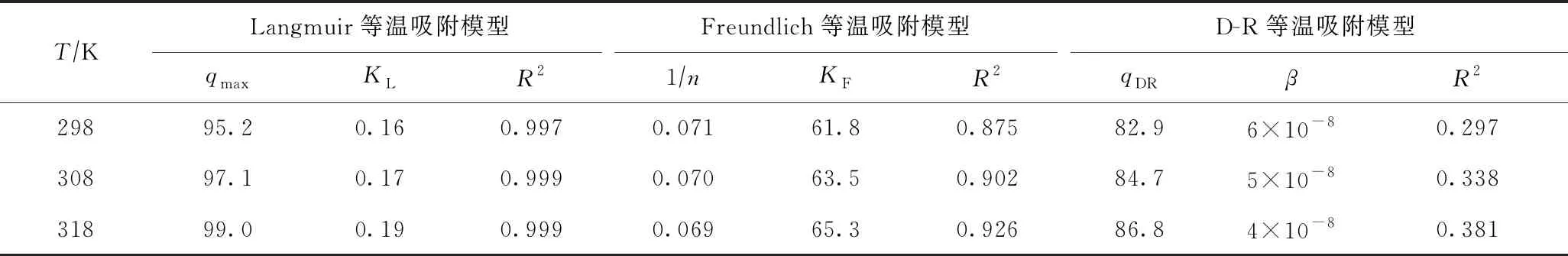
表2 等温吸附模型的参数
对吸附过程进行热力学分析发现,298、308、318 K下的吉布斯自由能分别为-10.9、-11.9、-12.9 kJmol,表明吸附过程可以自发进行[31],且在一定范围内温度越高越有利于吸附进行. 标准摩尔反应焓(ΔH0)为18.2 kJmol,说明该反应是吸热反应,与不同温度下的吸附等温线的变化趋势一致(见图6). 标准摩尔反应熵(ΔS0)为97.7 J(K·mol),表明Cr(Ⅵ)被吸附到复合材料上的随机性增加[32-33].
2.5 PANIPA的XPS分析
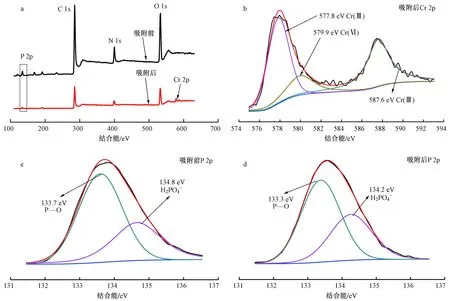
图7 吸附前后PANIPA复合材料的XPS图谱分析Fig.7 XPS spectra of PANIPA composites before and after adsorption
2.6 共存无机阴离子和金属离子对Cr(Ⅵ)吸附的影响
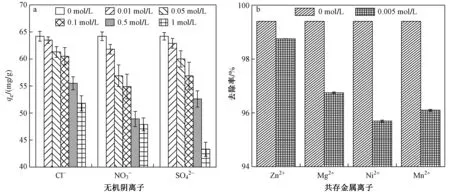
图8 无机阴离子和共存金属离子浓度对Cr(Ⅵ)吸附的影响Fig.8 Effect of concentration inorganic anions and co-existing metal ions on Cr(Ⅵ) adsorption
工业废水除含有多种金属离子,还含有一些无机阴离子(Cl-、NO3-、SO42-)等,可能对Cr(Ⅵ)在复合材料上的吸附产生影响. 由图8(a)可见:在低浓度阴离子溶液中,3种阴离子对Cr(Ⅵ)吸附的影响均较小;当浓度逐渐增大时,对吸附的影响程度略有增加. 主要由于无机阴离子会中和PANIPA上的部分正电荷,减弱PANIPA与Cr溶液中Cr2O72-、HCrO4-间的静电引力作用,但未明显降低对Cr(Ⅵ)的吸附容量.
多种金属离子共存可能与Cr(Ⅵ)竞争吸附材料上的吸附位点. 采用Zn2+、Mg2+、Mn2+、Ni2+作为共存离子,研究多种重金属共存下,PANIPA对Cr(Ⅵ)的吸附影响. 为减少金属化合物引入的无机阴离子影响,根据上述试验结果,金属离子的浓度设为0.005 molL,与50 mgL Cr(Ⅵ)溶液(摩尔浓度约为0.001 molL)混合进行竞争吸附试验,结果显示,PANIPA对Cr(Ⅵ)的吸附没有明显下降,其他金属离子对Cr(Ⅵ)吸附的影响较小〔见图8(b)〕. 主要是由于在pH为4.0的溶液中,其他金属离子主要以带正电荷的离子形式存在,与质子化带正电的复合材料产生静电排斥作用,占据较少的吸附位点. 因此,PANIPA对Cr(Ⅵ)具有较强的选择吸附性.
