24-表油菜素内酯对干旱胁迫下辣椒叶片快速叶绿素荧光诱导动力学曲线的影响
2021-02-26胡文海闫小红李晓红曹灶桂
胡文海 闫小红 李晓红 曹灶桂
(1. 井冈山大学生命科学学院,吉安 343009;2. 江西省生物多样性与生态工程重点实验室,吉安 343009)
干旱是农业生产中影响最大的气候灾害,严重影响作物的生长发育[1]。植物光合作用极易受到环境胁迫的影响,干旱引起气孔关闭和Calvin循环中关键酶活性的降低,从而限制了光合碳同化的进行,导致光合电子传递链的过度还原和过剩激发能的产生,造成植物光抑制甚至光合机构的破坏[2~3]。
快速叶绿素荧光诱导动力学曲线(OJIP 曲线)反映了PSⅡ的原初光化学反应及光合机构的结构和状态等变化[4~5]。快速叶绿素荧光诱导动力学分析(JIP-test)是以生物膜能量流动为基础建立的分析方法,通过JIP-test 分析能够获得环境条件对光合机构主要是PSⅡ供体侧、受体侧和PSⅡ反应中心的影响[5]。研究表明,干旱胁迫导致小麦叶片OJIP 曲线发生变化,造成PSⅡ反应中心失活,PSⅡ受体侧QA传递电子的能力和质体醌(PQ)库接受电子的能力下降;同时反应中心热耗散能力得到促进,对电子传递链起到一定的保护作用[6]。干旱胁迫也导致沙枣和孩儿拳头PSⅡ反应中心[7],白榆放氧复合体[8]受到一定程度的破坏。
油菜素内酯(Brassinosteroids,BRs)可以提高作物对各种生物和非生物胁迫的抗性,并在农业生产中得以广泛应用[9]。已有的研究表明,BRs能够改善干旱胁迫下辣椒叶片的光合碳同化和PSⅡ光化学反应,并促进PSⅡ天线色素热耗散能力的增强以缓解干旱光抑制对光合机构的伤害[10]。但是利用快速叶绿素荧光诱导动力学技术,探究BRs 对PSⅡ反应中心以及光合电子传递链的影响仍较少。本研究以辣椒为材料,研究外源BRs对干旱胁迫下辣椒叶片快速叶绿素荧光诱导动力学特性的影响,探讨BRs提高作物耐旱性的光合生理机制。
1 材料与方法
1.1 试验材料和处理
供试辣椒材料为超辣9 号(Capsicum annuum L.cv Chaola No.9)。将辣椒种子播种于装有草碳土的30 cm×30 cm 塑料花盆中,置于连栋大棚中培养,浇灌园试营养液进行水肥管理。植株长至20~25 叶时,选取长势基本一致的植株移入含500 mL园试营养液的培养容器中培养,适应7 d 后进行处理。实验期间温度范围为18~28℃,最大光照强度约600 μmol·m-2·s-1。
采用0.1 μmol·L-1的24-表油菜素内酯(EBR,Sigma 公司)对植株叶片上下均匀喷施进行BRs 处理,采用15%的PEG6000 模拟干旱胁迫。试验共设4 处理:①对照处理(CK):叶片喷施清水,培养在园试营养液中;②EBR 处理(EBR):叶片喷施0.1 μmol·L-1的EBR,培养在园试营养液中;③模拟干旱处理(D):叶片喷施清水,培养在PEG6000 浓度为15%的园试营养液中;④模拟干旱和EBR 协同处理(D+EBR):叶片喷施0.1 μmol·L-1的EBR,培养在PEG6000浓度为15%的园试营养液中。处理第4天选择成熟叶进行OJIP曲线测定。
1.2 测定项目和方法
1.2.1叶片相对含水量测定
植株叶片相对含水量(LRWC)的测定:先称取叶片鲜重(Mf),然后将叶片完全浸泡在蒸馏水中并置于黑暗中12 h 后称取饱和鲜量(Mt),再将叶片置于烘箱中110℃杀青1 h 后再80℃下48 h 烘干至恒重,称取其干重(Md),并计算叶片相对含水量:
1.2.2 OJIP曲线测定与JIP-test参数计算
采用便携式植物效率仪Handy-PEA(Hansat⁃ech,英国)测定叶片OJIP 曲线。叶片充分暗适应30 min后测定,OJIP曲线由1 500 μmol·m-2·s-1红光诱导,测定时间为1 s。JIP-test 参数的计算方法参见李鹏民等[5]和van Heerden 等[11]文献,相关参数及其含义见表1。参照苏晓琼等[12]的方法计算相对可变荧光(ΔVt):
式中:ΔK-、ΔJ-和ΔI-band 分别为在300 μs、2 ms和30 ms处测定的ΔVt。

表1 JIP测定分析所用的参数和公式Table 1 Parameters and formulae used in JIP-test anal⁃ysis
1.2.3数据统计
利用SPSS11.5 数据分析软件进行实验数据的统计检验。采用one-way ANVOA 最小显著性差异(LSD)检验,在P<0.05 水平上进行分析。数据均为平均值±标准误差,图表中不同字母表示在5%水平上处理间具有显著性差异。
2 结果与分析
2.1 对叶片相对含水量和光合性能的影响
干旱处理4d 导致叶片相对含水量大幅下降,施用EBR 对不同处理下叶片相对含水量没有影响;相比对照而言,干旱处理显著降低了辣椒叶片Fv/Fm、Fv/Fo和PIABS,EBR 处理则有效缓解了干旱胁迫所引起的这些参数的下降,而正常水分条件下喷施EBR 对辣椒叶片Fv/Fm、Fv/Fo和PIABS差异不显著(P>0.05)(见表2)。

表2 EBR对干旱胁迫下辣椒叶片相对含水量和光合性能的影响Table 2 Effect of EBR on LRWC and photosynthetic per⁃formance in leaves of pepper under drought stress
2.2 对叶片OJIP曲线的影响
与对照相比较,干旱处理导致OJIP 曲线发生变形,Ⅰ相(30 ms)和P 相(最大荧光)大幅下降;EBR处理可使干旱胁迫下OJIP曲线部分恢复到对照线型,而正常水分条件下喷施EBR 对OJIP 曲线影响不明显(见图1A)。将OJIP 曲线标准化后,可以看出EBR 明显缓解了干旱胁迫下ΔK-band 和ΔJ-band的增高,而正常水分条件下EBR 处理则对ΔK-band、ΔJ-band 和ΔI-band 没有明显影响(见图1B)。干旱胁迫下,EBR 处理并未减轻Fo增加,但缓解了Fm的下降;正常水分下EBR 处理则对Fo和Fm未产生影响(见图2)。
2.3 对PSⅡ受体侧的影响
与对照相比,干旱导致Mo和VJ增加,降低了Sm、ψo、φEo和φRo,对VI虽有促进但未产生显著影响;EBR 处理缓解了干旱胁迫下ψo的降低,对其他参数虽有改善但与干旱处理间差异不显著(P>0.05)。而正常水分处理下EBR 处理未引起这些参数的明显变化(见表3)。
2.4 对比活性参数的影响
由表4 可知,与对照相比较,干旱处理降低了RC/CS、ABS/CS、TRo/CS 和ETo/RC,增加了DIo/CS;EBR 处理则缓解了干旱胁迫下RC/CS、ABS/CS、TRo/CS 和ETo/CS 的降低,但DIo/CS 仍保持与干旱处理相同的程度。然而,干旱促进了ABS/RC、TRo/RC 和DIo/RC 的增加,分别比对照增加了22.1%、10.3%和62.7%,但并未影响ETo/RC;EBR 处理对干旱胁迫下TRo/RC 的增加略有缓解外,其他参数均与干旱处理无显著差异。正常水分处理下EBR处理未引起这些参数的明显变化。
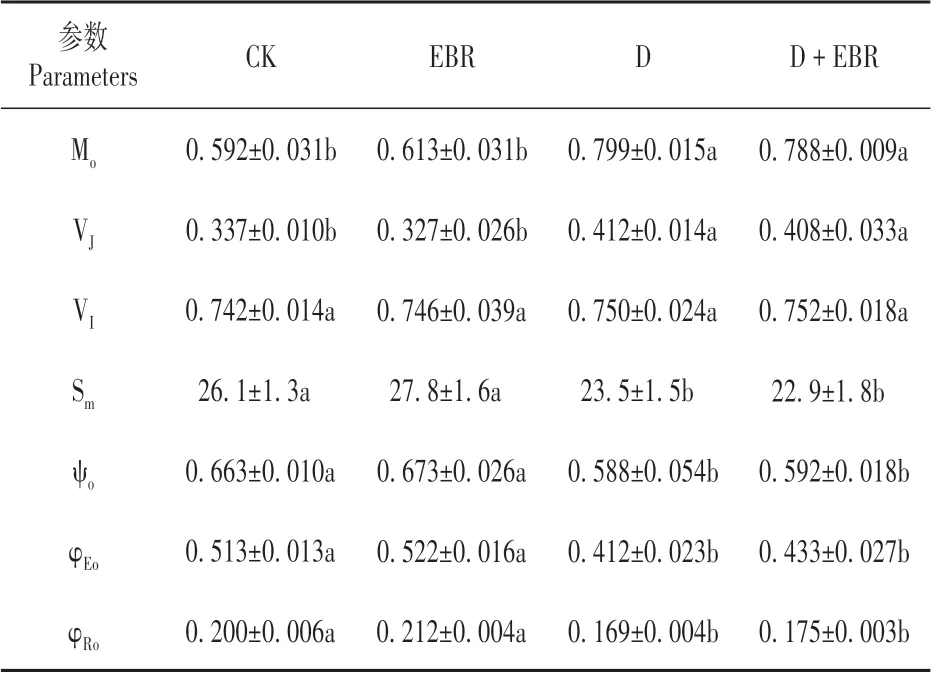
表3 EBR对干旱胁迫下辣椒叶片Mo、VJ、VI、Sm、ψo、φEo和φRo的影响Table 3 Effect of BR on Mo,VJ,VI,Sm,ψo,φEoand φRo in leaves of pepper under drought stress

表4 EBR对干旱胁迫下辣椒叶片比活性参数的影响Table 4 Effect of EBR on specific energy fluxes in leaves of pepper under drought stress
3 讨论
光合作用是对逆境最为敏感的生理过程之一。逆境胁迫下当光合机构吸收的光能超过其所能利用的数量时,过剩光能引起光合活性降低,导致光抑制发生,通常植物光抑制程度用Fv/Fm表示[13]。利用快速叶绿素荧光诱导动力学技术获得的光合性能指数(PIABS)对某些胁迫的敏感性高于Fv/Fm,能更好地反映胁迫对光合机构的影响[5,11]。我们的实验结果表明,干旱处理导致了辣椒叶片Fv/Fm、Fv/Fo和PIABS的下降,而EBR 处理则有效缓解了这些参数的下降,这说明干旱胁迫降低了辣椒叶片的光化学效率和光合性能,EBR 处理对干旱胁迫下辣椒叶片光合机构和光合性能具有保护作用,减轻了干旱光抑制程度。
快速叶绿素荧光诱导动力学曲线包含了大量关于PSⅡ反应中心原初光化学反应信息,通过对曲线的分析可以深入了解环境条件对光合机构,主要是PS Ⅱ供体侧、受体侧和反应中心的影响[4~5,14]。OJIP 曲线中J 相反映了QA-的第一次瞬间最大积累,J 相荧光上升意味着PSⅡ受体侧QA到QB间的电子传递受阻[15~16]。如果在OJIP 曲线上升至J相前出现K点,则反映了PSⅡ供体侧放氧复合体(OEC)受到损伤[17]。本实验结果表明,EBR 处理可有效缓解干旱胁迫下辣椒叶片ΔK-band 和ΔJ-band 的上升,这说明干旱胁迫既损伤了辣椒叶片PSⅡ供体侧OEC,同时也抑制了受体侧的电子传递,而EBR 处理对PSⅡ供体侧和受体侧均起到了保护作用[12,18]。
我们的实验结果还表明,Fv/Fm的下降主要是由于干旱胁迫导致Fo的增加和Fm的下降所致,这表明干旱胁迫对辣椒叶片PSⅡ反应中心和受体侧均造成伤害,电子传递能力明显下降[12,19]。有研究表明干旱胁迫导致抗旱性弱的小麦品种PSⅡ反应中心失活,使得天线色素吸收的光能向PSⅡ的传递减少[6]。VJ和VI反映了在J 点和I 点关闭的反应中心数量,即QA-的积累量[6]。其中VJ增高是PSⅡ受体侧QA向次级醌受体QB电子传递受阻的特异性标志,VI增高则表明PQ 库接受电子的能力下降[4,20]。干旱胁迫导致小麦PSⅡ受体侧QA向次级醌受体QB 电子传递受阻,同时也降低了质体醌PQ 库接受电子的能力[6]。我们的结果则表现为干旱处理导致VJ的增加,说明PSⅡ受体侧QA向QB电子传递受阻;然而干旱处理并未对VI造成影响,说明干旱并未影响到质体醌PQ 库接受电子的能力。这一结果与原佳乐等[6]在小麦干旱中的研究结果不一致,这可能与干旱处理程度和作物种类有关。进一步分析显示,干旱处理降低了ψo、Sm、φEo和φRo,但促进了Mo的上升,这表明干旱胁迫导致有活性的PSⅡ反应中心开放程度和PQ库容量下降,PSⅡ受体侧QA传递电子的能力下降。EBR处理促进了干旱胁迫下ψo的恢复,说明EBR 处理改善了干旱胁迫下叶片PSⅡ受体侧的电子传递。虽然干旱和EBR 协同处理下辣椒叶片Mo、VJ、φEo和φRo值与干旱胁迫下叶片的值之间没有显著差异,但这些参数比干旱处理植株更接近对照,这表明EBR可能从整体上对干旱胁迫下辣椒叶片PSⅡ受体侧的电子传递具有改善作用。
正常条件下,PSⅡ反应中心捕获的光能转化为激发能,其中大部分激发能转化为化学能推动碳同化,其余部分则以热的形式耗散掉;然而在逆境胁迫下,PSⅡ反应中心发生可逆失活,失活的PSⅡ反应中心能够吸收光能但并不传递给电子传递链[5,16]。王振山等[21]研究表明,干旱胁迫通过干扰山葡萄叶片PSⅡ电子供体侧、受体侧以及电子传递链的功能,严重伤害了叶片光合机构的正常功能。我们的实验结果也表明,干旱导致叶片单位叶面积有活性的PSⅡ反应中心数目(RC/CS)显著减少,单位叶面积吸收的光能(ABS/CS)明显降低,这意味着干旱胁迫导致了反应中心的降解或失活,并减少了天线色素对光能的捕获[22~23]。单位叶面积有活性反应中心数目的减少近而使得单位叶面积捕获的光能(TRo/CS)和进行电子传递的能量(ETo/CS)下降,同时诱导了热耗散(DIo/CS)的增加。这说明辣椒遭受干旱胁迫后启动了相应的防御机制,一方面通过PSⅡ的可逆失活和减少光能吸收以防御光能的过度积累,另一方面通过促进热耗散途径减少过剩激发能的积累[5]。然而,干旱胁迫促进了单位反应中心吸收光能(ABS/RC)、捕获光能(TRo/RC)和热耗散(DIo/RC)的增加,这可能是由于干旱使得单位叶面积有活性反应中心数目下降后的补偿反应,剩余的有活性的反应中心效率的提高有利于更好地消耗电子传递链中的能量[5]。研究表明BRs具有促进植物光合作用,并可缓解逆境胁迫对光合作用的伤害[9,24]。干旱胁迫下EBR 处理缓解了辣椒叶片RC/CS 的减少,以及ABS/CS、TRo/CS和ETo/CS的下降,并且维持较高的DIo/CS。虽然干旱胁迫下EBR 处理减轻了RC/CS的下降,但仍保持了相对较高ABS/RC、TRo/RC 和DIo/RC。这表明EBR 处理对干旱胁迫下PSⅡ反应中心具有保护作用,其原因可能是EBR 促进了光合作用和热耗散的进行,防止了光合电子传递链的过度还原,从而对光合电子传递链和反应中心起到保护作用[10,25]。
