LINC00339调控miR-195-5p对高糖作用的成骨细胞增殖和凋亡的影响
2021-02-26窦越超王雪飞
窦越超 王雪飞
糖尿病性骨质疏松症(diabetes osteoporosis,DOP)是糖尿病的一种并发症,是由于血糖升高导致骨组织代谢紊乱而引起的骨组织结构破坏、骨量减少、骨脆性增加、易引发骨折为特征的全身性骨骼疾病,严重影响患者生活质量,目前尚无有效药物治疗DOP,亟需开发新的治疗药物和方法[1]。成骨细胞是促进骨形成的主要功能细胞,成骨细胞凋亡是引起骨质疏松的重要原因,研究成骨细胞的凋亡机制对预防和治疗骨质疏松症具有重要意义[2]。长链非编码RNA(long non-coding RNA,lncRNA)参与了多种生物学过程,与骨质疏松也密切相关,可作为骨质疏松(osteoporosis,OP)骨代谢过程中的生物标志物,为OP诊断、治疗及判断预后提供新的靶标[3]。有研究报道rs3820282是染色体1p36.12上具有最强子宫内膜异位症风险关联的单核苷酸多态性(single nucleotide polymorphism,SNP),通过细胞分裂周期蛋白42(cell division cycle protein 42,CDC42)和LINC00339的反向调节起作用[4]。染色体1p36.12的骨质疏松症风险SNP rs6426749-G等位基因可以提高LINC00339的表达,而LINC00339的下调可促进骨代谢关键调节因子CDC42的表达,表明LINC00339可能与骨质疏松症有关[5]。但目前笔者未发现LINC00339对成骨细胞生物行为的影响及其机制还未有研究。研究发现miR-195-5p通过靶向成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)抑制子宫内膜癌细胞的增殖、侵袭和迁移并促进细胞凋亡,其可作为子宫内膜癌的治疗靶点[6]。上调miR-195-5p通过降低其靶基因骨形态发生蛋白受体-1α(bone morphogenetic protein receptor-1α,Bmpr1α)的表达可降低骨髓间充质干细胞的成脂分化,改善骨质疏松症状[7]。本实验旨在研究LINC00339和miR-195-5p对成骨细胞增殖、凋亡的影响及LINC00339是否通过调控miR-195-5p影响成骨细胞的增殖和凋亡。为骨质疏松的预防和治疗提供新思路和新靶点。
1 材料与方法
1.1 材料 成骨细胞hFOB1.19购自上海通派生物科技有限公司;DMEM培养基、胎牛血清购自美国Sigma公司;胰蛋白酶购自美国Gibco公司;Lipofectamine TM 2000转染试剂盒、RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒购自美国Invitrogen公司;二辛可宁酸(BCA)试剂盒、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、十二烷基硫酸钠,钠盐-聚丙烯酰胺凝胶电泳(dodecyl sulfate,sodium salt-Polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒、四甲基偶氮唑盐(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自上海碧云天生物技术有限公司;抗体均购自北京博奥森生物科技有限公司;载体质粒均购自上海斯信生物科技有限公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司。Bio-Rad2550型全自动酶标仪、FACSCanto Ⅱ流式细胞仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养与分组:将hFOB1.19细胞在37℃的培养箱中,用含10%胎牛血清的DMEM培养液培养,每隔2~3 d传代1次,将融和至80%的细胞无血清饥饿培养24 h,用终浓度为22 mmol/L的葡萄糖溶液培养细胞48 h作为高糖组,同时以终浓度为5 mmol/L的葡萄糖溶液处理作为对照组。将pcDNA3.1、pcDNA3.1-LINC00339、si-NC、si-LINC00339分别转染至正常hFOB1.19细胞中,记为pcDNA3.1组,pcDNA3.1-LINC00339组、si-NC组、si-LINC00339组。将si-NC、si-LINC00339转染至高糖处理的hFOB 1.19细胞中,记为高糖+si-NC组、高糖+si-LINC00339组;将si-LINC00339与anti-miR-NC、anti-miR-195-5p分别共同转染至高糖处理的hFOB1.19细胞中,记为高糖+si-LINC00339+anti-miR-NC、高糖组+si-LINC00339+anti-miR-195-5p组;转染按Lipofectamine TM 2000转染试剂盒进行。
1.2.2 荧光实时定量PCR(quantitative real-time PCR,qRT-PCR)检测miR-195-5p和LINC00339的表达水平:提取总RNA,将RNA逆转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,miR-195-5p和LINC00339分别以U6和GAPDH为内参,每个样品设3个重复,循环条件为95℃ 5 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量用2-ΔΔCt法计算。miR-195-5p上游引物序列:5’-GATAGCAGCACAGAAATATTGGC-3’,下游引物序列:5’-CAGTGCGTGTCGTGGAGT-3’;U6上游引物序列:5’-CTGGTAGGGTGCTCGCTT-3’,下游引物序列:5’-CGGCAGCAACTGGTGTCGTGGA-3’;LINC00339上游引物序列:5’-GGTTGACGAAGTCTGGAACG-3’,下游引物序列:5’-GCCCATCATTTCATTGGGTA-3’;GAPDH上游引物序列:5’-GGTGAAGGTCGGAGTCAACG-3’,下游引物序列:5’-CCATGTAGTTGAGGTCAATGAAG-3’。
1.2.3 蛋白质印迹(Western Blot)检测细胞周期素D1(CyclinD1)、P21、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、骨形态发生蛋白-2(BMP-2)表达水平:各组细胞培养48 h后提取总蛋白,BCA法测定蛋白浓度。将蛋白样品用SDS-PAGE电泳转至聚偏二氟乙烯膜(PVDF)上,用5%脱脂奶粉室温封闭2 h,加入一抗4℃过夜,TBST洗涤3次;加入二抗室温孵育90 min,TBST洗涤3次,用ECL发光法染色,用ChemiDoc XRS+系统成像,用Quantity One凝胶分析软件处理,检测蛋白条带的灰度值,蛋白相对表达水平=目的条带灰度值/GAPDH条带灰度值。每个蛋白样品设3个重复。
1.2.4 MTT检测细胞活性:各组细胞培养24 h、48 h、72 h时,每孔加入5 mg/ml MTT溶液20 μl,置于37℃培养箱培养4 h;1 000 r/min离心10 min,吸弃培养液,每孔加150 μl的DMSO,振荡10 min,使结晶物充分溶解。酶标仪上检测490 nm波长的吸光度(OD)值。细胞活性(%)=实验组OD值/空白对照组OD值×100%。实验重复3次,每次设3个复孔。
1.2.5 流式细胞术检测细胞凋亡:各组细胞培养48 h后用预冷的PBS漂洗2次,与500 μl的结合缓冲液混匀。先加入10 μl的Annexin V-FITC,再加入5 μl的PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
1.2.6 荧光素酶报告基因检测实验检测LINC00339对miR-195-5p的靶向调控:构建LINC00339野生型和突变型3′UTR荧光素酶表达载体WT-LINC00339和MUT-LINC00339,用LipofectamineTM 2000将WT-LINC00339和MUT-LINC00339分别与miR-NC和miR-195-5p共转染至转染hFOB1.19细胞中。按照说明书操作检测荧光活性,实验重复3次。
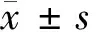
2 结果
2.1 LINC00339、miR-195-5p在高糖作用的细胞hFOB1.19中的表达 与对照组比较,高糖组细胞hFOB1.19中LINC00339表达水平显著升高,miR-195-5p表达水平显著降低(P<0.05)。在高糖作用的细胞hFOB1.19中LINC00339高表达,miR-195-5p低表达。见表1。

表1 LINC00339、miR-195-5p在高糖作用的细胞hFOB1.19中的表达
2.2 抑制LINC00339对高糖作用的细胞hFOB1.19增殖的影响 与高糖+si-NC组比较,高糖+si-LINC00339组细胞hFOB1.19中LINC00339表达水平显著降低,Cyclin D1表达水平显著升高,P21表达水平显著降低,细胞活性显著升高(P<0.05)。抑制LINC00339表达促进高糖作用的细胞hFOB1.19增殖。见图1,表2。

图1 抑制LINC00339对高糖作用的细胞hFOB1.19增殖蛋白表达的影响;1 高糖+si-NC,2 高糖+si-LINC00339

表2 抑制LINC00339对高糖作用的细胞hFOB1.19增殖的影响
2.3 抑制LINC00339对高糖作用的细胞hFOB1.19凋亡及BMP-2的表达的影响 与高糖+si-NC组比较,高糖+si-LINC00339组细胞hFOB1.19中BMP-2、Bcl-2表达水平显著升高,Bax表达水平显著降低,细胞凋亡率显著降低(P<0.05)。抑制LINC00339抑制高糖作用的细胞hFOB1.19凋亡及促进BMP-2表达。见图2,表2。

图2 抑制LINC00339对高糖作用的细胞hFOB1.19凋亡及BMP-2的表达的影响;A 抑制LINC00339对高糖作用的细胞hFOB1.19凋亡的影响;B 抑制LINC00339对高糖作用的细胞hFOB1.19凋亡蛋白及BMP-2表达的影响

表3 抑制LINC00339对高糖作用的细胞hFOB1.19凋亡及BMP-2的表达的影响
2.4 LINC00339靶向、调控miR-195-5p TargetScan数据库预测显示LINC00339与miR-195-5p有结合位点。转染野生型和突变型表达载体WT-LINC00339和MUT-LINC00339后,与miR-NC组比较,miR-195-5p组转染野生型细胞hFOB1.19的荧光素酶活性显著降低(P<0.05);而转染突变型细胞hFOB1.19的荧光素酶活性差异无统计学意义(P>0.05)。与pcDNA3.1组比较,pcDNA3.1-LINC00339组miR-195-5p表达水平显著降低;与si-NC组比较,si-LINC00339组miR-195-5p表达水平显著升高(P<0.05)。LINC00339可靶向调控miR-195-5p。见图3,表4、5。

图3 LINC00339靶向miR-195-5p

表4 荧光素酶报告实验
2.5 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19增殖的影响 与高糖+si-NC组比较,高糖+si-LINC00339组细胞hFOB1.19中miR-195-5p表达水平显著升高,Cyclin D1表达水平显著升高,P21表达水平显著降低,细胞活性显著升高(P<0.05);与高糖+si-LINC00339+anti-miR-NC组比较,高糖+si-LINC00339+anti-miR-195-5p组细胞hFOB1.19中miR-195-5p表达水平显著降低,Cyclin D1表达水平显著降低,P21表达水平显著升高,细胞活性显著降低(P<0.05)。抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19增殖的促进作用。见图4,表6。

表5 LINC00339调控miR-195-5p的表达

表6 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19增殖的影响

图4 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19增殖蛋白表达的影响;1 高糖+si-NC;2 高糖+si-LINC00339;3 高糖+si-LINC00339+anti-miR-NC;4 高糖+si-LINC00339+anti-miR-195-5p
2.6 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19凋亡的影响 与高糖+si-NC组比较,高糖+si-LINC00339组细胞hFOB1.19中BMP-2、Bcl-2表达水平显著升高,Bax表达水平显著降低,细胞凋亡率显著降低(P<0.05);与高糖+si-LINC00339+anti-miR-NC组比较,高糖+si-LINC00339+anti-miR-195-5p组细胞hFOB1.19中BMP-2、Bcl-2表达水平显著降低,Bax表达水平显著升高,细胞凋亡率显著升高(P<0.05)。抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19凋亡的抑制作用。见表7,图5。

表7 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19凋亡及BMP-2表达的影响

图5 抑制miR-195-5p能逆转抑制LINC00339对高糖作用的细胞hFOB1.19凋亡蛋白及BMP-2表达的影响;1 高糖+si-NC;2 高糖+si-LINC00339;3 高糖+si-LINC00339+anti-miR-NC;4 高糖+si-LINC00339+anti-miR-195-5p
3 讨论
DOP以高血糖和骨密度减低为特点,近些年来,DOP发病率升高,且易致病理性骨折、致残率高,深入研究其发病机制,控制血糖和OP相关危险因素,有利于防治DOP[8]。有研究表明高糖高脂可抑制成骨细胞分化能力[9];高糖高脂还可时间依赖性抑制成骨细胞增殖,促进凋亡[10]。本实验结果显示,在高糖作用的成骨细胞hFOB1.19中LINC00339表达水平显著升高,miR-195-5p表达水平显著降低。提示,LINC00339和miR-195-5p可能参与成骨细胞的增殖、分化和凋亡等生物学过程。
有研究报道LINC00339在非小细胞肺癌组织和细胞中显著上调,LINC00339沉默通过靶向miR-145调控FOXM1在体外和体内抑制非小细胞肺癌细胞的增殖和侵袭,加速细胞凋亡,抑制肿瘤生长[11]。LINC00339在胶质瘤组织以及胶质瘤细胞系中也上调表达,敲除LINC00339抑制胶质瘤细胞增殖、迁移、侵袭和管形成[12]。LINC00339通过miR-1182/SKA1途径促进肝细胞癌的生长和侵袭[13];LINC00339过表达通过miR-377-3p促进三阴性乳腺癌增殖,抑制细胞周期停滞和抑制细胞凋亡[14]。本实验结果显示,在高糖处理的成骨细胞hFOB1.19中转染si-LINC00339后,细胞活性显著升高,细胞凋亡率显著降低。且细胞周期素D1(CyclinD1)、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)表达水平显著升高,P21、Bcl-2相关X蛋白(Bcl-2 assiociated X protein,Bax)表达水平显著降低;抑制LINC00339表达,骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)表达水平显著升高,而BMP-2可在体内和体外促进间充质干细胞向成骨细胞分化[15]。说明抑制LINC00339表达促进了成骨细胞增殖,抑制了高糖作用的成骨细胞凋亡。
有研究报道miR-195通过靶向SMAD7可促进人骨髓间充质干细胞成骨分化[16]。miR-195-5p高表达可以抑制膀胱癌细胞增殖、促进细胞凋亡[17]。lncRNA XIST通过miR-195-5p靶向YAP促进骨肉瘤细胞增殖和侵袭[18]。本实验结果显示,LINC00339靶向调控miR-195-5p,在高糖作用的成骨细胞中,同时抑制miR-195-5p和LINC00339的表达,Cyclin D1、Bcl-2、BMP-2表达水平显著降低,P21、Bax表达水平显著升高,细胞活性显著降低,细胞凋亡率显著升高。即抑制miR-195-5p逆转了抑制LINC00339对高糖作用的成骨细胞增殖促进和凋亡抑制的作用。说明LINC00339可能通过调控miR-195-5p影响成骨细胞的增殖和凋亡。
综上所述,抑制LINC00339可促进细胞增殖,抑制细胞凋亡,对高糖作用的成骨细胞有保护作用,其机制可能与miR-195-5p表达水平有关。将可为骨质疏松症的预防和治疗提供新策略和新思路。
