藏橐吾的组织培养
2021-02-26李依陆旭郭萌卢娇王俊丽
李依,陆旭,郭萌,卢娇,王俊丽
(中央民族大学 生命与环境科学学院,北京 100081)
藏橐吾Ligulariarumicifolia(Drumm.) S.W.Liu是菊科橐吾属多年生草本植物,分布于中国西藏东南部至东北部,生于海拔3 700~4 500 m的湖边、林下、灌丛及山坡[1].
藏橐吾具有很高的药用价值.《西藏常用中草药》中记载:藏橐吾,藏名日肖,以根部入药,味苦,性温.9~10月份采挖,去除茎叶后洗净晒干,煎汤内服,可散寒、润肺下气、化痰止咳、利尿[2].藏药大典《晶珠本草》记载:日肖功效为吐培根,赤巴合并病,化性凉,愈疮,清解难以发散的旧疫热[3].《中国中药资源志要》记载:藏橐吾可用于治疗风寒咳嗽、支气管炎、肺结核咳血、咽喉炎[4].
藏橐吾作为一种重要的药用资源植物,由于其分布范围窄、生长海拔高,人工引种、驯化困难,加之入药部位仅限于根和根茎,生物量有限,传统的采挖方式使得这一资源更加紧缺.利用离体培养的方法对药用植物进行快速繁殖是扩大药用植物资源、促进资源合理开发利用的重要途径,目前已有很多种植物建立了离体培养方法.例如,奇异南星[5]、华北八宝[6]、华北蓝盆花[7]、新疆雪莲[8]、Harpagophytumprocumbens[9]、Violauliginosa[10]等,而有关藏橐吾组织培养方面的研究鲜见报道.
1 材料与方法
1.1 植物材料
藏橐吾的种子采自西藏米林县南伊沟海拔3 104 m的林下, 将种子去除冠毛后放于4 ℃冰箱保存.
1.2 培养条件
实验所用培养基为MS培养基,培养基中添加质量浓度为30 g/L的蔗糖和7 g/L的琼脂,pH值调为5.8,经121 ℃高压灭菌20 min.培养室温度为(25±2)℃,光照强度为2 000~3 000 lx,光照时间为12 h/d.
1.3 愈伤组织的诱导
将消毒后的种子接种到MS培养基中,在培养室中培养30 d获得无菌苗.将无菌苗子叶切成约0.5 cm×0.5 cm的切块,接种在添加了不同植物生长调节剂的MS培养基上进行诱导培养.每瓶接种5个外植体,每个处理接种10瓶,重复3次.
1.4 不定芽的诱导
分别选取愈伤组织和子叶为外植体,接种在含有不同植物生长调节剂的MS培养基上进行不定芽的诱导培养.每瓶接种5个外植体,每个处理接种10瓶,重复3次.
1.5 生根培养及移栽
选取3 cm左右的不定芽接入生根培养基中,每个处理取30个不定芽,重复3次,30 d后观察统计生根情况.
1.6 统计分析方法
通过SPSS 20.0软件对数据进行方差分析.
2 结果与分析
2.1 TDZ与NAA组合对愈伤组织的诱导效应
将子叶接种在MS+TDZ(1.0、2.0、3.0)mg/L+NAA(0.5、1.0、2.0、4.0)mg/L的培养基中培养30 d,愈伤组织的诱导结果如表1所示.由表1可知,较低质量浓度的TDZ有利于诱导子叶产生愈伤组织.当添加的TDZ质量浓度为1.0 mg/L时,愈伤组织的诱导率最高;TDZ质量浓度升高到3.0 mg/L时,不能诱导子叶产生愈伤组织.在MS+TDZ 1.0 mg/L +NAA 1.0 mg/L的培养基上愈伤组织诱导率为45.33%.因此,诱导子叶产生愈伤组织的适宜培养基为MS+TDZ 1.0 mg/L+NAA 1.0 mg/L.
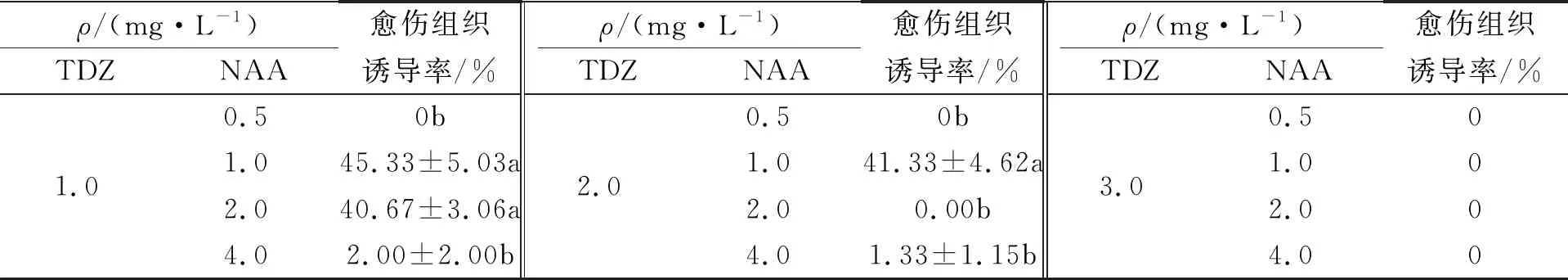
表1 不同质量浓度的TDZ与NAA组合对愈伤组织诱导的影响
2.2 TDZ与NAA组合对不定芽的诱导效应
将诱导出的愈伤组织接种到MS+TDZ(1.0、2.0、3.0、4.0)mg/L + NAA(0.5、1.0、2.0、4.0、6.0)mg/L培养基中,20 d左右出现深绿色的芽点.由表2可知,NAA质量浓度较低时,有利于不定芽的诱导.较适宜的培养基为MS+TDZ 3.0 mg/L+NAA 0.5 mg/L,诱导率为49.42%.
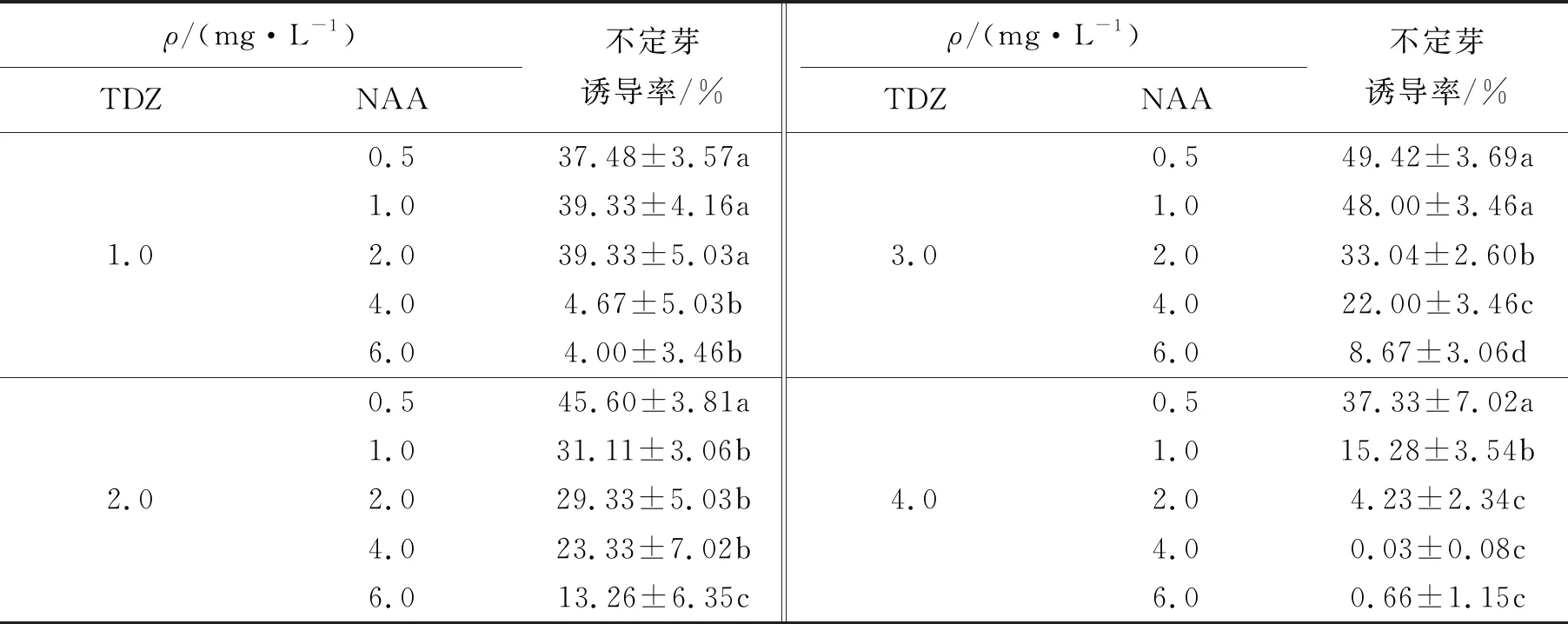
表2 不同质量浓度的TDZ与NAA组合对不定芽诱导的影响
2.3 6-BA与NAA组合对不定芽的诱导效应
将愈伤组织接种到MS+6-BA(1.0、2.0、3.0、4.0)mg/L+NAA(0.1、0.5、1.0、2.0)mg/L培养基中,培养15 d时部分愈伤组织褐化,20 d出现深绿色的芽点.培养30 d后,将愈伤组织取出,轻轻刮去褐化的部分,接种到同种新鲜培养基上继续培养.更换培养基10 d后,开始生成不定芽.6-BA与NAA组合对不定芽的诱导情况如表3所示.从表3可以看出,不定芽的适宜诱导培养基为MS+6-BA 2.0+NAA 0.5 mg/L,诱导率为69.56%,每块愈伤组织可分化出3个左右的绿色不定芽.
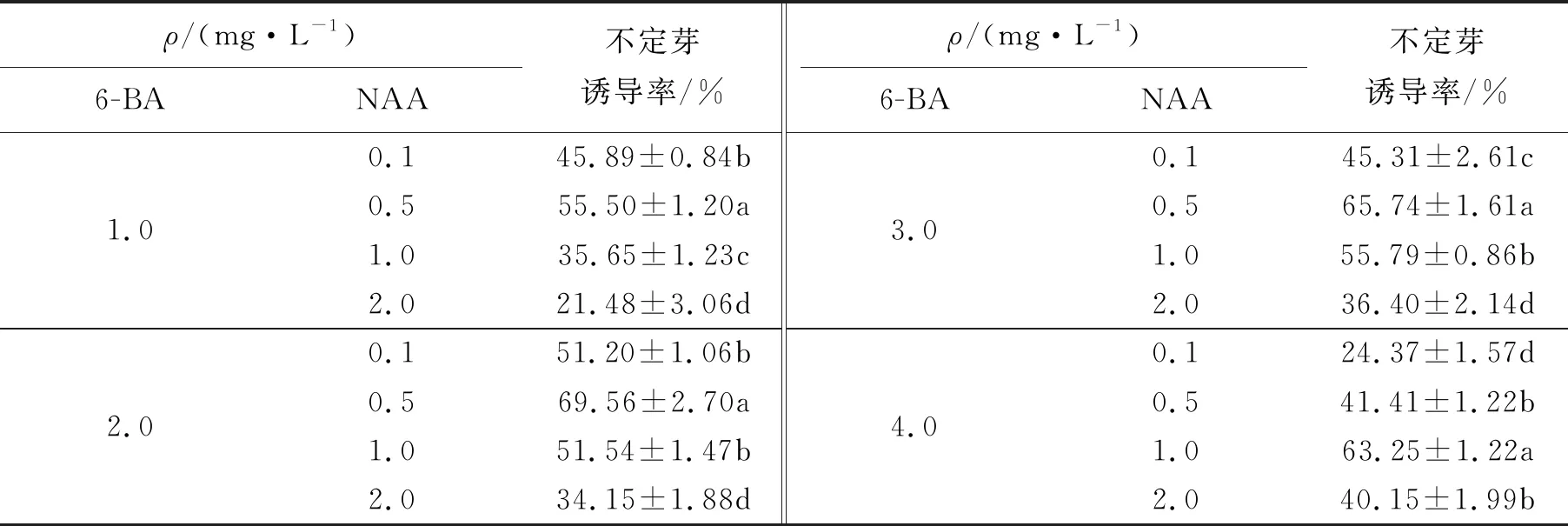
表3 不同质量浓度的6-BA与NAA组合对不定芽诱导的影响
2.4 6-BA与2,4-D组合对子叶分化不定芽的诱导效应
6-BA与2,4-D组合可直接诱导子叶产生不定芽.由表4可知,在MS+6-BA 2.0 mg/L+2,4-D 4.0 mg/L培养基中不定芽的诱导率达到最高值,为55.18%.
2.5 6-BA与NAA组合对子叶分化不定芽的诱导效应
将子叶接种在MS+6-BA(1.0、2.0、3.0、4.0)mg/L+ NAA(0.2、0.4、0.8、1.0、2.0、4.0)mg/L的培养基中,培养20 d左右,在子叶切口处诱导出大量球状凸起,培养至40 d,凸起发育成不定芽.不定芽的诱导情况如表5所示.6-BA质量浓度为4.0 mg/L时,20 d左右外植体在培养基上褐化死亡,不能诱导不定芽生成.诱导不定芽分化的适宜培养基为MS+6-BA 3.0 mg/L+ NAA 0.8 mg/L,诱导率可达到72.33%.
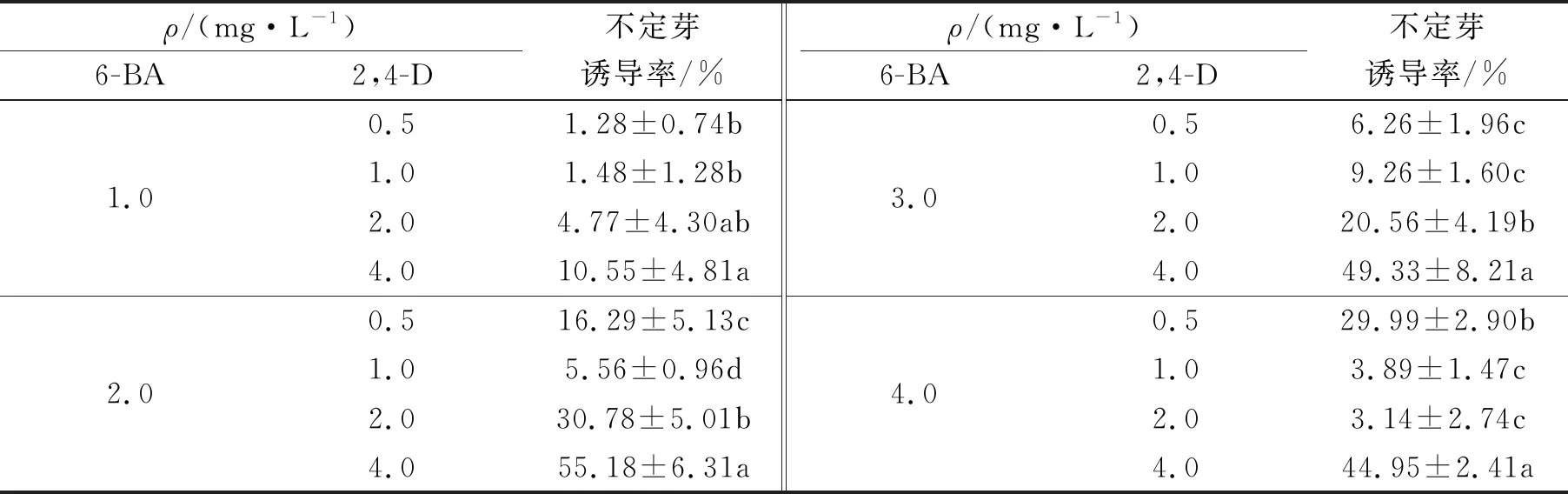
表4 不同质量浓度的6-BA与2,4-D组合对不定芽诱导的影响

表5 不同质量浓度的6-BA与NAA组合对不定芽诱导的影响
2.6 生根培养
将不定芽接种到1/2 MS+IAA(0.5、1.0、2.0)mg/L培养基中培养20 d,不定芽基部长出2~3条淡黄色不定根,根长3~5 cm.藏橐吾不定芽适宜生根培养基为1/2 MS+IAA 0.5 mg/L,生根率为70.00%(表6).

表6 不同质量浓度的IAA对不定根诱导的影响
2.7 炼苗及移栽
将锥形瓶封口膜打开,在无菌室内炼苗1周.选取叶片较大、叶柄粗壮、长势良好的再生苗,小心洗去根部的培养基,移栽至泥炭土、珍珠岩和沙的质量比为4∶3∶2的混合基质中,置于相对湿度为80%~90%、温度为20 ℃的环境中培养30 d,成活率为100%.
3 讨论
目前已有橐吾属不同植物组织培养方面的相关报道,并且植物种类不同,在诱导愈伤组织和不定芽的过程中对植物生长调节剂的需求各不相同.杜娟等[11]研究发现,蹄叶橐吾(Ligulariafischeri)叶片外植体诱导愈伤组织的适宜培养基为MS+6-BA 0.5~2.0 mg/L,培养3周后产生少量的愈伤组织.以蹄叶橐吾嫩茎为外植体进行愈伤组织诱导培养时,MS+6-BA 0.3 mg/L+2,4-D 1.5 mg/L是较适宜的培养基,MS+6-BA 0.6 mg/L+NAA 0.1 mg/L是其不定芽分化培养的适宜培养基[12].单花橐吾(Ligulariajamesii)愈伤组织诱导的适宜外植体是叶柄,适宜诱导培养基配方是MS+6-BA 3.0 mg/L+NAA 0.2 mg/L,MS+6-BA 1.5 mg/L+NAA 0.1 mg/L培养基可诱导出大量不定芽[13].
本研究发现,藏橐吾子叶外植体在含有TDZ(1.0~2.0 mg/L)和NAA1.0 mg/L的培养中,可诱导出绿色愈伤组织,并且诱导率在40%以上.MS培养基中添加2.0 mg/L的6-BA和0.5 mg/L NAA有利于愈伤组织产生不定芽,而MS+TDZ 3.0 mg/L+NAA 0.5 mg/L也可诱导愈伤组织分化不定芽,但诱导率不及6-BA和NAA组合.
在植物离体培养过程中,外植体经过诱导培养先产生愈伤组织,再由愈伤组织分化产生不定芽,这是一种常见的再生途径.此外,外植体还可不经过愈伤组织化而直接分化产生不定芽.在全缘橐吾(Ligulariamongolica)茎尖培养过程中,茎尖基部可以直接分化出不定芽,启动培养基为MS+6-BA 2.0 mg/L+NAA 0.2 mg/L,不定芽增殖的最适培养基为MS+6-BA 2.0 mg/L+IBA 0.5 mg/L[14].大头橐吾的无菌苗去除胚根后接种到MS+6-BA 1.0 mg/L培养基上,基部可直接形成丛生芽[15].
本研究发现,6-BA与2,4-D组合可以诱导子叶直接分化产生不定芽,当MS培养基中6-BA质量浓度为2.0 mg/L、2,4-D为4.0 mg/L时,子叶不定芽的诱导率最高(55.18%).6-BA与NAA组合也可诱导子叶直接分化出不定芽,当6-BA质量浓度为3.0 mg/L、 NAA为0.8 mg/L时,子叶不定芽分化率可达到72.33%.同6-BA与2,4-D组合相比,6-BA与NAA组合可诱导产生更多不定芽.
