[N(CH3)4]4[Mo10O18(OH)4(O2)10(O2)2]·6H2O的合成、晶体结构及表征
2021-02-26刘雪梅李慧敏丁丽芹郭珂欣李金环
刘雪梅,李慧敏,丁丽芹,郭珂欣,李金环
( 西安石油大学 化学化工学院,陕西 西安 710065)

含活性氧的过氧钼酸盐由钼酸盐与H2O2反应生成,通过控制pH、双氧水的用量、反应温度等反应条件,对钼原子的聚合方式、过氧基团的数目进行调变,从而形成不同结构的过氧钼酸盐阴离子.文献报道的过氧钼酸盐按照钼的核数分为单核、双核和多核(3核以上)过氧钼酸盐,主要以单核钼和双核钼过氧化物为主,最高钼核数为10核.过氧基团数目最少的为单过氧,其中以双过氧和四过氧钼酸盐较多.K4[Mo4O12(O2)2]·2H2O[17]、K6[Mo7O22(O2)2]·9H2O[18]、K4[Mo8O24(O2)2]·6H2O[19]为双过氧的多核钼酸盐,(NH4)4[Mo3O7(O2)4]·2H2O[20],K4[Mo3O7(O2)4]·2H2O[21]为四过氧三核钼酸盐,K8[Mo9O25(O2)6]·9H2O[18]和(NH4)8[Mo10O22(O2)12]·16H2O[22]分别是六过氧九核钼酸盐和十二过氧十核钼酸盐等.经典过氧O—O键长在0.14~0.15 nm内,超氧O—O键长比过氧短,文献[23]报道的超氧最短键长为0.127 nm[23],通过O—O键长和伸缩振动频率判断过氧基团和超氧基团.超氧化合物由于不稳定容易转变为过氧化合物而难以制备,迄今为止,见文献报道的超氧化合物主要为碱金属和第一过渡系金属(如Cr, Mn, Fe, Ni等)[24-27]形成的,而具有结构分析的金属钼形成的超氧化合物仅有2例报道,陈全亮课题组首次报道了2例含有超氧基团的七核钼酸盐K5[Mo7O22(O2)(OH)]Cl·6H2O和 K5[Mo7O22(O2)(O2)]·8H2O[23],其中前者含有一个超氧基团,后者为超氧和过氧基团混合型的钼酸盐,在溶液和固态中均不能稳定存在.
本研究以钼酸铵和四甲基氯化铵为原料,质量分数为30%的过氧化氢为氧化剂,通过改变过氧化氢的用量对过氧基团的数目及钼原子的聚合方式进行调控,成功制备了一种过氧与超氧基团混合型的十核钼酸盐,并初步探索了化合物的氧化性质.
1 实验部分
1.1 试剂与仪器
四甲基氯化铵(分析纯,上海市萨恩化学技术有限公司);质量分数30% 过氧化氢(分析纯,天津市大茂化学试剂厂);四水合钼酸铵(分析纯,天津市科密欧化学试剂有限公司).
仪器: Smart Apex Ⅱ CCD型 X线面探衍射仪(德国布鲁克公司);VarioEL Ⅲ型元素分析仪(德国艾乐曼公司);IRIS Advantage 全谱直读等离子体发射光谱仪(简称ICP)(美国赛默飞世尔科技公司);Nicolet- Avatar 370型傅里叶变换红外光谱仪(美国赛默尼高力公司);U-3310型紫外可见分光光度计(日本日立公司).
1.2 [N(CH3)4]4[Mo10O18(OH)4(O2)10(O2)2]·6H2O 的合成
称取0.618 g (0.5 mmol) (NH4)6Mo7O24溶于8 mL蒸馏水中,磁力搅拌下滴加0.907 g (8 mmol)质量分数30% 的H2O2,室温搅拌1 h后,溶液为黄色,将5 mL含有0.33 g(3 mmol)四甲基氯化铵的水溶液滴加到上述黄色溶液中,反应30 min后过滤,四五天后有橙黄色块状晶体析出,产率为63.2%.元素分析理论值(质量分数,%)为:Mo, 45.59; C, 9.13; N, 2.66; H, 3.07;实测值:Mo, 45.21; C, 9.13; N, 2.60; H,3.72.
1.3 氧化反应
在50 mL烧杯中加入10 mL 浓度为1.5 mol/L新鲜配制的NaI水溶液,磁力搅拌下,将0.5 mmol合成化合物加入NaI溶液中,立即生成大量的紫黑色沉淀I2,室温搅拌10 min后,真空泵抽滤、室温下晾干并称重.
1.4 晶体结构的测定
100(2) K下,在Smart Apex Ⅱ CCD 型X线单晶衍射仪上对晶体衍射数据进行收集,使用石墨单色化的波长为0.071 073 nm 的Mo-Kα线作为光源,以ω-2θ扫描方式对合成化合物的单晶衍射数据进行收集.化合物的初结构由直接法解出,非氢原子坐标采用最小二乘法进行精修,并对其进行各向异性热参数修正,所有氢原子通过理论加氢得到.全部计算均使用SHELX-97软件在计算机上完成[28],化合物的晶体结构图采用Diamond 3.0软件绘制.表1和表2分别列举了化合物的晶体数据及部分键长、键角.

表1 晶体数据表

表2 部分键长及键角
2 结果与讨论
2.1 合成
室温下,以四水合钼酸铵和四甲基氯化铵为原料,质量分数30% 的过氧化氢作为氧化剂,采用传统的水溶液合成法制得了一种含有过氧与超氧基团的十核钼酸四甲基铵盐.在合成中,pH、过氧化氢和四甲基氯化铵的用量是制备目标化合物晶体的关键.
1)过氧化氢是一种具有弱酸性的绿色无污染的氧化剂,过氧基团通过取代与钼原子配位的氧原子从而形成过氧化物,当过氧化氢与钼酸铵的物质的量之比小于10∶1时,得到黄色晶体,红外光谱表明是二过氧七核钼酸盐[11];当过氧化氢与钼酸铵物质的量之比在10∶1至16∶1时,得到目标化合物的橙黄色块状晶体;当两者之比大于16∶1,不能得到目标化合物,是由于过氧化氢呈弱酸性的原因,用量增大,溶液pH低于2.5.
2)[N(CH3)4]4+是一种大小合适的抗衡阳离子,对化合物的结晶起着重要的作用,四甲基氯化铵与钼酸铵的物质的量之比为6∶1时,容易析出用于X线单晶测试用的晶体;四甲基氯化铵用量过大会形成大量的晶状沉淀而得不到单晶.
3)目标化合物的形成在pH=2.5~3.0的弱酸性条件下,质量分数30%的过氧化氢和四甲基氯化铵水溶液均呈弱酸性,在反应过程中对溶液pH起调节作用,避免使用稀盐酸、硝酸等强酸.
2.2 [N(CH3)4]4[Mo10O18(OH)4(O2)10(O2)2]·6H2O的晶体结构
目标化合物属于单斜晶系,P21/c空间群,不对称单元由4个[N(CH3)4]+,1个含有超氧与过氧基团的十核钼酸阴离子[Mo10O18(OH)4(O2)10(O2)2]4-和6个结晶水分子构成.
图1显示了阴离子[Mo10O18(OH)4(O2)10(O2)2]4-的球棍图,由图1可知,阴离子是由2个桥氧O16将对称单元[Mo5O9(OH)2(O2)6]2-连接形成中心对称结构,阴离子中每个Mo原子均与7个氧原子配位形成五角双锥.

图1 阴离子[Mo10O18(OH)4(O2)12]4- 的球棍Fig.1 Ball-and-stick representation of [Mo10O18(OH)4(O2)12]4-
以对称单元[Mo5O9(OH)2(O2)6]2-为例进行结构分析.如图2a所示,对称单元是由5个Mo,1个超氧基团(O2)2-,5个过氧基团(O2)2-,4个桥氧(Ob),2个μ3-O和5个端氧(Od)构成.6个双氧基根据键长分为1个超氧基团和5个过氧基团,其中O21-O23键长为0.114 5 nm,为超氧基团,小于文献[23]报道值0.127 nm[23];O1-O17、O2-O19、O4-O20、O5-O12和O7-O10的键长分别为0.148 1, 0.144 7, 0.147 2, 0.145 3和0.143 5 nm,平均键长为0.145 8 nm, 属于经典的过氧基团,其键长比超氧键长大得多.5个Mo原子中Mo3与超氧基团(O21-O23)2-相连,Mo4连接2个过氧基团(O4-O20)2-和(O1-O17)2-,而Mo1、Mo2和Mo5均分别与一个过氧基团(O5-O12)2-、(O2-O19)2-和(O7-O10)2-相接,比较特殊的是过氧O1、O12和O17起桥连作用将Mo1、Mo2、Mo4和Mo5连接形成Mo2-O1-Mo4-O17-Mo1-O12-Mo5链(图3),Mo5-O12, Mo2-O1和Mo1-O17的键长分别为0.250 1、0.238 6、0.223 7 nm,比Mo-(O2)(peroxo)的键长(0.190 4~0.203 0 nm)大得多,表明起桥连作用的过氧与金属钼原子的相互作用较弱.Mo3-O21(superoxo)和Mo3-O23(superoxo)的键长分别为0.187 6和0.183 7 nm,Mo-(O2)(peroxo)的键长为0.190 4~0.203 0 nm(图3),金属Mo3原子与超氧的键长比Mo与过氧的键长短,表明与超氧原子的作用强于过氧原子.
对称单元的四个桥氧中的O8和O22与H形成质子化(图1),O-H键长分别为0.093 1 nm和0.092 9 nm,这是由于在弱酸性条件下合成的原因.μ3-O11、μ3-O18和过氧基团上氧原子O1、O17、O12的桥连作用使阴离子的结构变得复杂,图2b所示为聚阴离子对称单元的Mo5O10笼状结构(为了清晰删掉了Mo上的端氧和自由过氧基团),Mo与O连接形成不同大小、形状的环,最小的为MoO2三元环,最大的为Mo4O5九元环.
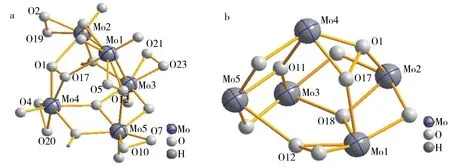
图2 聚阴离子对称单元的球棍图(a),对称单元的Mo5O10笼状结构(删掉过氧基团和端氧后)的球棍(b)Fig.2 Ball-and-stick representation of symmetric unit of the polyanion and Mo5O10( Peroxo groups and Od atoms are deleted for clarity)
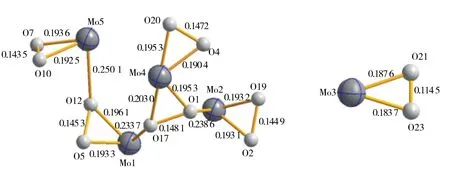
图3 O—O和Mo—O2键长的对比Fig.3 Comparisons of O—O and Mo—O2 bond distances in the title compound
图4显示了化合物[N(CH3)4]4[Mo10O18(OH)4(O2)10(O2)2] 在ac(左)和bc(右)平面的多面体堆积图,由图4可知,每个聚阴离子由8个MoO5(O2)十面体和2个MoO3(O2)2十面体通过共角共边相连形成,[N(CH3)4]+阳离子游离在阴离子[Mo10O18(OH)4(O2)10(O2)2]4-多面体的外围.

图4 [N(CH3)4]4[Mo10O18(OH)4(O2)12]在ac和bc平面的多面体堆积图(为了清晰,删掉了结晶水分子和C—H及O—H键)Fig.4 Packing diagram of [N(CH3)4]4[Mo10O18(OH)4(O2)12]in ac and bc plane (Water molecules and C—H, O—H bonds are deleted for clarity)
2.3 红外光谱
目标化合物红外光谱的重要吸收峰为2 000~400 cm-1,如图5所示.1 624(s) cm-1处的吸收峰是水中O—H的弯曲振动峰,1 418 cm-1处的吸收峰是N—H的弯曲振动峰,1 483 cm-1处的强尖峰及1 448、1 383 cm-1处的吸收峰归属于C—H的弯曲振动峰,1 286 cm-1处的弱吸收峰为C—N的弯曲振动峰.1 168和1 076 cm-1处的弱吸收峰是O(超氧)—O(超氧)的伸缩振动峰[23],964和948 cm-1处的肩峰为Mo=Od(端氧)的伸缩振动峰;881和854 cm-1处的吸收峰归属于过氧基团中O—O的伸缩振动峰,903、732和474 cm-1处的吸收峰分别为Mo—Ob(桥氧)—Mo的伸缩振动峰,685 cm-1处的吸收峰为Mo—Oc(桥氧)—Mo的伸缩振动峰,629、588、553和513 cm-1处的吸收峰为Mo—O2(过氧)的伸缩振动峰[23].
2.4 紫外光谱
图6为目标化合物的紫外光谱,如图6所示,在208 nm处出现的强吸收峰归属于Od→Mo键的pπ-dπ的电子转移,在290~375 nm内出现宽而较弱的吸收峰带为Ob,c→Mo键的pπ-dπ电子转移.

图5 红外光谱Fig.5 IR spectrum

图6 紫外光谱Fig.6 UV spectrum
2.5 目标化合物的氧化性
0.5 mmol目标化合物加入到10 mL浓度为1.5 mol/L NaI水溶液中,生成大量的深蓝色沉淀I2,真空泵抽滤、干燥称重计算收率为91.2%,这是由于少量的碘会溶于溶剂水中的原因.氧化实验结果说明目标化合物能迅速将I-氧化为碘单质,表明了目标化合物由于结构中过氧基团和超氧基团的存在而具有强的氧化性.
3 结论
以质量分数30%的过氧化氢为氧化剂,四水合钼酸铵和四甲基氯化铵为原料,室温下采用传统的水溶液法成功制备了一种含有超氧和过氧基团的十核钼酸盐晶体,通过X线单晶衍射对目标化合物的晶体结构进行了确定,通过元素分析、IR、UV光谱对其进行了表征,并对其氧化性质进行了初步探索.在产物的制备中,发现过氧化氢的用量、合适的pH及四甲基氯化铵的用量是合成目标化合物的关键条件.
1)过氧化氢与钼酸铵物质的量之比在10∶1至16∶1时,可以制得目标化合物的橙黄色块状晶体;而当两者之比小于10∶1时,得到七核钼二过氧酸盐的黄色晶体;两者之比大于16∶1时,溶液pH低于2.5,不能得到目标化合物.
2)钼酸盐的形成对pH非常敏感,目标化合物形成的合适pH为2.5~3.0,当pH小于2.5或大于3时,会形成其他结构的过氧钼酸盐.
3)四甲基氯化铵与钼酸铵的物质的量之比等于6∶1时容易制得目标化合物的单晶.
4)目标化合物能够氧化碘离子生成单质碘,表明了目标化合物具有强的氧化性能,是一种含有活性氧的固体氧化剂.
