浓缩生长因子对慢性牙周炎治疗效果的影响
2021-02-25许剑
许剑
慢性牙周炎的发生,与机体菌斑或其他微生物含量的增加密切相关;菌斑及其产物会破坏牙龈微生态环境,导致病菌滋生至整个牙龈甚至牙龈深部组织,造成局部牙槽骨缺损。基于此,为维持正常咀嚼功能,需采取骨引导再生术修复受损牙齿。为全面改善口腔健康状况,临床倾向于配合减轻局部炎性反应的修复治疗。研究指出,浓缩生长因子可对局部细胞增殖、血管生成起到一定的促进作用[1]。本研究观察浓缩生长因子对慢性牙周炎治疗效果的影响,报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2020年1月-2021年2月三明市第二医院接受浓缩生长因子治疗的慢性牙周炎患者62例的临床资料,根据治疗方案不同分为观察组和对照组,各31例。观察组男16例,女15例;年龄35~58(48.39±8.13)岁;单颗治疗24例,双颗治疗7例。对照组男17例,女14例;年龄37~58(48.25±8.20)岁;单颗治疗25例,双颗治疗6例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。患者及家属已知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)患者均经病理学检查证实其釉牙骨质界根方有牙周袋形成;(2)经X线检查显示其牙槽嵴顶存在骨质吸收且吸收长度>根长的1/2,伴随不同程度的牙周支持组织丧失或附着丧失。排除标准:(1)具有即刻种植修复或其他口腔手术史者;(2)高血压、糖尿病等基础性疾病患者。
1.3 方法
1.3.1 浓缩生长因子微粒制备:采集2组患者外周静脉血10~40 ml,3 000 r/min转速离心12 min,分离为血浆上层清液、纤维蛋白、红细胞及血小板3层。将浓缩生长因子凝胶分离,然后将凝胶与红细胞交界区域一并分离压缩,切割成1~2 mm微粒,按照1∶1比例与Bio-Oss骨粉[瑞士盖氏制药有限公司生产,国食药监械(进)字2008第3461464号,规格:0.5 g]混合备用。
1.3.2 手术方法:常规消毒,行术区局部麻醉,采用Widman翻瓣术充分暴露患者牙周骨缺损部位,将增生肉芽去除并平整根面,修整牙槽骨。修整后首先采用生理盐水冲洗术区,接着将Bio-Oss骨粉材料与患者自体血浆、注射用液体相混合,于牙槽骨缺损处植入混合液。在此基础上,对照组单行胶原膜覆盖,观察组则先采用制备好的微粒进行覆盖再行胶原膜覆盖。覆盖完成后对龈瓣进行缝合。
1.4 观察指标与方法 (1)于术后1周,使用成都恩普生医疗科技有限公司所生产的M201酶标分析仪(川械注准20162400078)以酶联免疫吸附法测定2组Wnt信号通路相关配体(Wnt3a)、骨保护素(OPG)、人核因子KB受体活化因子配体(RANKL)等边缘骨吸收标志物含量。(2)于术后1周,使用酶标分析仪对2组高迁移率族蛋白-1(HMGB1)、细胞间黏附分子-1(ICAM-1)、E-选择素(E-selectin)等炎性因子水平进行检测。(3)分别于2组术后3个月、6个月时,根据改良出血指数(mSBI)、改良菌斑指数(mPLI)评价标准对其牙周组织菌斑、出血情况进行评估[2]。mSBI:采用探针探查龈缘出血情况,根据出血程度及出血范围分别计0~3分,分数越高则出血情况越严重。mPLI:使用浓度为2%的碱性品红对受检牙齿进行染色后评估菌斑分布情况,按照牙龈各处菌斑分布程度分别计0~3分,分数与菌斑分布范围及严重程度呈正比。
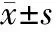
2 结 果
2.1 术后边缘骨吸收标志物含量比较 术后1周,观察组Wnt3a、OPG含量较对照组高,RANKL含量较对照组低,差异均有统计学意义(P<0.01)。见表1。
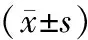
表1 2组患者术后边缘骨吸收标志物含量比较
2.2 术后炎性因子水平比较 术后1周,观察组HMGB1、ICAM-1、E-selectin水平均低于对照组,差异有统计学意义(P<0.01)。见表2。
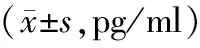
表2 2组患者术后炎性因子水平比较
2.3 牙周健康改善情况 观察组术后3、6个月的mSBI、mPLI评分均低于对照组,差异有统计学意义(P<0.01)。见表3。

表3 2组患者牙周健康改善情况比较分)
3 讨 论
慢性牙周炎长期发展不仅会导致患者牙齿逐渐移位、牙槽骨吸收程度增加,而且还会促使炎性组织不断扩散并在牙周袋壁内聚集进而形成脓性分泌物。相关手术虽能够修整牙龈并刮除不健康肉芽组织,但若想全面消除影响牙龈健康的危险因素,则需在手术治疗的同时结合一定的菌斑控制措施来重建牙周支持组织[3]。
本研究结果显示,术后1周,观察组Wnt3a、OPG含量较对照组高,RANKL含量较对照组低。提示浓缩生长因子可有效减轻慢性牙周炎患者局部炎性反应。HMGB1活性显著,该因子基因消除后仍可能导致局部细胞组织形态畸形;机体牙龈受损组织可对HMGB1产生一定的诱导作用,将其释放至细胞外部从而引发一系列炎性反应。ICAM-1能够强化白细胞、炎性细胞等与内皮细胞的粘附性,促使以上细胞穿透内皮并持续扩散。E-selectin广泛分布于内皮细胞、血小板等多种细胞表面。对以上炎性因子活性进行合理抑制,有助于改善牙周健康状况。浓缩生长因子可对淋巴细胞、单核巨噬细胞活性进行调节,并可通过增加抑炎因子表达来抑制炎性反应活性,减少炎性细胞对内皮细胞的黏附作用,在血管内皮生长因子作用下提高内皮细胞功能完整度,减轻局部炎性反应[4]。
结果可见,术后1周,观察组HMGB1、ICAM-1、E-selectin水平均低于对照组。此结果说明浓缩生长因子在改善慢性牙周炎患者牙龈健康状况方面的有效性。慢性牙周炎患者牙齿及周围组织均存在多处损伤,牙齿整体健康状况每况愈下;其齿龈下菌斑持续作用于周围正常牙周组织,导致局部微循环发生异常,表现为牙龈出血、局部发炎等症状[5]。引导骨再生术可诱导存在组织再生潜力的牙周膜细胞生长分化,促使局部受损牙骨质、牙槽骨再生。在此术式的修复基础上,浓缩生长因子可借助纤维网支架发挥强效促新生作用[6]。浓缩生长因子制备过程中,血小板α颗粒活性得以激活,其所释放出的血小板衍生生长因子、成纤维细胞生长因子均具有促细胞增殖、促血管新生的作用,可有效增加血管平滑肌细胞含量,并修复受损内皮细胞,对牙周组织的修复过程起到显著促进作用[7]。同时,浓缩生长因子可有效控制局部牙周炎性反应,从而提高牙齿抗炎能力,最大程度抑制齿龈内部菌斑生长、扩散,净化口腔内部环境,维持口腔微循环稳定性,从而改善牙周健康状况。
结果还显示,观察组术后3、6个月的mSBI、mPLI评分均低于对照组。此结果可印证浓缩生长因子在抑制慢性牙周炎患者牙槽骨吸收进程方面的作用。Wnt3a属于Wnt糖蛋白分泌信号通路家族的代表性信号蛋白,其可在局部骨质流失、骨密度降低等过程中发挥显著抑制作用[8-9]。OPG又称破骨细胞抑制因子,其可与RANKL相结合阻断破骨细胞的产生过程;RANKL过度表达可强化破骨细胞活性并诱发一系列骨质疾病[10]。浓缩生长因子富含CD34+等大量转化生长因子,此类生长因子不仅能够降低细胞结合特异性,还能够强化细胞间的黏附作用力,维持细胞间高亲和力的作用状态,促使血管内皮细胞与骨髓血管外基质达成合理黏附,从而有效增殖分化成骨细胞,最终使患者牙周组织再生,阻止破骨细胞对矿化骨质的分解吸收,减少炎性介质对牙周移植体或新生组织的影响,促使骨吸收与生长形成动态平衡[11-12]。
综上所述,浓缩生长因子对慢性牙周炎治疗效果具有积极影响,可减轻患者牙周局部炎性反应,抑制牙槽骨、牙骨质吸收,全面改善患者牙齿健康状况。
