新型聚合物Soluplus制备水飞蓟素固体分散体及体外评价
2021-02-25程佳慧刘喜纲
程佳慧,赵 强,张 领,刘喜纲
(河北省中药研究与开发重点实验室/承德医学院中药研究所,河北承德 067000)
水飞蓟素(silymarin, SM)是提取自菊科植物水飞蓟果实和种子的混合物,水飞蓟宾为主要的活性成分[1-2]。SM具有抗炎、抗氧化作用,对肝癌、乳腺癌和宫颈癌等也表现出抑制作用[3-4]。SM属于BCS II类药物,其较差的溶解性是生物利用度低的主要原因[5],为了解决这一问题,研究者将其制成纳米混悬剂[6]、环糊精包合物[7]、微丸[8]及固体分散体(solid dispersions, SD)[9-10]等。固体分散技术是一种简单有效的改善药物溶解度的方法,同时可作为中间体制成多种剂型。
目前报道水飞蓟素固体分散体(silymarin solid dispersion, SM-SD)常用的载体有F68、PVPk30[7]、PEG6000[11]等,聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)是一种两亲性非离子型聚合物,与不含疏水基团的亲水聚合物相比,Soluplus具有良好润湿性的同时还可形成胶束增加药物溶解度,口服后受胃肠道pH变化的影响较小,是制备固体分散体的新型载体[12]。本实验以Soluplus为载体制备SM-SD,优化其制备工艺,并进行物相表征,为SM剂型的研究提供参考。
1 仪器与试剂
SM原料药(上海士锋生物科技有限公司,批号:16051227);水飞蓟宾标准品(成都普菲德生物技术有限公司,批号:170503);Soluplus(巴斯夫股份公司);试剂均为分析纯。
AG-254电子分析天平(瑞士梅特勒-托利多公司);8453 UV-VIS分光光度计(HP-Agilent公司);NETZSCH STA 449F3热分析仪(德国耐驰公司);RC806溶出试验仪(天津市天大天发科技有限公司);Nicolet 6700红外光谱仪(美国Thermo Nicolet公司);气浴恒温振荡器HZQ-C(金坛市天竟实验仪器厂);SU8020扫描电镜(日本日立有限公司);D8-AdvanceX射线衍射仪(德国 Bruker公司)。
2 方法与结果
2.1 紫外分光光度法的建立
以甲醇为空白,采用UV-VIS分光光度计在200nm~400nm波长范围内分别对水飞蓟宾及Soluplus溶液进行扫描。结果显示,水飞蓟宾在288nm处有最大吸收,且Soluplus对其无影响,因而选择288nm作为检测波长。
2.2 样品的制备
固体分散体:溶剂法制备,分别按一定比例(1:1、1:3、1:5、1:7、1:9)精密称取SM原料药和Soluplus于圆底烧瓶中,加入适量的无水乙醇,超声使其完全溶解,50℃减压蒸发,干燥后研磨,保存备用。
物理混合物(Physical mixture,PM):采用等量递增法制备,按一定比例(1:7、1:9)精密称取SM原料药和Soluplus混合均匀,保存备用。
2.3 处方筛选
2.3.1 药物-载体比例的筛选 分别按照一定的药物与载体比例(1:1、1:3、1:5、1:7、1:9),按“2.2”项下方法制备固体分散体。按照《中国药典》(2015年版四部)中溶出度测定,选用桨法,以0.1%SDS水溶液900mL为介质,转速100r/min,温度37℃±0.5℃,精密称取SM原料药和SM-SD(相当于SM 15mg)进行实验,于不同时间点取样进行测定,计算溶出度,绘制累积溶出曲线,见图1:
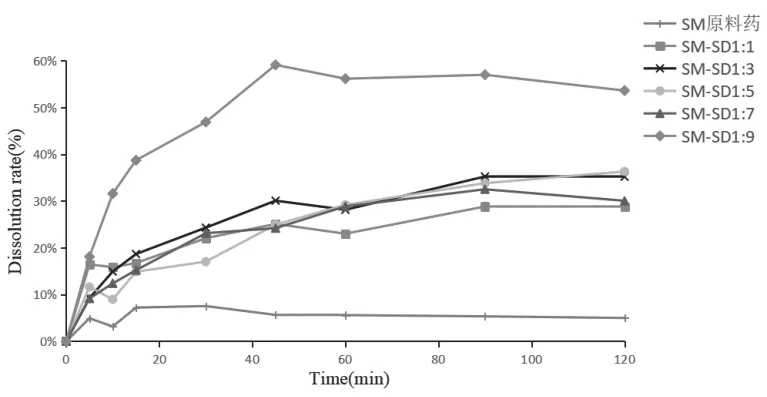
图1 不同药载比SM-SD的累积溶出曲线
结果显示,SM原料药120min时的溶出度不到10%,不同药载比的SM-SD中SM溶出度均有不同程度的提高,其中药载比为1:9的SM-SD在45min时累积溶出度可达59.14%。
2.3.2 水飞蓟素含量及溶解度的测定 精密称取SM原料药及不同药载比的SM-SD制备供试品溶液,测定其含量。将过量上述样品分别加入5 mL蒸馏水中使其成过饱和,于气浴恒温振荡器中(25℃)振摇24h后,取上清液过滤,测定SM的溶解度,结果见表1:
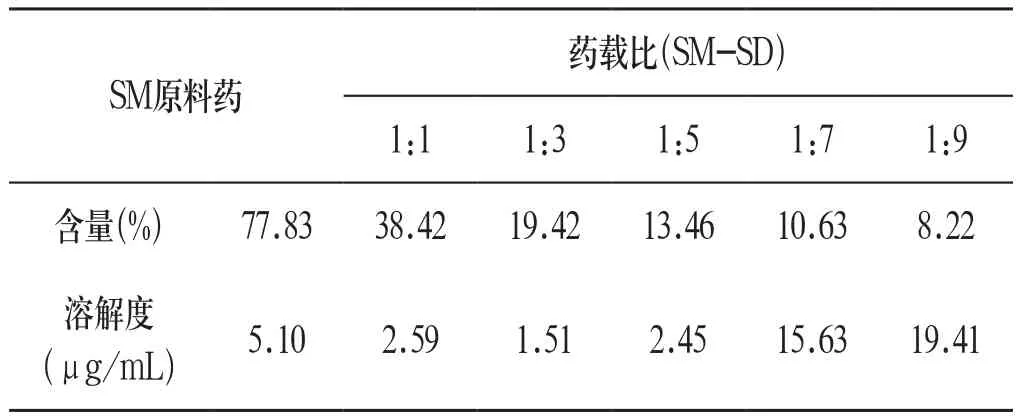
表1 SM含量及溶解度测定结果
由表可知,SM-SD的药载比为1:1、1:3和1:5时,SM的溶解度略有降低,而药载比为1:7、1:9的SM-SD溶解度分别为SM原料药的3.06倍和3.80倍。综合溶出度、含量及溶解度的测定结果,药载比为1:9时效果最优,其次是1:7,因此选择药载比为1:7与1:9的SM-SD进行物相表征。
2.4 物相表征
2.4.1 扫描电子显微镜(SEM) 取SM原料药、Soluplus、SM-SD(1:7、1:9)及SM-PM(1:7、1:9)适量,测试条件为:电流10 mA,加速电压5.0kV。观察表面外观形貌,记录图像,结果见图2:

图2 样品SEM图
结果显示,SM原料药呈粉末颗粒状,表面粗糙,较为疏松;Soluplus呈颗粒圆球状,表面光滑,较为紧密。药载比为1:7、1:9的SM-PM中可见SM与Soluplus的特征,说明只是SM和载体的简单混合,两者之间并未发生相互作用。SM-SD的表观形态与SM-PM完全不同,SM及载体本身的特征完全消失,表现为致密的不规则团块状。
2.4.2 差示扫描量热(DSC) 分别取SM原料药、Soluplus、SM-SD(1:7、1:9)及SM-PM(1:7、1:9)适量均匀放入铝盘内,测试条件:升温速度为10K/min,扫描范围为30~500℃,样品气氛为氮气,进行分析,结果见图3:
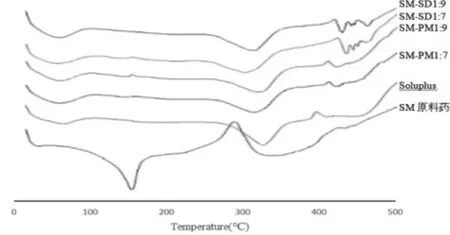
图3 DSC图
由图可知,SM原料药和Soluplus的特征熔点峰分别出现在160℃和322℃左右,且载体的熔点峰较钝;PM中仅Soluplus的熔点峰清晰可见,可能是因为原料药的比例较小,SM峰强度较弱而未显现;SM-SD中SM的熔点峰消失,但保留了Soluplus的熔点峰且产生了不同于SM及载体的吸热峰,表明SM的晶型可能发生了改变或以无定形形式分散于载体中。
2.4.3 傅里叶变换红外光谱(FT-IR) 分别取SM原料药、Soluplus、SM-SD(1:7、1:9)及SM-PM(1:7、1:9)与适量KBr研磨、混合均匀后压片,扫描范围:400cm-1~4000cm-1,结果见图4:
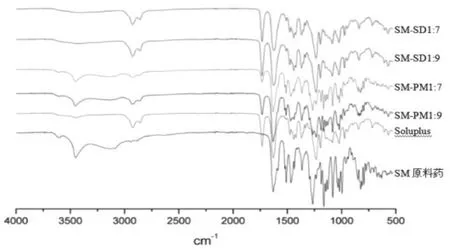
图4 FT-IR图
由图可知,SM原料药在3441 cm-1、1642cm-1处有较强的C=O峰和OH峰;Soluplus在2900cm-1附近有两个明显的特征峰可区别于SM原料药;SM-PM中并未出现新的吸收峰,SM和载体Soluplus的特征峰清晰可见,表明PM是两者的简单混合,SM峰强度可能因载体比例较大而减弱;SM-SD中SM的C=O特征吸收峰消失,载体Soluplus的特征峰保留,未出现其他特征峰,表明SM-SD中SM与Soluplus之间可能存在相互作用。
2.4.4 X-射线衍射(XRD) 分别取SM原料药、Soluplus、SM-SD(1:7、1:9)及SM-PM(1:7、1:9)适量进行分析,测试条件:波长(Cu靶)1.5406 nm,40mA,40kV,在3~60°范围进行扫描,见图5:

图5 XRD图谱
由图可见,SM原料药在13.75°,14.67°,16.17°,17.33°,17.51°,19.77°,20.77°,22.42°,24.49°,24.60°处均存在尖锐的衍射峰,表明SM以晶体形式存在;Soluplus无明显衍射峰,表明其以无定形状态存在;PM中可见强度减弱的原料药衍射峰,表明仅是二者的简单混合,而SM-SD图谱和Soluplus类似,药物晶体衍射峰消失,表明SM可能以无定形的形式存在于载体中。
3 讨论
水飞蓟素为难溶性药物,可通过固体分散技术来改善这一问题。Soluplus是以聚乙二醇骨架为亲水部分、乙烯基己内酰胺/醋酸乙烯侧链为亲脂部分的接枝共聚物。亲水性骨架为难溶性药物提供了空间阻碍,防止了溶解过程中局部过饱和现象的发生,减少了药物的再结晶,亲脂部分保证了良好的润湿性。研究表明Soluplus作为固体分散体载体,可通过在胃肠道中溶解形成胶束包裹难溶性药物和抑制P-糖蛋白的外排作用增强其在大鼠空肠段的渗透性及Caco-2细胞的单层转运等多种途径促进药物吸收,改善生物利用度,同时还可减少单核吞噬细胞系统的摄取,延长半衰期[13-14]。因此,选用Soluplus为载体制备固体分散体,为加快SM的溶出度并提高生物利用度提供了可能。
药物以无定形的形式存在,具有结晶的趋势,而水的存在会降低固体分散体系的玻璃化转变温度,加快药物结晶。在高湿度下,物相表征及计算机模拟相互作用等表明,Soluplus与药物之间存在较强的相互作用,且其低吸湿性避免了水分诱导的结晶生成,具有较高的溶解速率和稳定性,因此,Soluplus的使用在一定程度上可抑制高湿度引起的药物结晶[15]。针对SM-SD稳定性这一问题,分别在高温(60℃±2℃)、高湿(25℃、RH90%±5%)、强光(25℃、4500Lx±500Lx)条件下进行了稳定性考察,结果表明,固体分散体样品质量、含量及溶出百分率均略有下降。因此,贮存环境建议避光、干燥、低温。
综上可知,以Soluplus为载体制备的SM-SD可提高SM溶出度,并有可能提高其生物利用度,为水飞蓟素的临床应用提供了参考。
