内镜黏膜下剥离术治疗消化道早癌术后出血的风险模型构建
2021-02-25阿里木江阿不都热合曼马秀英朱勇荷
吴 江,吴 涛,庞 澜,阿里木江·阿不都热合曼,马秀英,陈 鹏,朱勇荷
0 引 言
近年来随着生活方式及饮食习惯的改变,消化道肿瘤发病率虽然呈不同的变化,但总体趋于年轻化。食管癌[1]、胃癌[2-3]总体发病率较平稳且呈下降趋势,结直肠癌[4]发病率明显增高。2018年研究结果显示,消化道肿瘤占新增恶性肿瘤病例超过25%,超过死亡病例30%[5]。早发现、早治疗是改善消化道肿瘤患者预后的关键。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)可整块切除病灶,具有创伤小、并发症少、术后恢复快等优点,已成为消化道肿瘤及癌前病变治疗的一线方法[6-8]。由于ESD切除黏膜范围广、创面大,导致操作时间延长;即使术中进行有效止血,术后仍易发生穿孔[9]或出血[10],影响患者康复、降低生活质量。尤其对于出血,需急诊内镜处理,甚至行外科手术止血。通过构建风险模型有助于将患者危险分层,早期筛选出高危人群,进而提前干预,对改善患者预后意义重大。既往研究多探讨延迟出血的危险因素,预测模型的相关研究较欠缺。本研究为探讨消化道早癌/癌前病变患者应用ESD治疗后术后出血的危险因素,并进一步构建预测模型,以期为ESD术后出血的预测提供参考。
1 资料与方法
1.1 研究对象回顾性分析2013年5月-2020年3月我院内镜中心诊治消化道早癌患者560例。其中,男390例、女170例,平均年龄(63.25±9.67)岁;病变位于食管138例、胃320例、结肠67例、直肠35例。纳入标准:①胃肠镜活检组织病理证实为消化道早癌或癌前病变[11];②病变局限于黏膜层或黏膜下层,无淋巴结及远处转移;③均行ESD治疗;④年龄≥45岁。排除标准:①合并其他肿瘤;②有ESD治疗禁忌证或中途转外科手术;③凝血功能异常或近期服用抗凝血、抗血小板药物者;④合并感染者;⑤心、肝、肾功能严重低下者;⑥临床资料不完整者。
1.2方法
1.2.1ESD方法ESD治疗均由同一内镜医师团队完成。仪器为日本Olympus公司EU-MEI电子内镜系统,GIF-Q260J胃镜、260AI型肠镜。首先确定病变范围,在外缘进行标记。采用黏膜下多点注射,DUAL刀或IT刀沿病灶外缘缓慢将黏膜层和肌层组织分离,完整剥离黏膜及黏膜下层;术中断离血管前应先电凝,对出血点电凝止血。若出血点较大,可采用活检钳或金属钳夹闭止血。病变及黏膜完整切除后,对创面显露血管再次电凝止血。切除组织经甲醛固定后送病理科[12]。
1.2.2术后出血定义术中或手术结束时未出血,术后28 d内出血:①出现血便、黑便或呕血;②血清检测示血红蛋白降低>20 g/L;③术后输血或需内镜/外科手术止血。①~③满足任意一项即为术后出血[13]。
1.3资料收集通过电子病历系统记录患者临床资料。①年龄、性别、吸烟饮酒、既往病史等;②肿瘤部位、病灶直径、浸润深度、病理分级、多发病灶等;③既往服药药物史,如阿司匹林、二甲双胍等。本研究规定有药物服用史为按药品说明书或遵医嘱连续服药3个月以上。
1.4统计学分析应用SPSS 25.0软件进行分析。计数资料以n(%)形式表示,组间比较采用χ2检验。多因素logistic回归分析术后出血的危险因素,并构建预测模型。采用ROC曲线对预测模型的价值进行验证。以P≤0.05为差异有统计学意义。
2 结 果
2.1 术后出血结果术后28 d,本组560例消化道早癌患者中发生术后出血25例(4.46%),出血时间为术后1~16 d。其中21例(84%)发生在术后7 d内。10例术后出血者应用药物止血,15例行急诊内镜止血。
2.2一般资料比较术后出血者BMI>24 kg/m2比率高于对照组(P<0.05);而不同出血情况患者年龄、性别、吸烟史、饮酒史等差异无统计学意义(P>0.05)。见表1。
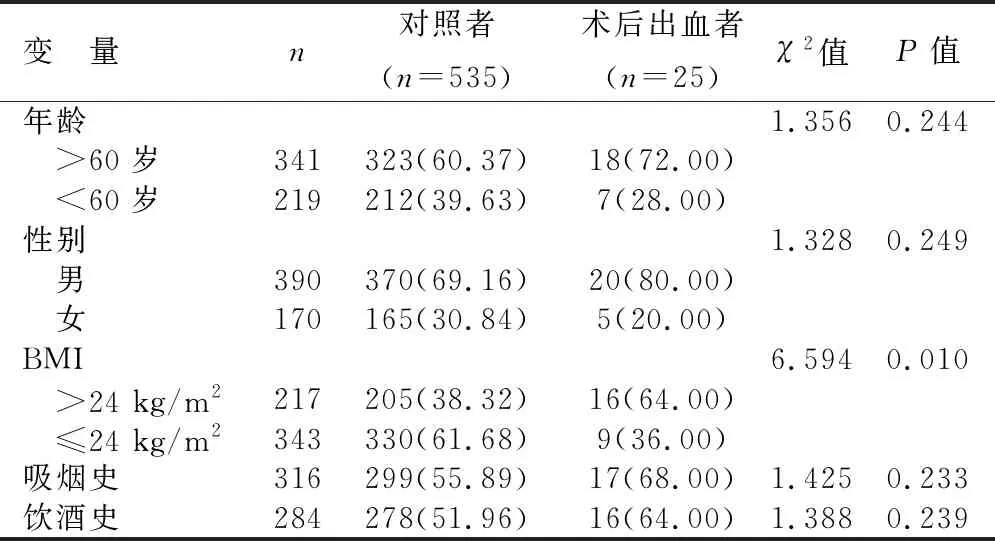
表 1 入组消化道早癌患者一般资料比较[n(%)]
2.3手术操作时间、既往基础疾病及服药史比较术后出血者操作时间>90 min、有高血压、有氯吡格雷服用史比率均高于对照者,差异有统计学意义(P<0.05)。见表2。
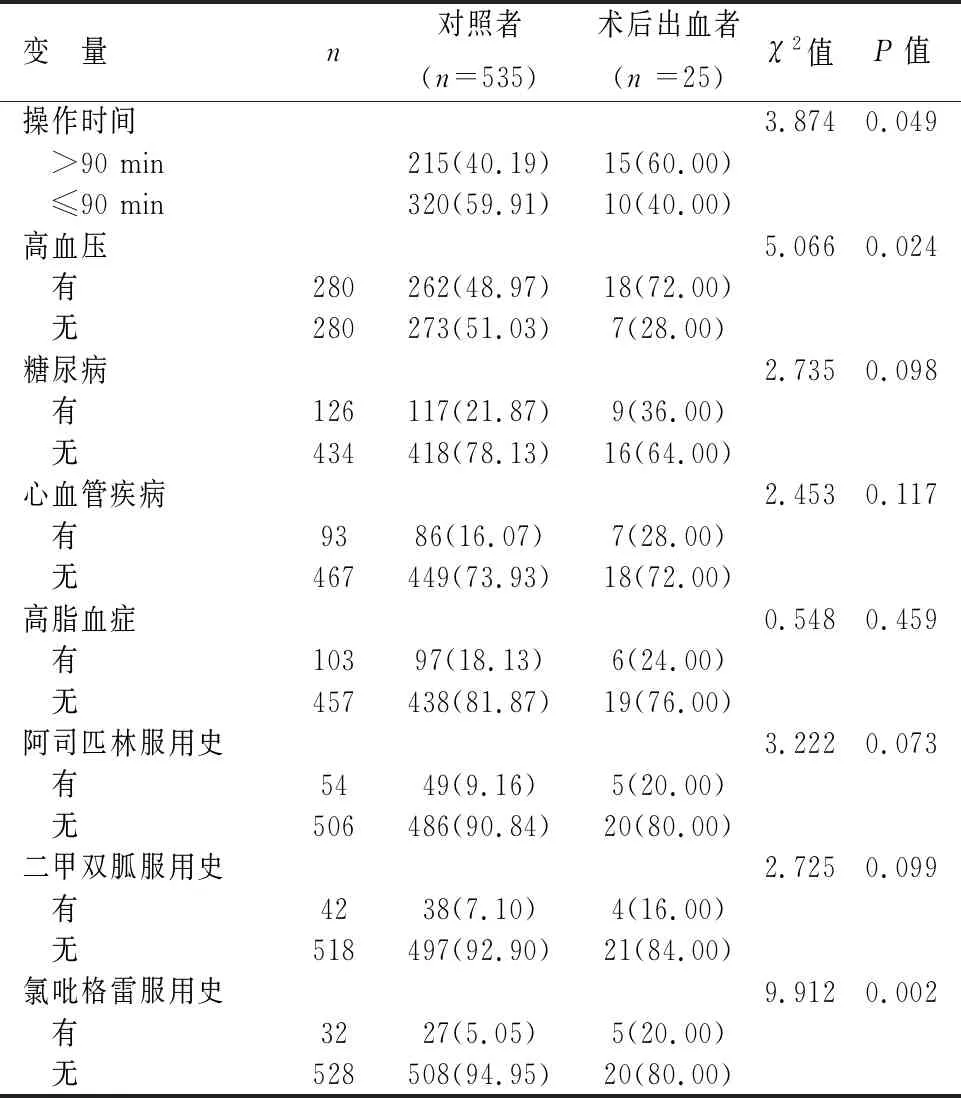
表 2 入组消化道早癌患者手术操作时间、既往基础疾病及服药史比较[n(%)]
2.4病理特征比较术后出血组病变部位为直肠、最大病灶直径≥3 cm、合并溃疡比率高于对照组(P<0.05)。见表3。
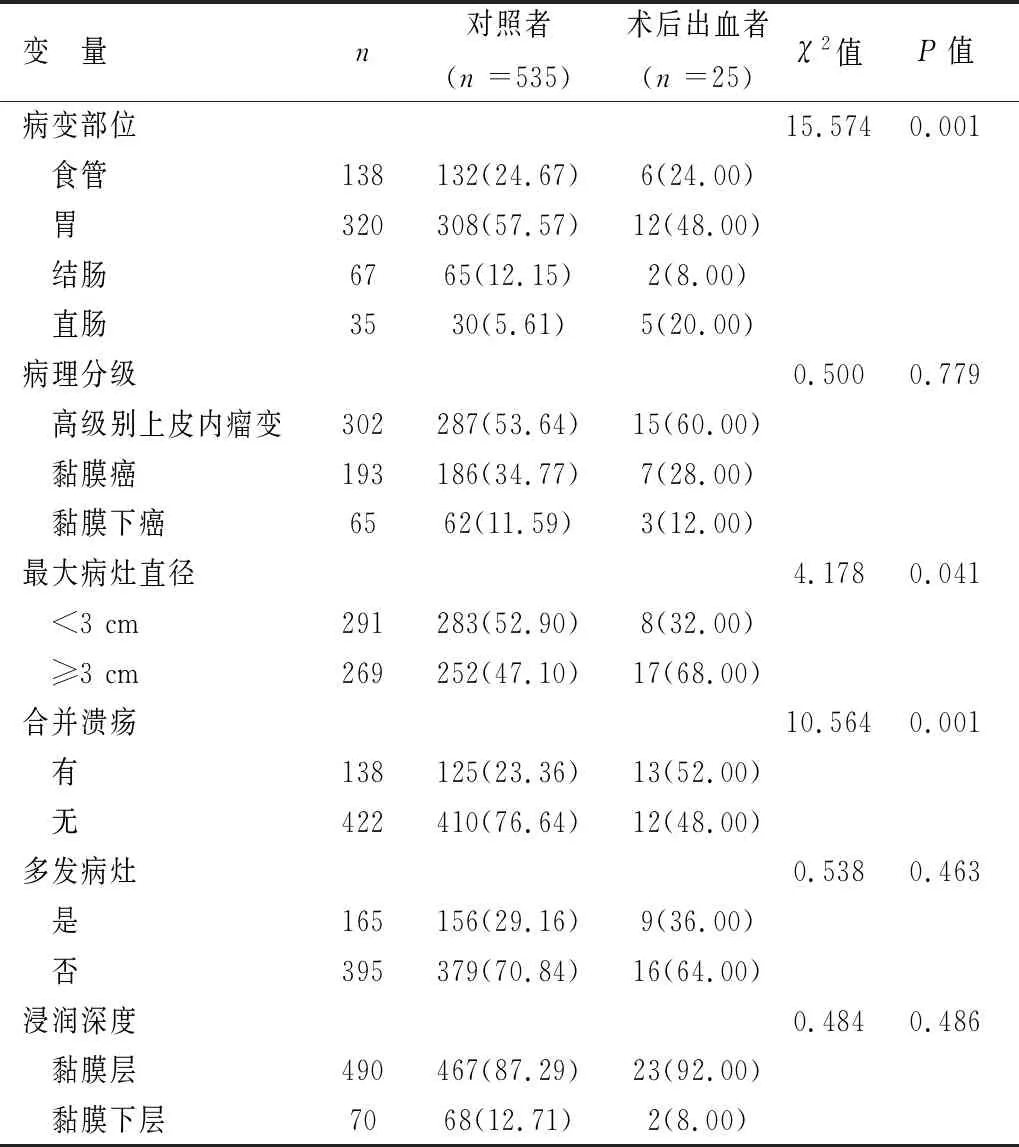
表 3 入组消化道早癌患者病理特征比较[n(%)]
2.5ESD术后出血危险因素的多因素logistic回归分析以单因素分析P<0.1的指标为自变量,是否术后出血为因变量纳入模型进行多因素logistic回归分析。结果显示:有高血压、操作时间>90 min、最大病灶直径≥3 cm、病灶位于直肠为消化道早癌患者ESD术后出血的危险因素。见表4。
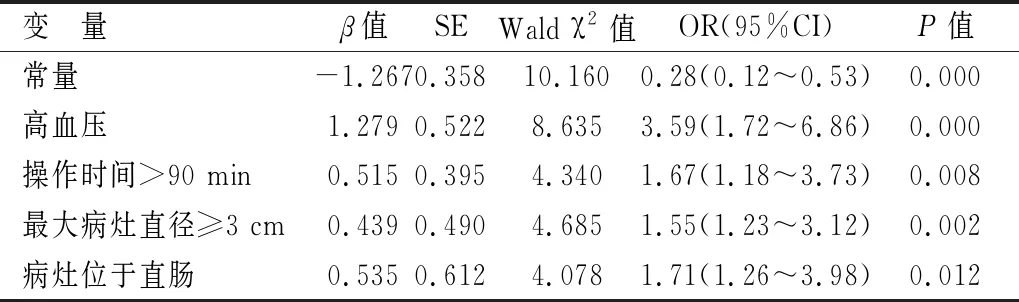
表 4 ESD术后出血危险因素的多因素logistic回归分析结果
2.6预测模型构建以术后28 d是否出血为因变量,高血压、操作时间、最大病灶直径、病灶部位为自变量建立回归方程:logit(P)=-1.267+1.279(高血压)+0.515(操作时间)+0.439(最大病灶直径)+0.535(病灶部位),由于自变量均为分类变量,分别赋值0或1。使用Predict Pre1命令将回归方程拟合为一个新变量Predicting,即Predicting=-1.267+1.279(高血压)+0.515(操作时间)+0.439(最大病灶直径)+0.535(病灶部位)。ROC曲线分析显示,预测消化道早癌/癌前病变患者ESD术后出血的AUC为0.865(95%CI:0.849~0.976,P=0.000),准确率82.32%、敏感度84.00%、特异度82.24%、临界值0.545。见图1。
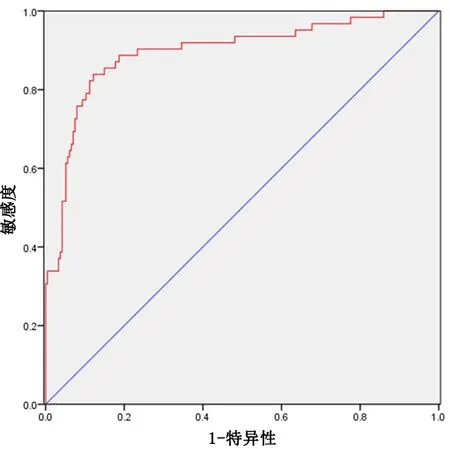
图 1 回归方程预测ESD术后出血的ROC曲线
3 讨 论
ESD属于微创技术,可完整切除黏膜及黏膜下层病变,患者术后恢复快。唐小鹤等[14]对42例早期胃癌行ESD治疗,中位随访41个月无复发病例。Matsui等[15]报道显示,ESD治疗消化道早癌病灶完整切除率高,术后5年存活率高于90%。由于黏膜菲薄,部分肿瘤部位较深,ESD易引起出血和穿孔,即使术中进行充分止血,术后出血仍不可避免[16]。7%~38%消化道早癌患者ESD治疗后发生出血,其中多数为术中出血,术后出血发生率相对较低,为1.8%~18.03%[17-18]。不同研究术后出血率差异较大,可能原因与纳入的患者肿瘤类型不同或医者对内镜操作熟练程度有关。一个纳入62项研究的Meta分析结果表明,行ESD治疗的早期胃癌患者术后出血率为5.1%[19]。本研究对560例消化道早癌患者回顾性分析表明,术后出血25例,发生率为4.46%,与蓝燕芬等[20]、刘思等[21]报道结果相近。ESD术后出血易被忽视,情况紧急者可能需外科手术止血,不仅增加医疗费用,且延长住院时间,影响患者恢复。分析ESD术后出血的影响因素,有助于识别高危患者,提前预防。
3.1高血压本研究结果显示,合并高血压是消化道早癌患者ESD术后出血的危险因素。高血压可引起血管损伤,长期高血压直接损伤血管内皮细胞,导致血管硬化,血管壁弹性减弱、脆性增加,收缩不良。血压升高可延长操作时间,不仅增加术中出血,且影响止血效果。另一方面,术后禁饮、禁食,手术损伤等导致的应激反应,进一步升高血压,导致术后出血。邹健等[22]对784例肠息肉患者行ESD治疗,结果显示合并高血压者术后出血风险是血压正常者的1.79倍。国外研究显示,ESD术后出血者合并高血压比率(87.5%)显著高于未出血者(38.8%),多因素logistic回归分析合并高血压是ESD治疗术后出血的危险因素(OR=11.55, 95%CI:1.20~111.66,P=0.034),与本研究结果一致[23]。
3.2操作时间本研究多因素logistic回归分析显示,操作时间>90 min者ESD术后出血风险是操作时间≤90 min者的1.67倍,与既往报道一致[24-25]。操作时间延长的原因较多,如病灶部位、多发病灶、病灶直径较大等,增加手术难度,导致术后出血风险增大;操作时间延长使创面血流减少、形成溃疡,导致术后出血[20]。另外,操作时间延长可增加术中出血,而术中出血处理不当可增加术后出血风险[26]。因此,术前应充分评估病情,减少操作时间。
3.3最大病灶直径病灶直径直接影响ESD术中操作,其直径较大增加黏膜层的剥离难度,导致损伤大、出血多。病灶直径较大者血流相对丰富,血管分布多,是术后出血的危险因素[22]。李艳霞等[27]对281例早期食管癌患者回顾性分析,结果显示病灶直径>3 cm者ESD术后出血风险是病灶直径≤3 cm者的4.81倍。刘建强等[28]研究发现,病变≥5 cm是老年胃黏膜病变患者ESD术后出血的独立危险因素,本研究结果与上述报道一致。因此对于病灶直径较大者,术中应充分止血,如必要延长血管夹闭时间,尤其是注意对隐匿性血管的处理。
3.4直肠病变病变部位与ESD术后出血关系密切。孙运军等[18]对61例早期胃癌患者研究显示,ESD术后出血组病变部位为贲门-胃底比率高于未出血组。有研究认为病变部位胃中上1/3者ESD术后出血风险增加[29]。一项大样本量回顾性分析表明,病变部位与术后出血无明显相关[30]。本研究多因素logistic回归分析结果显示,病灶位于直肠是消化道早癌患者ESD术后出血的独立危险因素,与Lai等[31]报道相符。可能是由于直肠血管丛较多,低位直肠的血供不仅来自于肛周动脉,也来源于直肠下动脉,多血管易损伤,此特点决定直肠病变患者术后易出血;此外,患者术后排便可导致肠壁过度挤压、收缩,引起损伤的血管出血[32]。
3.5风险模型构建适宜、实用、预测价值高的风险模型有助于对患者进行危险分层,早期识别术后出血高危患者,进而提前干预。刘晓燕等[33]对171例早期胃癌患者进行回顾性分析,通过logistic回归筛选了高血脂、抗菌药物使用情况、入住ICU、吞咽障碍、浸润深度、口腔护理及留置胃管7个独立危险因素,进而构建预测模型,结果显示该模型能有效预测早期胃癌患者ESD术后并发肺炎,C-index指数为0.937。杜耀等[34]对行远端胃癌根治术的患者术后发生胃瘫综合征构建预测模型,结果显示该模型预测的敏感性为71.4%,特异性为88.3%。秦娟等[35]筛选肿瘤部位、术前放化疗史构建风险模型预测食管癌患者125I粒子支架置入术后出血发生的AUC为0.686。目前,关于消化道早癌患者ESD术后出血的风险预测模型研究的较少。Seo等[36]对1189例结直肠癌患者的研究中,筛选了肿瘤位置、肿瘤直径以及抗血小板药使用情况3个变量,进而建立结直肠癌患者ESD术后延迟出血的预测模型。但该研究入选的仅为结直肠癌患者。本研究结果显示,根据多因素logistic回归方程成功构建预测模型,经ROC曲线检验,该模型预测ESD术后出血的AUC为0.865,准确率82.32%,敏感度84.00%,特异度为82.24%,临界值为0.545,提示该模型预测价值较高。根据临界值,进一步可对临床个体术后出血风险进行预测,有助于指导临床工作。
本研究局限性:①样本量较小,可能存在混杂因素;②未对模型进行内部验证;③仅应用ROC曲线分析结果对模型进行评价;④可能存在其他的影响因素未纳入模型。下一步可考虑纳入更多的变量进行多中心、大样本量研究,并采用Bootstrap等多种方法对模型进行内部验证和外部验证。
综上所述,消化道早癌患者ESD术后出血与高血压、操作时间、病灶直径及病灶部位有关,预测模型可有效预测个体ESD术后出血风险。对出血高风险个体,应提前干预,以降低术后出血风险。高血压患者进行严格的血压控制,病灶直径较大者充分电凝止血、并采用荷包缝合法,多发病灶导致的操作时间长、直肠病变者可适当喷洒肾上腺素、纤维蛋白胶、放置金属钛夹等,以降低术后出血风险。