次黄嘌呤联合氧嗪酸钾构建高尿酸血症小鼠模型探讨*
2021-02-25何曦萌徐黎青朱春霖潘小红吴丽辉孙军刚
何曦萌 徐黎青 朱春霖 潘小红 何 梅 吴丽辉 孙军刚
1 成都中医药大学,四川省成都市 610000; 2 四川省中西医结合医院
高尿酸血症(Hyperuricemia,HUA)是嘌呤代谢异常引起的代谢性疾病。多项研究表明,高尿酸血症不仅是痛风的重要生化基础,也与肥胖[1]、糖代谢异常[2-3]、高血压[4]和慢性肾脏病[5]关系密切。合适的动物模型是进一步探究其发病机制与药物研发的基础,但目前高尿酸血症模型造模方法众多、剂量各异,对实际造模操作有一定影响。文献调研表明,高尿酸血症小鼠模型多采用腹腔注射氧嗪酸钾[6-10]的给药方式构建,但注射造模存在首过效应,血清尿酸水平升高持久性较差,且长期腹腔注射很容易造成腹腔积水、腹膜硬化等不良反应,不适于慢性高尿酸血症模型的建立,同时因氧嗪酸钾不溶于水,造模时常用羧甲基纤维素钠水溶液配置成混悬剂,一般认为混悬剂不适合注射给药。而灌胃法相对刺激轻微,可以避免这些弊端,常用于制作长期模型。因此本实验结合啮齿类动物存在尿酸酶代谢系统的特点,采用灌胃的给药方式,给予雄性KM小鼠不同剂量的次黄嘌呤(Hypoxanthine,HX)与氧嗪酸钾(Potassium Oxoxazine,PO),通过小鼠造模前后空腹体重变化及血清尿酸(Serum uric acid,SUA)评价构建动物模型的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物: SPF级KM雄性小鼠50只,1月龄,体重25~30g,由四川省中医药科学院动物中心提供[SCXK (川) 2018-19],饲养在四川省中医药科学院实验动物中心[SYXK (川)2018-100]。动物饲养室内以12h昼夜循环照明,温度维持在(22±2)℃,湿度(50±10)%,自由饮水和采食。整个实验过程中对动物的各种处置均符合中华人民共和国科技部颁布的《关于善待实验动物的指导性意见》。
1.1.2 试剂与仪器: 氧嗪酸钾(Potassium Oxonate,PO,美国Sigma公司,批号SLBT3093);次黄嘌呤(Hypoxanthine,HX,美国Sigma公司,批号SLBZ9513);羧甲基纤维素钠(Sodium carboxymethyl cellulose,成都市科龙化工试剂厂,批号030612);尿酸由四川省中西医结合医院检验科进行检测(全自动生化分析仪,西门子ADVIA2400;INS:罗氏电发光分析仪,COBAS602)。
1.2 方法
1.2.1 动物分组与造模: 适应性喂养1周后,小鼠禁食12~14h,饮水自由,次日测量空腹体重,乙醚麻醉后内眦采血,检测SUA基础数据。按空腹体质量将小鼠随机分为空白组和4个模型组(A、B、C、D),每组10只。次黄嘌呤与氧嗪酸钾用0.5%的羧甲基纤维素钠溶液配制成混悬液,每组予不同剂量灌胃。见表1。模型A、B、C组均先灌胃给予次黄嘌呤,2h后再灌胃给予氧嗪酸钾,模型D组灌胃给予氧嗪酸钾,空白组灌胃等体积蒸馏水,持续7d。造模期间,各组小鼠自由饮水,喂饲相同质量的饲料。
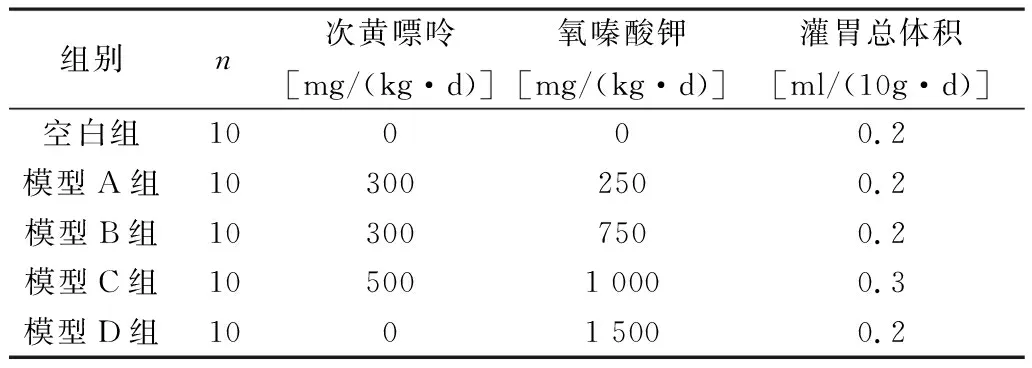
表1 各组小鼠灌胃剂量
1.2.2 检测指标:每天观察小鼠的一般情况,对比造模前后小鼠空腹体重和SUA变化。第6日灌胃后予禁食14h,第7日测定空腹体重,于末次造模后2h内眦取血,室温静置1~2h后2 000r/min离心15min,取血清送检。
2 结果
2.1 小鼠一般情况 随着造模时间的延长,模型C组出现体毛干枯无光泽、精神萎靡、饮食及活动减少等,其余组小鼠毛色正常、精神状态良好,整个实验过程,各组小鼠未出现死亡。
2.2 小鼠空腹体重变化 造模开始时各小组体质量均无显著差异,实验期间,各组小鼠体重呈逐渐增长的趋势,造模7d后,模型C组与空白组小鼠比较,其体重增长缓慢,差异有显著性(P<0.05)。其余模型组与空白组比较,体重差异无显著性,与模型C组比较,体重增长较快,差异有显著性(P<0.05)。见表2。
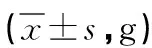
表2 各组小鼠体重比较
2.3 小鼠血清尿酸变化 造模前各小组基础尿酸值均无显著差异,造模7d后,只有模型C组与空白组比较SUA水平升高,差异有显著性(P<0.001),提示造模成功。模型B、D组造模后SUA升高,但与空白组比较无显著性差异。模型A组造模后SUA水平反而降低,与空白组比较差异无显著性。模型C组SUA水平均高于其余模型组,差异具有显著性(P<0.001)。见表3。
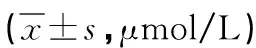
表3 各组小鼠血清尿酸比较
3 讨论
高尿酸血症在我国的发病率日趋升高,因此建立合适的HUA模型以便开展研究成了热点。啮齿类动物是目前构建高尿酸血症采用最广泛的实验动物,但是其体内存在尿酸酶,可将尿酸分解为尿囊素,然后被排出体外,造高尿酸血症模型困难。刘晓燕等[10]研究表明,选择高尿酸血症在体模型时,昆明种小鼠灵敏度高于ICR小鼠以及近交系的C57BL/6J小鼠。金沈锐等[11]报道,雌雄小鼠及同性动物间SUA值差异较大,雌性小鼠个体间SUA值波动较大,建议选用雄性小鼠。
HUA模型的造模方法多样,根据HUA的发病机制主要有直接补充尿酸合成前体物质(腺嘌呤、次黄嘌呤等)或者外源性尿酸,给予尿酸酶抑制剂(氧嗪酸钾)或抑制肾脏对尿酸的排泄(乙胺丁醇)等药物,以及敲除尿酸酶Uox和转运体ABCG2基因[12]。其中采用腺嘌呤造模,小鼠肾功能损害明显[13-14],更适用于高尿酸血症伴肾衰模型的建立。氧嗪酸钾化学结构与尿酸的嘌呤环类似,竞争性地与尿酸酶结合,可用于复制较稳定的高尿酸血症,短时间内尿酸升高,且对肾脏损害不明显[15-16]。在国际上,以氧嗪酸钾为诱导剂建立高尿酸血症的方法得以广泛使用。
基于文献研究,本实验选择雄性KM小鼠,采取灌胃次黄嘌呤和氧嗪酸钾的方式构建高尿酸血症模型,在四个模型组中,只有模型C组造模7d后,血清尿酸水平明显升高,且与空白组和其余模型组之间存在显著差异(P<0.05),提示高尿酸血症模型制备成功,但是小鼠出现体重增长缓慢、精神萎靡、饮食减少,考虑是小鼠体内尿酸水平增加过快造成了一定程度的肾脏损伤。需要说明的是,在实践中若要将模型动物的血尿酸升高到临床诊断标准(420μmol/L)以上,往往会导致动物死亡,这也说明药物性“高尿酸血症”动物模型与临床有较大差异。模型A组SUA均值下降,根据甘志勇等[17]研究报道尿酸浓度升高时,可能反馈性促进尿酸酶的表达或者活性增加。说明低剂量氧嗪酸钾不足以抑制代偿性增多的尿酸酶,因而出现后续的血尿酸降低。陈露滢等[18]对SD大鼠每日以氧嗪酸钾1.5g/kg灌胃15d造成SUA水平升高。本研究中模型D组使用相同剂量的氧嗪酸钾灌胃造模,SUA有升高趋势,但差异不显著,可能与实验周期略短相关。同时通过比较模型C组与模型D组KM小鼠造模后SUA水平,发现在灌胃造模的条件下,次黄嘌呤和氧嗪酸钾联用造模效果更好,说明了药物联用具有造模优势。
综上所述,本实验采用灌胃给药的方式作用于KM雄性小鼠,500mg/kg次黄嘌呤联合1 000mg/kg氧嗪酸钾可用于制备高尿酸血症小鼠模型,但对小鼠体质量有一定影响,同时也进一步验证了药物联用具有造模优势,为制备HUA小鼠模型提供了参考依据。但仍有很多亟待解决的问题,如小鼠与人体尿酸代谢机制存在差异,造模所致的肾损伤尚无定论等,需要后期进一步的优化与探讨。
