外泌体lncRNA在肿瘤中的研究进展*
2021-02-23商安全权文强孙祖俊综述审校
陈 晨,商安全,权文强,孙祖俊 综述,李 冬 审校
同济大学附属同济医院检验科,上海 200065
外泌体是直径为30~150 nm的杯形小囊泡,具有特定的表面分子特征[1],其可携带蛋白质、脂质和核酸等多种物质在体液中循环,作为“胞间通讯”的载体存在于绝大部份体液中,包括外周血、尿液、脑脊液、唾液、泪液、滑膜液、支气管肺泡灌洗液、母乳、精液和腹水等[2-4]。研究发现,外泌体通过将生物活性分子转移到受体细胞,改变受体细胞的内容物和行为,在肿瘤发生、发展过程中发挥改变肿瘤微环境,介导肿瘤细胞增殖、转移和耐药,促进血管生成等作用,在细胞间的远距离通讯上具有重大意义[5-7]。病理状态下,肿瘤细胞释放外泌体的水平显著升高,并且外泌体的内容物与正常生理状态下相比也会发生显著改变,由于外泌体能够运载物质在全身体液循环,这使得它作为一种新型液态活检标志物备受研究人员的关注。外泌体中包含大量非编码RNA,如微小RNA(miRNA)、环状RNA、长链非编码RNA(lncRNA)等,其中lncRNA因序列长、空间结构复杂,参与表达调控肿瘤发生、发展的机制多样[8]而备受关注。本文将对外泌体lncRNA对肿瘤发生、发展的调控作用,以及外泌体lncRNA在肿瘤诊断中的临床应用价值进行综述。
1 外泌体的生化特征
外泌体是多泡体与细胞质膜融合后释放到细胞外的脂质双分子层膜性小囊泡,呈杯形,大小相对均一。外泌体的密度由它的细胞来源和蛋白质水平决定,为1.15~1.19 g/mL。外泌体的膜表面具有多种特征分子,如凋亡相关基因相互作用蛋白X(ALIX)、肿瘤易感基因101(TSG101)、四跨膜蛋白超家族(CD9、CD63、CD81)、热休克蛋白(HSP70、HSP90)等[9-10]。
差速超速离心法是目前提取外泌体的“金标准”,此方法尤其适用于细胞上清液和尿液等大体积液体标本的检测。对所得的外泌体进行鉴定是必不可少的实验环节,目前,公认的鉴定方法是从外泌体的物理特征(形态、大小和粒径分布)和表面分子成分(标志蛋白)两方面进行的,即通过扫描电镜(SEM)或透射电镜(TEM)技术直接观察外泌体的杯形或凹半球样结构。纳米粒径跟踪分析技术(NTA)测定外泌体的粒径范围;免疫印迹法(Western blot)检测外泌体表面标志蛋白(CD63、CD81、TSG101等)的存在。国际细胞外囊泡协会(ISEV)在2018年发布的指南中明确指出[11],TEM、NTA、Western blot是外泌体鉴定必备的3种技术,需要联合使用、相互验证从而完成外泌体的鉴定,只有经过严格鉴定的外泌体才能进行下一步的功能研究。
2 lncRNA
lncRNA是不能编码蛋白、长度大于200 nt的长链转录本,lncRNA大多数分布在细胞核,但也有部分分布在细胞质,与mRNA相比,lncRNA的核定位偏向更为显著[12]。起初科学家们认为lncRNA是基因组转录的“噪声”,不具有任何生物学功能。但是随着转录组测序技术的发展和科学家的深入研究发现,lncRNA在表观遗传调控、转录调控和转录后调控等多层面调控基因的表达,它参与了细胞分化、胚胎发育、细胞增殖与凋亡、细胞代谢、X染色体沉默、基因组印记、染色质修饰、转录激活与抑制、核内运输等绝大部份的生理或病理过程[8],因此,lncRNA具有成为生物标志物和治疗靶标的可能性。在序列上,lncRNA具有低保守性,仅有极少部分的lncRNA能在人类之外的其他生物中找到。在表达上,lncRNA具有时间与空间的特异性,不同组织和发育阶段的lncRNA表达均会有所差异。在结构上,lncRNA具有mRNA样结构,5′端有7mc的帽子,3′端有或无polyA尾[13]。
根据lncRNA与编码基因的关系,lncRNA可分为反义lncRNA、正义lncRNA、内含子lncRNA、基因间lncRNA、重叠转录的lncRNA和双向lncRNA[14]。lncRNA虽不能编码蛋白,但是可从转录前修饰、转录调控及转录后调控等多种层面调控基因的表达。
2.1lncRNA转录前修饰 常见的lncRNA转录前修饰是通过调控DNA甲基化与羟甲基化,以及组蛋白乙酰化与甲基化作用,调控下游分子的转录。ZHOU等[15]研究发现,敲减lncRNA H19可激活S-腺苷同型半胱氨酸水解酶(SAHH)导致S-腺苷同型半胱氨酸(SAH)水平相对降低,使SAH对S-腺苷甲硫氨酸依赖的甲基转移酶的抑制作用减弱,诱导全基因组范围内广泛的甲基化改变。lncRNA中的HOX转录反义RNA(HOTAIR)可以作为分子支架,与组蛋白修饰复合物PRC2和LSD1/CoREST/REST相互结合,不同区域的结合发挥特定的功能,介导组蛋白甲基化与去甲基化[16]。HOTAIR在实体瘤中普遍过表达,并与肿瘤浸润、转移和不良预后相关[17]。
2.2lncRNA转录调控 lncRNA在转录水平可促进增强子环化,并诱导转录因子、剪接因子结合到靶基因周围,从而影响靶基因的转录与表达。lncRNA LINoCR的转录可导致鸡溶菌酶基因上游的绝缘子不再与CCCTC-结合因子结合,解除绝缘子对增强子的抑制作用从而促进靶基因表达[18];lncRNA Evf2还能作为转录因子DLX2的共激活因子,促进Dlx5/6增强子的转录表达[19]。
2.3lncRNA转录后调控 在转录后水平,lncRNA可以通过参与mRNA可变剪接和提高mRNA稳定性的方式调控基因表达。lncRNA肺腺癌转移相关转录物1(MALAT1)在多种癌症中有异常表达,MALAT1可以调控丝氨酸/精氨酸剪接因子在剪接斑点中的分布和磷酸化水平,从而改变pre-mRNA的选择性剪接[20]。lncRNA β-分泌酶(BACE1)-AS通过与BACE1的mRNA序列部分互补结合,增加BACE1 mRNA的稳定性,促进β-淀粉样蛋白(Aβ1-42)的合成,Aβ1-42还能正反馈促进BACE1-AS的转录,最终导致Aβ1-42沉积,引起阿尔茨海默病[21]。关于lncRNA转录后调控的功能研究目前主要聚焦在竞争性内源RNA机制上,lncRNA可以作为miRNA的“分子海绵”,以碱基互补配对的方式与靶基因竞争性结合miRNA,从而减弱miRNA对靶基因的沉默作用,进一步影响miRNA对下游靶基因的调控,形成一个lncRNA-miRNA-mRNA的调控关系,lncRNA的表达与mRNA的表达通常呈正相关[22]。如WU等[23]发现,间充质干细胞在肿瘤微环境中影响胃癌细胞的耐药,将间充质干细胞与胃癌细胞共培养可诱导lncRNA HCP5上调,并通过miR-3619-5p/AMPK/PGC1α/CEBPB轴促进脂肪酸氧化,提高肿瘤细胞的干性与化疗耐药。
3 外泌体lncRNA的稳定性与分选机制
外泌体作为液体活检的明星分子具有极佳的稳定性。不同于循环肿瘤细胞(CTC)需要新鲜标本才能进行研究,外泌体在保存良好的陈旧标本中仍然稳定存在并且可以很容易检出。2015年的一项研究表明,从20年前储存在冷库中的血液标本中仍能检测并分离出富含磷脂酰肌醇蛋白聚糖-1(GPC-1)的外泌体[24]。GPC-1在胰腺癌发病早期患者的血清外泌体中显著升高,且该指标能将慢性胰腺炎患者和胰腺癌早期、晚期患者进行区别,具有一定的诊断特异度和灵敏度。
外泌体对其内容物具有保护作用。有研究人员使用Rnase A处理细胞培养液发现lncARSR并无差异,但在同时使用Rnase A与TritonX-100处理后lncARSR会显著降低[25]。Rnase A可降解RNA,TritonX-100作为破膜剂,这表明lncARSR在细胞培养液中的存在形式是以膜包裹为主,而非直接游离在培养液中,经Western blot鉴定标志蛋白(TSG101、CD9)发现该膜性结构为外泌体。在临床标本中,从人体体液中分离得到的裸露的lncRNA极易受外界因素影响从而发生降解,而外泌体中的lncRNA却可以在脂质双分子膜层的保护作用下稳定存在。研究表明,即使反复冻融,血浆外泌体lncRNA PTENP1的表达也没有显著变化[26],这表明lncRNA在血浆外泌体中是稳定的,一定程度的冻融对外泌体影响不大。在常见的尿液标本中,外泌体膜可以保护lncRNA免于尿液中普遍存在的蛋白酶和RNA酶的降解[3],这种优异的稳定性使得外泌体lncRNA成为肿瘤诊断的理想生物标志物。
RNA测序表明,外泌体的RNA表达谱一定程度上可以反映分泌细胞的RNA组成,但是一部分细胞内低表达的lncRNA在相应外泌体中却富集存在,并且有的转录本只存在于外泌体中,在细胞内无法检测到。这表明,外泌体包裹RNA的过程是一种“选择性分选”机制[27-28],外泌体中特异的、富集的lncRNA可能通过外泌体在远端运输,并有效影响受体细胞,进而影响肿瘤的发生与发展。然而,这种分选机制目前尚不明确。外泌体miRNA中均存在一个被命名为EXO motif的特定序列(GGAG),该序列可被hnRNPA1和hnRNPA2B特异性识别,从而调控这些特定的miRNA进入外泌体。hnRNPA2B1也可通过识别一个特定的序列参与lncRNA的分选[29]。
4 外泌体lncRNA的肿瘤生物学功能
外泌体lncRNA在肿瘤生物学中具备多种生物学功能。肿瘤细胞可分泌携带有肿瘤相关核酸、蛋白质的外泌体,并随体液转移至正常细胞,从而使正常细胞向癌细胞发生转变。另有研究表明,正常细胞分泌的外泌体lncRNA也可以转移进癌细胞中,发挥抑癌作用。lncRNA PTENP1在正常细胞及其分泌的外泌体中表达上调,并且外泌体中的相对表达水平大约是其生产细胞的3倍,但是膀胱癌患者的血浆外泌体中lncRNA PTENP1表达下调,并且外泌体PTENP1的低表达与更高的肿瘤分期、分级有关[26]。外泌体lncRNA的肿瘤生物学研究仍处于初级阶段,目前大多数研究探讨了不同lncRNA在肿瘤中的作用,但关于lncRNA如何通过外泌体发挥其肿瘤促进作用还有待进一步的研究。如KOGURE等[30]发现,lncRNA TUC339在肝癌细胞培养液外泌体中高表达,上调或下调lncRNA TUC339均可影响肿瘤细胞的增殖与转移,然而,该研究并无直接证据证明外泌体中的lncRNA可以影响肿瘤的发展。
4.1调节肿瘤微环境与血管生成 肿瘤组织微环境和外周循环中均含有丰富的外泌体,其中肿瘤细胞是外泌体最主要的来源,其余外泌体主要来自肿瘤相关巨噬细胞(TAM)[31]。研究表明,外泌体来源的lncRNA可通过调节肿瘤微环境从而影响肿瘤生长、转移、侵袭和预后。WU等[32]研究发现,TAM外泌体可以抑制人脐静脉内皮细胞(HUVEC)迁移,但是将TAM外泌体与卵巢癌细胞SKOV3外泌体联合刺激HUVEC时发现,SKOV3来源的外泌体可能通过转移lncRNA远程逆转TAM外泌体对内皮细胞的抑制作用,最终恢复内皮细胞的迁移,反映了外泌体lncRNA在肿瘤微环境调控中的强大作用。
CONIGLIARO等[33]研究发现,在肝细胞癌中CD90+癌细胞通过黏附HUVEC可以将外泌体转移至内皮细胞,CD90+癌细胞外泌体中高表达的lncRNA H19可促进靶细胞合成与释放血管内皮生长因子,进而促进血管生成。LANG等[34]研究发现,U87MG细胞分泌的富含linc-CCAT2的外泌体,通过转运入内皮细胞,使内皮细胞的血管内皮生长因子A和转化生长因子β(TGF-β)的表达上调,Bax和caspase-3的表达下调,最终达到促进血管生成、减少细胞凋亡的作用。
4.2缺氧信号转导与上皮间质转化(EMT) 缺氧是一个重要的肿瘤病理学因素,肿瘤细胞经常利用低氧信号来维持缺氧状态下的增殖反应,并在缺氧状态下逃避生长停滞。TAKAHASHI等[35]研究发现,lncRNA ROR是一种缺氧应答的lncRNA,并能促进缺血条件下癌细胞的存活,通过外泌体的转移来调节缺氧对细胞间的反应。此外,低氧信号常常刺激细胞EMT过程,这是转移的关键调节因子。研究表明,许多外泌体lncRNA影响癌细胞的EMT信号[36]。XUE等[37]研究发现,低氧诱导的富含lncRNA UCA1的5637细胞来源外泌体可促进UMUC2细胞的增殖、迁移和侵袭,并诱导EMT。
BERRONDO等[13]研究发现,敲减lncRNA HOTAIR会降低膀胱癌细胞的迁移与侵袭能力,且改变EMT相关基因SNAI1、ZEB1、ZO1、MMP1的表达,影响肿瘤进展,并且在膀胱癌患者的尿液外泌体中也发现了富集的lncRNA HOTAIR,这提示尿液外泌体中的lncRNA可能成为膀胱癌的无创诊断生物标志物及预后监测指标,是极有研究价值的液体活检分子。
4.3介导耐药 研究发现,外泌体可通过转运lncRNA介导受体细胞耐药性的产生[6,36,38]。高表达的lncRNA AFAP1-AS1可通过与AU结合因子1(AUF1)结合,促进酪氨酸激酶受体2(ERBB2)的翻译,从而诱导乳腺癌细胞曲妥珠单抗耐药,并且由外泌体包裹lncRNA AFAP1-AS1传递耐药性[38]。在舒尼替尼耐药的肾癌癌细胞外泌体中发现一个显著升高的lncRNA ARSR,该lncRNA可以竞争性结合miRNA,促进下游靶基因AXL和c-MET的表达,激活RTK并介导耐药[25]。TGF-β可降低肝细胞癌细胞对索拉菲尼的敏感性,有研究发现,使用TGF-β刺激肝癌细胞,其分泌的外泌体中lncRNA ROR与lncRNA VLDLR均升高[35,39]。将高表达lncRNA ROR的肝细胞癌来源的外泌体与HepG2细胞共培养后发现,HepG2细胞的lncRNA ROR也表达升高并获得了较高的化疗耐药性,lncRNA VLDLR也具有类似的作用。以上发现证明了外泌体作为lncRNA运输的载体可传递肿瘤细胞的耐药性,这无疑增加了临床用药的难度与风险,关于外泌体lncRNA与化疗耐药之间的具体作用机制仍需研究人员进一步关注。
5 外泌体lncRNA与肿瘤诊断
外泌体具有运载lncRNA在全身体液循环的特性,使得外泌体lncRNA可成为新兴生物标志物,尤其在肿瘤发生、发展过程中,外泌体可携带比肿瘤细胞丰度更高的特异性lncRNA,从而精确地反映肿瘤进程,在临床上具有极高的研究意义与应用价值,见表1。如ZHANG等[40]收集宫颈癌患者和体检健康者的宫颈阴道灌洗液外泌体,结果发现,外泌体中lncRNA HOTAIR、MALAT1、MEG3在宫颈癌患者中表达显著高于体检健康者。因此,宫颈癌患者的阴道灌洗液外泌体中的lncRNA HOTAIR、MALAT1、MEG3具有成为宫颈癌生物标志物的潜力。值得注意的是,在目前的研究中,一般共识不建议将单个的外泌体lncRNA分子作为肿瘤诊断标志物,而是将多个分子作为一组,从而提高诊断的整体可信度。在某些标本类型中,如阴道灌洗液和尿液因其无创性且易于收集,尤其是尿液,通过尿液外泌体来研究膀胱癌等泌尿系统肿瘤的发生、发展,在肿瘤早期诊断、疗效检测及用药指导等方面均有较高的应用价值。
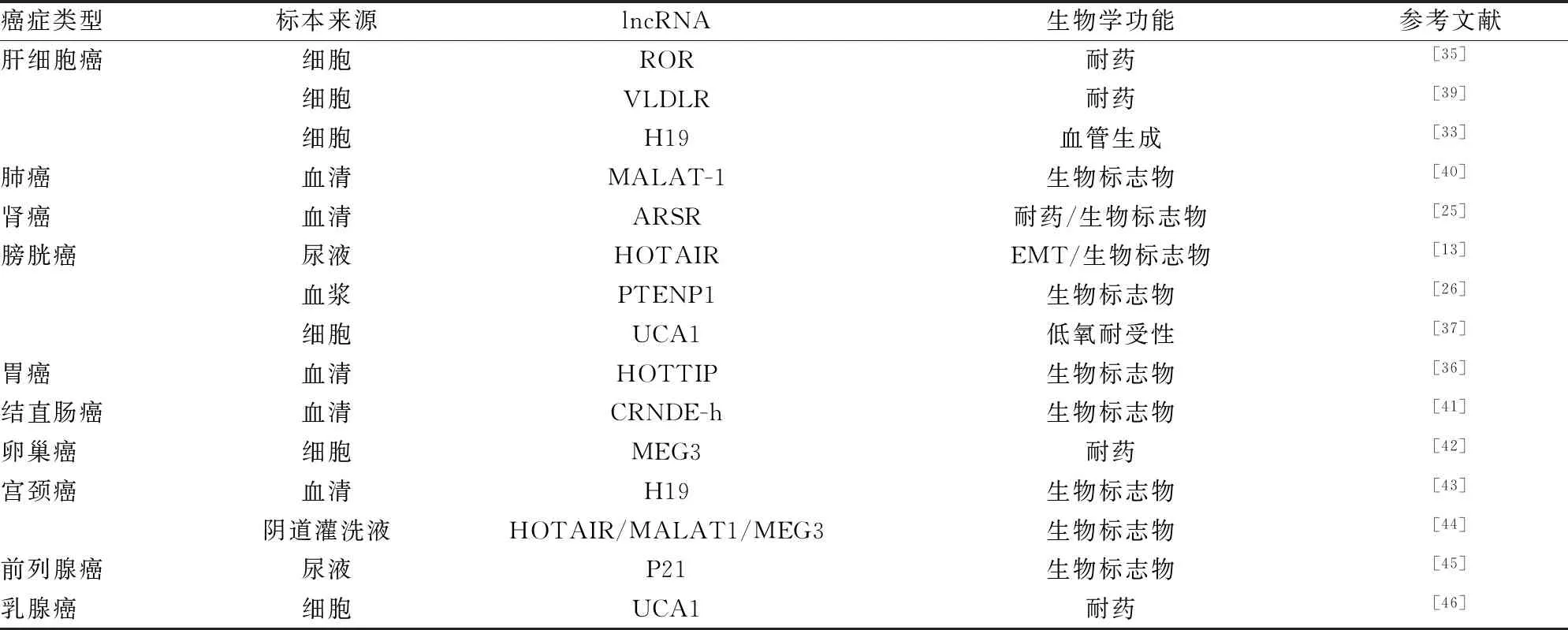
表1 外泌体lncRNA的肿瘤生物学功能
6 展 望
近年来,CTC、循环肿瘤DNA(ctDNA)和外泌体成为液体活检的“三驾马车”[47]。CTC在肿瘤初期的数量少,富集效率低,限制了早期肿瘤的阳性检出率;ctDNA的检测技术对标本质量要求高,很难在临床推广和应用;外泌体作为“胞间通讯”的信使可以在全身体液循环,并含有多种脂类、蛋白质和核酸,可作为液体活检的较好检测目标。随着科学家们对lncRNA的深入研究发现,lncRNA并非基因组“噪声”,反而在表观遗传修饰、转录调控与转录后调控等多个层面发挥功能,虽然不能编码蛋白,但是其编码短肽的能力同样具有重要意义[48]。外泌体对lncRNA的富集和“选择性分选”机制,使得外泌体lncRNA更具有研究可行性和作为生物标志物的特异性。目前,大多数研究仅探讨了lncRNA在肿瘤发生、发展中的作用,对lncRNA通过外泌体的细胞间运送发挥作用的研究还不深入。lncRNA的二级结构复杂,而目前并没有很好地预测二级结构的生物信息学手段,这使得科研人员无法从结构推测其功能。lncRNA的低保守性、结构复杂性、表达的时空和组织特异性使其研究更加困难,目前研究主要聚焦于人和动物,在微生物和植物方面的探索鲜见报道。外泌体lncRNA作为一个新兴的分子,未来研究前景十分广阔,随着新技术的应用和发展及科学家们的不断深入探索,将在疾病早期诊断、疗效监测和预后评估等方面具有广阔的临床应用前景。
