外周血单个核细胞自噬相关基因LC3Ⅱ、Beclin-1与类风湿关节炎的相关性研究*
2021-02-23赵莉平李彦魁方亚妮张荣强
吴 茜,赵莉平,李彦魁,方亚妮,张荣强
陕西中医药大学:1.医学技术学院;2.公共卫生学院,陕西咸阳 712046
类风湿关节炎(RA)是一种慢性关节炎,可导致关节软骨、骨质破坏并造成功能丧失[1]。这种慢性疾病发病机制复杂,是遗传、环境、免疫等多种因素共同作用的结果[2]。其中,激活的免疫细胞不断释放炎症介质是导致滑膜持续性炎症及关节软骨和骨质破坏的重要原因。因此,在临床应用中,一方面通过观察RA患者炎症相关指标的变化,监测病程进展;另一方面,以抑制及平衡机体炎症为主要的治疗手段,缓解病情[3]。
细胞自噬是指在外界不良环境因素影响下(包括饥饿、氧化应激、感染、营养缺乏),可被诱导产生并通过一系列途径将细胞内物质运送到溶酶体中进行降解的过程[4]。近年来研究发现,细胞自噬不仅可以形成自噬小体传递吞噬物到溶酶体中,以发挥细胞保护作用,而且它在确保重要免疫细胞行使正常功能及调控炎症信号等方面同样扮演着重要角色[4-6]。本研究旨在分析自噬相关基因LC3Ⅱ、Beclin-1在RA患者外周血单个核细胞(PBMC)中相对表达水平的变化,以及其与炎症因子的相关性,探讨细胞自噬在RA患者中的临床价值。
1 资料与方法
1.1一般资料 收集2018年4月至2019年9月陕西中医药大学附属医院风湿肾病科确诊的RA住院患者58例作为RA组。纳入标准:(1)符合2010年美国风湿病学会和欧洲抗风湿病联盟修订的RA分类标准[7];(2)无羟氯喹药物使用史。排除标准:排除患有其他自身免疫性疾病、感染、肿瘤。根据28关节疾病活动度评分(DAS28评分),将RA组分为活动期组(高、中、低3个疾病活动度亚组,分别为18、11、12例)及缓解期组(17例)。RA组中选取16例初诊病例(无羟氯喹药物治疗史)作为治疗前组;使用含羟氯喹药物的治疗方案正规治疗后,随访14例(2例患者失访)达到临床缓解期的RA患者作为治疗后组。收集同期体检健康者46例作为健康对照组。RA组和健康对照组的一般资料比较,差异无统计学意义(P>0.05)。见表1。
1.2仪器与试剂 Ficoll淋巴细胞(北京索莱宝公司);Trizol 试剂、反转录试剂盒、TB Green Premix Ex TaqⅡ PCR定量试剂盒(日本TaKaRa);肿瘤坏死因子α(TNF-α)酶联免疫吸附试验(ELASA)试剂盒(南京建成生物科技有限公司);Nano Drop-2000紫外分光光度仪(美国Thermo);Sure Cycler 8800 热循环仪(美国安捷伦);Step One Plus实时荧光定量PCR(qPCR)仪(美国ABI);全自动酶标仪(美国Bio-TEK)。

表1 RA组和健康对照组一般资料比较
1.3实验方法
1.3.1临床及实验室资料收集及整理 收集RA组患者临床及实验室资料,整理到Excel表中。包括(1)患者性别、年龄、体质量指数等一般资料;(2)患者既往史:患病史、用药史;(3)患者现病史:28 肿胀关节计数(SJC)、28 疼痛关节计数(TJC)、患者全身视觉模拟评分(100-mm VAS);(4)患者实验室检查结果:C反应蛋白(CRP)、红细胞沉降率(ESR)。利用DAS28评分软件计算患者DAS28评分。
1.3.2PBMC分离、RNA提取及cDNA合成 使用乙二胺四乙酸二钾抗凝管空腹采集静脉血3 mL,离心分离血浆后,差速密度梯度离心法分离PBMC,Trizol法提取细胞中的总RNA,微量分光光度计检测RNA浓度、纯度[吸光度(A)260/280比值],将符合标准的RNA样本统一调整至50 ng/μL,反转录为cDNA,于-20 ℃冰箱保存。
1.3.3qPCR qPCR采用核酸染料法,以cDNA为模板,β-actin为内参基因,每个标本做3个复孔,使用Step One Plus qPCR仪进行PCR扩增。引物由TaKaRa公司设计合成,序列见表2。PCR反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。基因相对表达水平采用(2-ΔΔCt)表示,其中ΔΔCt = (CtRA组目的基因-CtRA组内参基因)- (Ct健康对照组目的基因-Ct健康对照组内参基因)。

表2 内参基因及目的基因的引物序列
1.3.4TNF-α检测 使用无抗凝剂采血管采集RA患者3 mL血液,分离血清,ELISA法检测RA患者TNF-α水平。
2 结 果
2.1RA组PBMC中LC3Ⅱ、Beclin-1 mRNA的相对表达水平 LC3Ⅱ、Beclin-1 mRNA在2组PBMC中均有表达,RA组与健康对照组相比,LC3Ⅱ mRNA相对表达水平显著升高,差异有统计学意义(t=2.894,P<0.01),而2组Beclin-1 mRNA相对表达水平差异无统计学意义(t=1.847,P>0.05)。见表3。
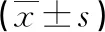
表3 RA组及健康对照组PBMCs中LC3Ⅱ、Beclin-1的mRNA相对表达水平比较
2.2LC3Ⅱ、Beclin-1 的mRNA相对表达水平与RA疾病活动度的相关性 活动期组LC3Ⅱ 的mRNA相对表达水平较缓解期组显著升高(4.31±2.86vs. 0.96±0.81),差异有统计学意义(t=2.872,P<0.05);Beclin-1的mRNA相对表达水平没有显著变化(1.32±0.67vs. 0.91±0.18),差异无统计学意义(t=1.186,P>0.05)。
高度活动期组、中度活动期组、低度活动期组、缓解期组中LC3Ⅱ mRNA的相对表达水平比较,差异有统计学意义(F=2.56,P<0.05),且随疾病活动度升高,呈上升趋势。DAS28评分与LC3Ⅱ mRNA相对表达水平呈正相关(r=0.783,P<0.05)。而高度活动期组、中度活动期组、低度活动期组、缓解期组中Beclin-1 mRNA相对表达水平比较,差异无统计学意义(F=0.858,P>0.05),且与DAS28评分也无相关性(r=0.196,P>0.05)。RA组LC3Ⅱ mRNA相对表达水平与血清中的TNF-α水平呈正相关(r=0.671,P<0.05),但与CRP水平无相关性(r=0.149,P>0.05)。Beclin-1 mRNA相对表达水平与TNF-α及CRP水平均无相关性(r=0.270、0.151,P>0.05)。RA不同疾病活动度LC3Ⅱ、Beclin-1的mRNA相对表达水平,见图1。
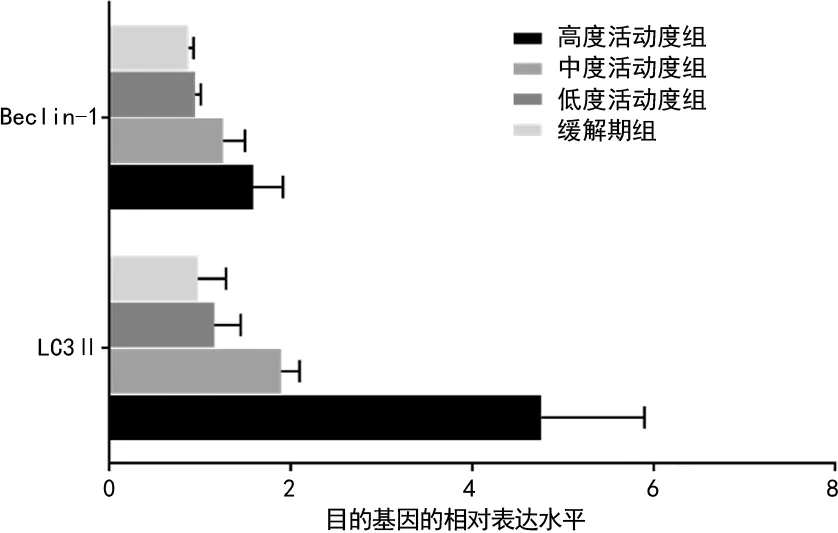
图1 RA不同疾病活动度LC3Ⅱ、Beclin-1的mRNA相对表达水平
2.3治疗前后组LC3Ⅱ、Beclin-1 mRNA的相对表达水平 与治疗前组比较,治疗后组LC3Ⅱ、Beclin-1 mRNA相对表达水平显著下降,差异有统计学意义(t=2.931,P<0.05)。见表4。
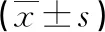
表4 RA患者PBMC中LC3Ⅱ、Beclin-1的mRNA在治疗前后的相对表达水平比较
3 讨 论
细胞自噬是一种维持细胞内环境稳态的生存机制,能够在各种不同刺激下诱导产生。通过包裹损伤的细胞器、错误折叠的蛋白质形成自噬小体,并与溶酶体融合完成内容物的降解,从而避免细胞凋亡,起到保护细胞的作用[8-9]。有研究发现,RA成纤维滑膜细胞的过度增殖与凋亡抵抗有关,而细胞的凋亡抵抗正是由于自噬作用增强,细胞得到保护的结果[10]。
RA作为慢性炎症性疾病,参与其发病的T细胞(CD4+T淋巴细胞)、B细胞、单核巨噬细胞通过释放多种细胞因子、直接攻击靶组织、抗原呈递、促进破骨细胞分化、形成慢性炎症环境等方式参与RA疾病进程[11-12]。有研究显示,RA中的T细胞异常激活,凋亡减少,并且还能保证其他细胞如成纤维滑膜细胞、单核巨噬细胞、B细胞等在慢性炎症环境中的生存[13]。在本研究中,提取RA患者及健康者的PBMC,比较观察自噬相关基因LC3Ⅱ及Beclin-1的相对表达水平,发现RA患者LC3Ⅱ mRNA相对表达水平高于健康者,表示外周血PBMC中存在自噬现象,推测T细胞凋亡减少或许与其发生自噬有关。
除细胞保护机制,自噬途径及相关蛋白在机体免疫和炎性反应中同样扮演重要角色。通过平衡免疫和炎性反应的利弊效应,自噬作用保护机体免受自身免疫性疾病的伤害[5]。然而,炎性反应和自噬的具体调节机制迄今尚不明晰,蔡永青等[14]研究表示,自噬在炎性反应中通过抑制作用来维持内环境的稳态。有研究发现,自噬与炎症因子可互相调节,一方面,炎症因子调节自噬,诱导或抑制细胞自噬;另一方面,自噬反过来可以调节炎症因子的产生和释放[15]。RA患者可通过疾病活动度反映机体炎症情况,临床上通常用DAS28评分进行评估。本研究在探索自噬与炎症关系中发现,LC3Ⅱ mRNA相对表达水平与疾病活动度呈正相关。LC3Ⅱ mRNA可作为反映疾病活动度的指标监测RA患者的病情。另外,研究显示,TNF-α作为重要的炎症因子参与RA的发生、发展,并与疾病活动度呈正相关[16]。本研究也对LC3Ⅱ mRNA相对表达水平与TNF-α的相关性进行分析,发现LC3Ⅱ mRNA相对表达水平与TNF-α呈正相关。因此,可进一步证实机体炎症情况与自噬水平有相关性,但炎症因子与自噬二者是单方面作用还是互为因果还需继续深入研究。
在肿瘤治疗中,已提出以自噬作为治疗靶点干预疾病的进程[17]。RA同样存在自噬现象,推测通过抑制自噬可缓解病情。羟氯喹是抑制自噬的有效药物[18],在研究中选择RA初诊患者(未使用羟氯喹)进行正规治疗(治疗药物中有羟氯喹),比较治疗前后RA患者自噬水平,结果显示LC3Ⅱ mRNA相对表达水平在治疗后下降,推测自噬活性的降低可缓解病情。但是,在临床治疗过程中难以使用单一药物进行干预,其他药物造成的影响无法判断。因此,自噬作为有效治疗靶点仍需通过细胞或动物模型,控制单因素进行验证。
综上所述,从RA患者和治疗前后自噬相关基因的相对表达水平,及其与疾病活动度和炎症介质相关性分析结果表明,自噬水平在活动期RA患者中升高,且与疾病活动度及机体炎症情况呈正相关。自噬相关基因LC3Ⅱ作为评价RA疾病活动度和治疗效果的指标之一,为临床监测病情及疗效提供帮助。同时,本研究也为探索自噬、炎症、RA三者之间的关系提供一定依据,课题组将针对三者之间的具体作用机制展开进一步的研究。
