等位基因特异性PCR结合金磁微粒免疫层析检测膀胱癌患者尿液中TERT突变*
2021-02-23郜赵伟王会平
郜赵伟,王会平,刘 冲,和 婷,刘 丽,董 轲
空军军医大学第二附属医院检验科,陕西西安 710038
端粒位于染色体末端,对维持染色体稳定和调控细胞凋亡具有重要作用[1]。端粒酶通过向端粒末端添加重复序列维持端粒长度,端粒酶活性与细胞增生、分化和不死性密切相关,是肿瘤发生的研究热点[2-5]。端粒酶逆转录酶(TERT)是端粒酶的蛋白活性成分,由位于染色体5p15.33的TERT基因编码[6]。TERT启动子序列位于转录起始点附近的富于GC区,对端粒酶活性具有关键调控作用[7-8]。研究显示,TERT启动子存在2个高频突变位点C228T和C250T[9-11]。启动子区域突变导致TERT相对表达水平异常升高,进而上调端粒酶活性,破坏细胞凋亡调控,使细胞获得无限增殖能力,发生癌变[12-13]。研究显示,TERT启动子区域突变存在于多种类型的肿瘤中[14-19],尤其在膀胱癌中,TERT突变频率在所有突变基因中排名第一。研究表明,TERT启动子区域突变与膀胱癌的进展、复发及转移相关[20-22]。因此,TERT启动子区域突变检测对膀胱癌患者的诊断及预后监测具有重要意义,尤其是以患者尿液为检测对象,实现无创检测,具有重要临床应用价值。本文建立了一种TERT启动子区域突变的检测方法,可用于检测尿液DNA中TERT启动子区域的C228T突变和C250T突变,为TERT启动子区域突变检测在膀胱癌患者诊断及预后监测中的临床应用提供依据,现报道如下。
1 材料与方法
1.1材料 TERT-C228T纯合突变细胞系U251来自本实验室;TERT-C250T杂合突变的基因组DNA来自本实验室;DMEM培养基购自美国Invitrogen公司,小牛血清购自杭州四季青公司;基因组提取试剂盒(D3392-02)购自美国OMEGA生物技术公司;引物合成及测序委托西安擎科生物技术公司完成;Taq Mix购自西安润德生物技术公司;金磁微粒检测板购自西安金磁纳米生物技术公司;膀胱癌患者尿液取自本实验室,患者留取尿液至尿杯中,除吸取足量尿液用于体液指标检验外,尿杯中剩余标本转移至15 mL离心管中,提取DNA。
1.2方法
1.2.1基因组提取 培养U251细胞,采用10%小牛血清的DMEM培养液,于37 ℃、5% CO2孵箱中培养。取患者尿液10~15 mL,转速5 000 r/min,4 ℃离心10 min,弃上清液,收集尿沉渣,200 μL的PBS重悬,收集1×106个细胞,利用OMEGA基因组提取试剂盒提取DNA。
1.2.2引物设计 根据等位基因特异性PCR原理,利用Primer Premier 5软件设计TERT启动子区域228和250位点基因型检测引物,包括野生型PCR引物对(-WT,3′端碱基为野生型)和突变型PCR引物对(-M,3′端碱基为突变型);Sanger测序鉴定采用PCR引物对(TERT-seq);生物素(上游引物)和地高辛(下游引物)标记PCR引物,引物委托西安擎科泽西生物公司进行合成。引物序列见表1。

表1 引物序列
1.2.3等位基因特异性PCR 利用无标记的等位基因特异性PCR引物进行PCR,采用梯度PCR确定退火温度,PCR体系:DNA模板3.0 μL;上游+下游引物(10 μmol)0.5 μL;2×Tag mix 10.0 μL;灭菌水6.5 μL;PCR反应程序:94 ℃ 10 min;94 ℃ 20 s;60~78 ℃ 1 min;30个循环;72 ℃ 5 min;4 ℃保存。共选择18个退火温度,根据凝胶电泳检测结果,确定最佳PCR条件。
1.2.4等位基因特异性PCR结合金磁微粒免疫层析检测 利用生物素和地高辛标记的引物进行等位基因特异性PCR,将10.0~20.0 μL的等位基因特异性PCR产物加入金磁微粒检测板,室温静置5 min,读取检测结果,质控线和检测线均显示条带即表示DNA携带有相应位点突变。利用TERT-seq引物对DNA模板进行PCR扩增,回收PCR产物,进行测序鉴定,与金磁微粒检测板显示结果进行比对。
2 结 果
2.1等位基因特异性PCR程序建立 根据梯度PCR结果,确定TERT228位点基因型检测的等位基因特异性PCR反应程序:94 ℃ 10 min; 94 ℃ 20 s,78 ℃ 1 min,30个循环; 72 ℃ 5 min,4 ℃保存。利用上述程序,采用TERT228-M引物可以特异性地识别携带有TERT-C228T突变的DNA模板,并扩增出DNA片段,而无法识别和扩增TERT野生型DNA片段,见图1;相反,采用TERT228-WT引物可特异性识别并扩增TERT野生型DNA片段,而无法识别和扩增携带有TERT-C228T突变型DNA片段。

注:A表示C228T突变的等位基因特异性PCR;模板为U251 DNA;1表示TERT228-WT;2表示TERT228-M;3表示TERT250-WT;4表示TERT250-M;M表示Takara DL2000 DNA marker。B表示C250T突变的等位基因特异性PCR;模板为C250T突变DNA;1表示TERT250-WT;2表示TERT250-M;3表示TERT228-WT;4表示TERT228-M;M表示Takara DL2000 DNA marker。
确定TERT250位点检测的PCR反应程序:94 ℃ 10 min; 94 ℃ 20 s,72 ℃ 1 min,30个循环; 72 ℃ 5 min,4 ℃保存。利用上述程序,采用TERT250-M引物可以特异性地识别携带有C250T突变的DNA模板,并扩增出DNA片段,而无法识别和扩增TERT野生型DNA片段。上述结果表明,本文设计的特异性引物和程序可用于检测TERT启动子区域C228T和C250T突变。见图1 。
2.2等位基因特异性PCR结合金磁微粒免疫层析检测 以TERT-C228T突变的U251细胞DNA、TERT-C250T突变的DNA为模板,分别利用生物素或地高辛标记的Labeled或TERT228-M和Labeled或TERT250-M引物,进行等位基因特异性PCR扩增,PCR产物加入金磁微粒检测板进行检测,见图2A、C。PCR产物经Sanger测序验证,等位基因特异性PCR结合金磁微粒免疫层析检测结果与测序结果一致,见图2B、D。
2.3尿液DNA的TERT启动子区域突变检测 等位基因特异性PCR结合金磁微粒免疫层析方法检测34例膀胱癌患者尿液DNA中的TERT启动子区域突变情况。结果显示,其中8例(23.53%)患者尿液DNA中存在TERT-C228T突变,1例(2.94%)患者尿液DNA中存在TERT-C250T突变。
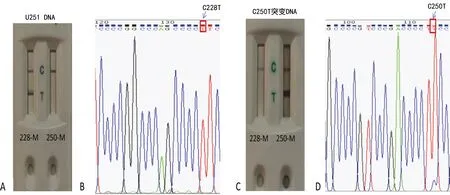
注:A表示结合金磁微粒免疫层析的C228T突变,B表示结合Sanger测序检测的C228T突变,C表示结合金磁微粒免疫层析的C250T突变,D表示结合Sanger测序检测的C250T突变。
3 讨 论
端粒酶活性对于细胞永生化具有重要作用,而TERT则是端粒酶活性的关键成分。TERT在衰老或损伤的细胞中是阴性的,端粒缩短导致DNA损伤应答途径的激活和细胞凋亡,然而,在肿瘤细胞中,TERT相对表达水平增强,维持肿瘤细胞端粒长度,进而逃避细胞凋亡,使肿瘤细胞获得无限增殖的能力。TERT启动子区域活性的增强对TERT表达上调具有重要作用。2013年有研究报道,TERT启动子区域在恶性黑色素瘤细胞中发生突变,最常见的2个突变位点为C228T和C250T,此突变会形成新的转录因子结合位点,导致TERT转录活性异常升高[23-24]。目前,已在泌尿系统(突变率11.55%)、乳腺组织(突变率1.67%)、宫颈组织(突变率2.06%)等多种类型的组织中发现TERT启动子区域突变现象。肿瘤基因突变数据库显示,TERT在膀胱癌中的突变率为12.00%。TERT启动子区域突变检测对膀胱癌患者诊断、病理分级、预后监测具有重要价值。研究表明,尿液中TERT启动子区域突变检测有助于早期发现治疗后膀胱癌患者的复发[25]。
目前,TERT启动子区域突变检测的方法有多种,主要包括Sanger测序和荧光定量PCR,均需要较昂贵的仪器设备,在基层医院普及具有一定困难。金磁微粒免疫层析检测已经成熟应用于基因分型的临床检测中,如叶酸多态性检测[26-27]。金磁微粒检测板包括加样区、 地高辛单抗-金磁微粒区、检测线(包被链霉亲和素)、质控线(包被地高辛二抗)。其检测原理为PCR设计时两端的引物分别带有生物素和地高辛标记,当受检测的DNA中包含阳性模板时,可以扩增出同时带有生物素和地高辛单抗的产物。此PCR产物加至检测板加样区后,根据薄层层析的原理向前泳动,达到地高辛单抗-金磁微粒区后,PCR产物上的地高辛与地高辛单抗结合,进而使PCR产物上携带金磁微粒,继续泳动,达到检测线后,PCR产物上的生物素与此处包被的链霉亲和素结合,因此处可显示出金磁微粒的颜色,过量的金磁微粒进一步达到质控线停留显色。与此相反,当受检测DNA中不包含阳性模板时,则检测线处无颜色,质控线处有颜色。本文基于此检测原理,首先设计标记引物,建立尿液TERT启动子区域C228T和C250T突变的等位基因特异性PCR方法,然后利用金磁微粒免疫层析进行快速检测,并对膀胱癌患者尿液进行初步验证,最终构建了TERT启动子区域的突变检测方法,为后续开发临床检验试剂盒提供方法学基础。当然,本文初步建立的检测方法还存在一定的缺陷,首先,使用的尿液量较大;其次,PCR循环数较多,导致用时较长。因此,后续需要对尿液DNA提取,以及等位基因特异性PCR的扩增效率进行优化,使检测方法更加灵敏。
综上所述,本文建立了一种尿液样本TERT启动子区域C228T和C250T突变检测方法,此方法无需荧光定量PCR仪,操作简单,可视化结果解读快速、方便,便于基层推广应用。由于TERT启动子区域突变状态与膀胱癌患者的预后密切相关,本文研究结果为膀胱癌患者TERT启动子区域突变无创检测试剂盒的开发提供了方法学参考。
