牛蜱龙岩分离株的分子鉴定
2021-02-23黄翠琴
杨 飞 黄翠琴
(1.龙岩学院生命科学学院/福建省家畜传染病防治与生物技术重点实验室 福建龙岩 364012;2.西藏农牧学院动物科学学院 西藏林芝 860000)
蜱系统分类学上属于节肢动物门(Arthropda)、蛛形纲(Arachnida)、寄螨目(Parasitiformes)、蜱总科(Ixodoidea)。 依据蜱虫有无壳质化盾板(Seutum),蜱总科又分为硬蜱科(Ixodidae)、软蜱科(Argasidae)和纳蜱科(Nuttalliellidae)3 个科,共包括13 个属、867种蜱虫[1]。 硬蜱具有一个起始于身体前部的坚硬盾板,雌蜱的盾板覆盖到背部中间部位,而雄蜱的盾板覆盖其整个背部。硬蜱的口器在背面可见,而软蜱的口器仅从腹面可见。 蜱体长为3~12 mm,饱血的雌蜱更大。所有蜱虫都需经历卵、幼蜱和若蜱阶段才能发育为成蜱, 在发育过程中蜱虫需要一个或多个宿主。 蜱在外界产卵,幼蜱孵出后可在外界感染宿主。硬蜱的幼蜱阶段经历第一次蜕皮成为若蜱, 若蜱阶段经历第二次蜕皮成为成蜱。 在两次蜕皮期间一直寄生在宿主身上称为一宿主蜱; 停留在宿主身上蜕化成若蜱, 饱血后脱离宿主, 在外界完成第二次蜕皮, 然后再寄生到新的宿主称为二宿主蜱。 三宿主蜱的发育过程中,幼蜱、若蜱饱血后便会离开宿主蜕皮,然后再寄生到新的宿主上。所有的蜱虫都需要附着宿主并经历几天的吸血后才能进行蜕皮。 一些蜱虫在不同发育过程中倾向于寄生相同的宿主种类,另有一些蜱虫在不同发育过程中则选择多种宿主种类。 很多软蜱只有在吸血时才会寄生于宿主身上。
蜱是一类常见于家畜体表的外寄生虫, 硬蜱具有重要的兽医学意义, 硬蜱叮咬宿主的部位多数是难以被梳理的部位, 例如宿主的头部、 耳部以及尾部。 硬蜱可以携带细菌、动物原虫、病毒以及人类的病原体。 通过叮咬吸食宿主血液, 传播埃立克体病(Ehrlichiosis)、 无形体病 (Anaplasmosis)、 莱姆病(Lyme disease)等人畜共患病[2-4]。 此外,硬蜱还会导致蜱瘫和蜱中毒。 因此,应该使用镊子去除蜱虫,以防感染蜱内可能含有的病原体。 即使幼蜱体长仅几毫米,但所有发育阶段的蜱均大到肉眼可见。目前发现的蜱种类繁多,由蜱造成的临床症状和病变相似,临床上很难区分。在兽医实践中,形态学鉴定是寄生虫学研究中传统的分类鉴定方法, 但是形态学对于不同发育阶段的寄生虫和相似虫种的鉴别存在着局限性。
福建地区畜牧养殖业较发达, 同时该地区蜱类极为丰富。本研究采集龙岩地区牛体表寄生蜱样本,并采用基于核糖体DNA (rDNA) 的ITS 序列进行PCR 检测,通过同源性比较,对龙岩地区牛体表分离的蜱类进行分子鉴定。 ITS 序列具有种间特异性和种内保守性,可以将蜱种类鉴定到种、亚种。
1 材 料
1.1 样品采集与保存 采集福建龙岩地区某牛场牛蜱数只,分别置于一次性离心管中,标明牛蜱的性别、宿主编号、采集地点以及采集时间。 将虫体样品用70%乙醇溶液固定,存放于4 ℃冰箱,用于分子鉴定。
1.2 主要试剂 基因组E.Z.N.A.TM DNA 提取试剂盒购自OMEGA 公司;6×DNA Loading Dye、DNA Ladder Mix(100~10 000 bp)购自福州晶泰生物技术有限公司;70%乙醇溶液、DEPC 处理过的水(DEPCtreated water)、2-巯基乙醇 (2-mercaptoethanol)、灭菌去离子水、Taq Plus DNA 聚合酶、10× PCR Buffer(含Mg2+)、dNTP(10 mM)、凝胶回收试剂盒购自北京擎科新业生物有限公司;克隆连接试剂盒购自ThermoFisher 公司。
2 方 法
2.1 引物设计 引物序列由广东省农业科学院提供,由北京擎科新业生物有限公司合成,引物信息见表1。

表1 ITS 基因引物序列信息
2.2 组织样品基因组DNA 提取 选取形态完整的虫体进行称量,用双蒸水对虫体进行冲洗,使用研钵和杵研用约10 mL 液氮下研磨虫体组织,尽量破碎和均匀化(Homogenization)组织样品,然后将悬浮液倒入预冷的15 mL 聚丙烯管中。 使用前需将聚丙烯管预先在液氮中冷却,否则会造成悬浮液剧烈沸腾,造成虫体组织的损失。 液氮完全蒸发后, 添加Buffer GTC 试剂, 按照基因组E.Z.N.A.TM DNA 提取试剂盒提取牛蜱DNA 后置于-80 ℃保存待用。
2.3 rDNA ITS1、ITS2 基因扩增及测序 PCR 扩增牛蜱核糖体DNA 的ITS 基因,PCR 扩增体系25 μL:Taq Plus 酶 (5 U/μL)0.5 μL,10×PCR Buffer(Mg2+free)2.5 μL,dNTPs(10 mM)2 μL,MgCl2(25 mM)2 μL,上游引物(50 pmol/μL)0.5 μL,下游引物 (50 pmol/μL)0.5 μL, 模板 DNA 1 μL,ddH2O16 μL。PCR 反应条件为:95 ℃、5 min,35 个循环, 每个循环95 ℃、45 s,55 ℃、1 min,72 ℃、90 s,最后72 ℃、5 min。 PCR 产物经1%琼脂糖凝胶电泳检测回收纯化后, 根据克隆连接试剂盒筛选阳性克隆产物, 由北京擎科生物科技有限公司进行基因测序。
2.4 rDNA ITS1、ITS2 基因序列分析 应用DNAMAN 5.2.9 Demo version 获得校正的完整序列,在NCBI 的blast 上进行相似性搜索, 下载同源性最高的序列,应用DNASTAR.Lasergene.v7 程序中的MegAlign 软件与获得的序列进行多序列比较(multiple aligment),确定牛蜱的种属,从ALIGN MENU 选择Jotun Hein Method 分析序列差异。 应用MEGA 7.0软件,选用Neighbor joining(NJ)邻位归并法制作进化树(Phylogenetic trees),选 择Bootstrap method 分析进行1 000 个重复验证系统发育树的可靠性。
3 结果与分析
3.1 牛蜱rDNA ITS 基因PCR 扩增结果 以提取的牛蜱基因组DNA 为模板进行ITS1、ITS2 基因扩增,产物经1%琼脂糖凝胶电泳检测。 结果表明,1、2 为ITS1 扩增片段,3、4 为ITS2 扩增片段, 条带单一明亮(见图1),阴性对照无电泳条带出现。
3.2 牛蜱rDNA ITS 基因测序结果 PCR 扩增产物切胶纯化后, 根据克隆连接试剂盒筛选阳性克隆产物, 经北京擎科生物科技有限公司进行基因测序并拼接后,获得长度为1 982 bp 的ITS1基因序列片段、1 414 bp 的ITS2 基因序列片段,测序结果与GenBank 数据库中蜱ITS 基因序列完全匹配。
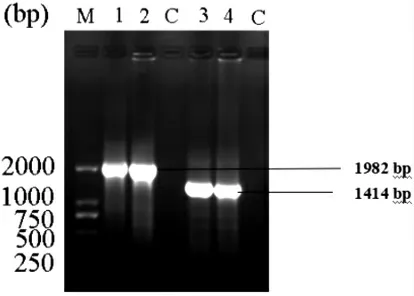
图1 牛蜱ITS 基因PCR 鉴定
3.3 牛蜱rDNA ITS1、ITS2 基因序列分析 将福建省龙岩地区某牛场牛体表分离的牛蜱ITS 基因序列在NCBI 的blast 上进行相似性搜索,比对后相似性最高的序列以确定种, 下载国内报道主要牛蜱的ITS 基因序列等作为参考序列, 应用MEGA 7.0 软件,选用Neighbor joining(NJ)邻位归并法分别构建ITS1、ITS2 基因序列的种系发育进化树。 结果显示,所分离的牛蜱ITS1 序列与中国甘肃2016 年上传的微 小 扇头蜱 (Rh.microplus) 序列(JQ737125.1、JQ737124.1)相似性达99.32%,与中国湖南2019 年上传的微小扇头蜱HAI2、LD2、LD5、SY1 分离株(Rh.microplus) 序列(MK224531.1、MK224539.1、MK224542.1、MK224543.1) 相似性达99.16%;ITS2序列与中国河南2016 年上传的微小扇头蜱(Rh.microplus)序列(KX450287)相似性达100%,与南非豪登2017 年上传的微小扇头蜱 (Rh.microplus) 序列(KY457506.1)相似性达100%。 种系发育分析结果显示, 龙岩地区牛体表分离的牛蜱ITS 基因序列与扇头蜱属(Rhipicephalus)的ITS 基因序列聚类,与革蜱属(Dermacentor)、璃眼蜱属(Hyalomma)处于两个不同的分支(见图2-图3)。 结果表明,中国福建龙岩牛体表分离的牛蜱为微小扇头蜱。
4 讨论与结论
1)微小扇头蜱(Rh. microplus)归类于硬蜱科、扇头蜱属,呈流行性分布于世界各地[5-6],我国华南区包括台湾和海南全部,福建东南部,广东、广西中南部等地,热带-亚热带特征突出,该区域蜱类极为丰富,镰形扇头蜱、微小牛蜱等扇头蜱属为该区的广布种[7]。微小扇头蜱作为一宿主蜱,其主要宿主为牛。其卵在外界环境中孵化为幼蜱后便寄生于宿主上,发育期经历若蜱、成蜱阶段,雌蜱饱血后便会离开宿主在外界环境中产卵,也是许多真菌、动物原虫、病毒以及细菌的传播媒介和贮存宿主[8]。 微小扇头蜱的寄生不仅导致患病动物皮肤痛痒、 肉乳品质和数量下降, 也可传播多种病原, 如柯契卡弗朗斯虫(Francaiella colchica)、牛边缘边虫(Bovine Anaplasmosis)、牛双芽巴贝斯焦虫(Babesia bigemica)、瑟氏泰勒虫 (Theileria sergenti) 和牛巴贝斯虫(Babesia bovis)等威胁牛体健康的血液寄生虫,给全世界范围的畜牧业都造成严重的经济损失[9],而且会引起地方性人畜共患病。据相关报道,微小扇头蜱可通过传播立克次体(Rickettsia)引发斑点热、传播伯氏疏螺旋体(Borrelia burgdorferi)引发莱姆病,威胁人类健康[10]。还可传播内罗毕绵羊病(Nairobi sheep disease)和无浆体病。

图2 牛蜱核糖体ITS1 基因系统进化树
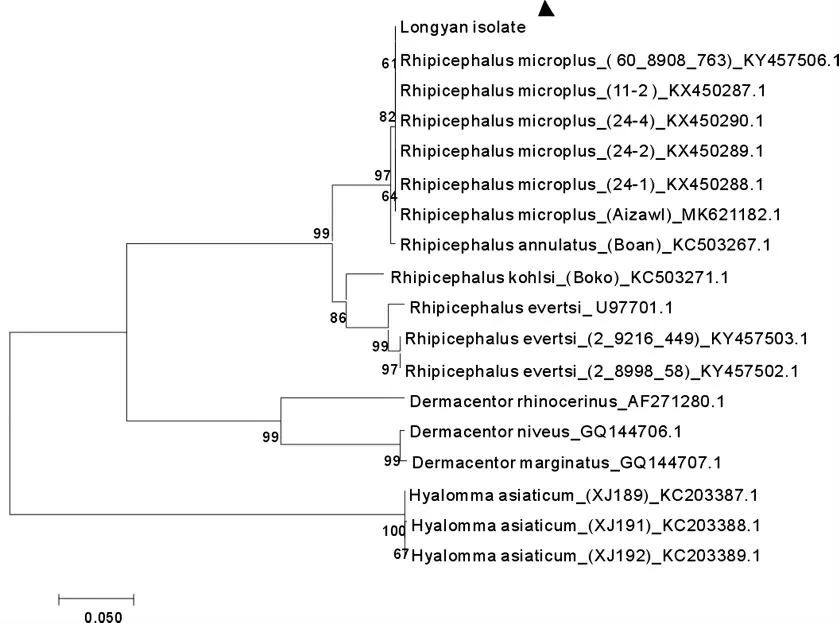
图3 牛蜱核糖体ITS2 基因系统进化树
2)核糖体DNA(rDNA)是编码核糖体RNA(rRNA)的基因,在真核生物中以串联多拷贝的形式组成庞大的多基因家族, 每一单位都包括NTS、ETS、18S rDNA、ITS1、5.8S rDNA、ITS2、28S rDNA[11]。rDNA 为串状重复序列, 包括编码区18S、5.8S 和28S rDNA 的基因, 其间的间隔区包括ITS1 及ITS2非编码区。 由于ITS1、ITS2 基因不受选择压力的影响,因而种内具有高度保守性。在真核生物中,rDNA的ITS 序列进化速度是非常迅速的, 因此种间的变异较大且具多态性。 ITS 序列所表现出的这些特性,为兽医寄生虫学的生物多样性分析、系统发育分析、分子分类学研究、 进化关系研究以及种属鉴定等提供了理想标记[12]。 张新高等[13]对广州动物园采集的华南虎绦虫的rDNA 进行序列分析后认为, 分离的绦虫属于迭宫属的猬迭宫绦虫。 ZHU X Q 等[14]对中国源以及欧洲源的异尖线虫基于rDNA 的ITS-1 及ITS-2 序列PCR 扩增方法进行分子鉴定,结果证明rDNA 的ITS 是一种理想的分子遗传标记,能够有效区分、 鉴别不同种属及来源的异尖线虫。 ZHU X Q等[14]选择rDNA 的5.8S DNA 和ITS1、ITS2 做分子遗传标记, 经PCR-RFLP 技术和PCR-SSCP 技术,证实这两种分子标记技术均能有效区分犬首弓蛔虫和猫弓首蛔虫。 PRASAD P K 等[15]对布氏姜片吸虫rDNA 基于ITS 区域序列进行测序分析,证明布氏姜片吸虫rDNA 的ITS 序列及其组成不因其发育阶段不同而存在差异,具有高度保守性,进一步证明rDNA 的ITS 区域是一种有效的分子遗传标记。目前可见许多关于应用ITS 序列作为分子标记进行蜱虫鉴别的相关报道[16-17]。 与传统形态学相比,分子生物学鉴定不但简单快速, 且对于蜱类的分类研究更加准确,更利于我国对蜱种的分类鉴定、进化关系及生物多样性研究[18]。
3)采集福建龙岩地区某牛场牛蜱样本,设计特异性引物,对牛体表分离获得的牛蜱核糖体DNA 的ITS1 和ITS2 基因序列进行PCR 扩增, 将扩增产物连接pMD18-T 载体后测序, 通过与GenBank 已发表的国内外蜱虫基因序列进行比对, 结合核酸测序分析,从而确定其分类地位。 结果表明,龙岩地区分离的牛蜱为微小扇头蜱,ITS1 序列与国内甘肃、湖南的微小扇头蜱同源性均达到99%以上, 其中1%微小的差异可能是由于种内遗传的多态性所致或者试验过程测序反应中碱基的错配;ITS2 序列与南非豪登、中国河南的微小扇头蜱同源性均达100%。 种系发育分析结果显示, 龙岩地区牛体表分离的牛蜱ITS 基因序列与扇头蜱属ITS 基因序列聚类,与革蜱属、璃眼蜱属处于两个不同的分支。本项研究结果为蜱虫的进一步分类、 鉴定和进化关系研究提供科学依据。
