Gitelman综合征合并严重低钠血症的诊治分析
2021-02-22马福慧王新玲王静宋向欣郭艳英
马福慧,王新玲,王静,宋向欣,郭艳英
Gitelman综合征(GS)是一种罕见的位于常染色体16q13的SLC12A3基因失活突变,导致该基因编码的噻嗪类利尿剂敏感的离子通道钠-氯协同转运体(NCCT)功能障碍[1],主要临床特点为肾性失钾导致的低钾血症、代谢性碱中毒,常伴有低血镁、低尿钙和肾素-血管紧张素-醛固酮系统(RASS)活化,血压在参考范围内或偏低。本文报道1例后期经基因检测确诊为GS的患者,除此之外其还合并严重的低钠血症。尽管GS患者本身存在长期的尿钠流失,但因代偿机制很少出现严重的低钠血症。本文收集该病例相关的临床资料进行分析,以期提高临床工作中对此类疾病的临床鉴别诊治及重新认识。
1 病例简介
患者,男,54岁,父母非近亲婚配,以“口干、多饮伴全身乏力20 d”于2018-08-03入住新疆维吾尔自治区人民医院。2018-07-13感冒后患者出现口干、多饮(3 000~4 000 ml/d)、四肢无力,双下肢明显,不能站立,上述症状逐渐加重,四肢明显乏力,持物费力,卧床不能翻身,伴有咳嗽、咳痰、间断发热,2018-07-23在当地医院住院检查:血钾1.6 mmol/L,血钠114 mmol/L,血氯80 mmol/L,血钙1.86 mmol/L,血磷0.13 mmol/L,血镁0.66 mmol/L,血pH 7.47,随机血糖12.2 mmol/L(参考范围:3.9~11.1 mmol/L)。血常规:白细胞计数(WBC):15.77×109/L,中性粒细胞分数:0.887,C反应蛋白(CRP):15.6 mg/L(参考范围:0~5.0 mg/L)。胸部CT:双侧胸膜增厚伴少量胸腔积液。颅脑磁共振:多发腔梗。给予补钾、补钠、抗感染(注射用哌拉西林钠他唑巴坦钠)治疗后略好转。为进一步明确诊治转至本院内分泌科。患者既往查血钾水平为2~3 mmol/L。否认特殊疾病药物服用史,否认明显禁食偏食、长期呕吐、腹泻情况,否认服用利尿剂。患者家庭成员否认类似症状。体格检查:体温35.8 ℃,脉搏99次/min,心率21次/min,血压105/81 mm Hg(1 mm Hg=0.133 kPa),身高169 cm,体质量60 kg,体质指数21 kg/m2。发育正常,营养中等,意识清晰,精神稍差,右侧颈静脉自带外院置管,心肺腹无异常。四肢肌力Ⅳ级,肌张力正常,腱反射存在,病理征阴性,双下肢无水肿。
患者入院完善实验室检查,提示低血钾、低血钠、低血镁、低尿钙、代谢性碱中毒、肾素和醛固酮水平增加,血象较前好转,血尿酸及血渗透压降低,糖耐量异常,具体结果见表1。
其余垂体-肾上腺轴、甲状腺轴、性腺轴均正常,垂体MRI:部分空泡蝶鞍。肾上腺CT:左侧增粗。复查肺部CT:胸腔积液较前吸收,肺纹理增粗,右肺结节(见图1)。其他生化指标、心电图正常。
在知情同意的前提下收集患者全血,抽提基因组DNA。针对遗传性低钾血症相关基因制成panel,设计合成基因序列引物并PCR扩增序列,纯化后利用Roche Nimblegen SeqCap EZ Choice XL Library进行外显子捕获,Illumina测序平台进行高通量测序,采用BWA(0.7.12-r1039)软件将测序数据比对到人类基因组上,使用annovar($Date:2015-06-17)对突变位点进行dbSNP,Clinvar,ExAC,千人基因组等数据库注释。
患者经临床诊断为GS,积极完善基因学检测,因发病时同时合并严重低钠血症,对导致低钠血症的相关病因逐一排除。由于GS属于常染色体隐性遗传病,单一杂合子发病表现为严重的低钾、低钠血症较少见。重新进行临床生化评估,在低血容量血症、甲状腺功能和肾上腺功能正常的背景下,提示诊断为血管升压素分泌不当综合征(SIADH)。完善影像学检查,未发现其他导致血管升压素(ADH)高分泌的明显原因,排除严重颅脑损伤、脑血管病急性期、恶性肿瘤等,考虑为肺部感染导致的一过性SIADH合并GS。
检测到患者SLA12A3基因第12个外显子单纯杂合突变,即c.G1456A,引起氨基酸序列p.D486N改变(见图2)。既往文献报道D486N与GS发病相关[2],是一类较多见的SLA12A3突变。在一项67例中国GS患者的研究中显示,携带D486N突变的患者占13.4%,仅次于T60M(28.4%)[3]。患者近3代直系亲属中只有1个姐姐、1个儿子,其中姐姐于当地医院查血钾3.7 mmol/L,血钠138.4 mmol/L,血镁0.98 mmol/L;儿子于当地医院查血钾3.4 mmol/L,血钠142 mmol/L,血镁0.91 mmol/L,两人均因个人原因拒绝行基因检测。

图1 患者肺部CT影像资料Figure 1 Lung CT images of patient
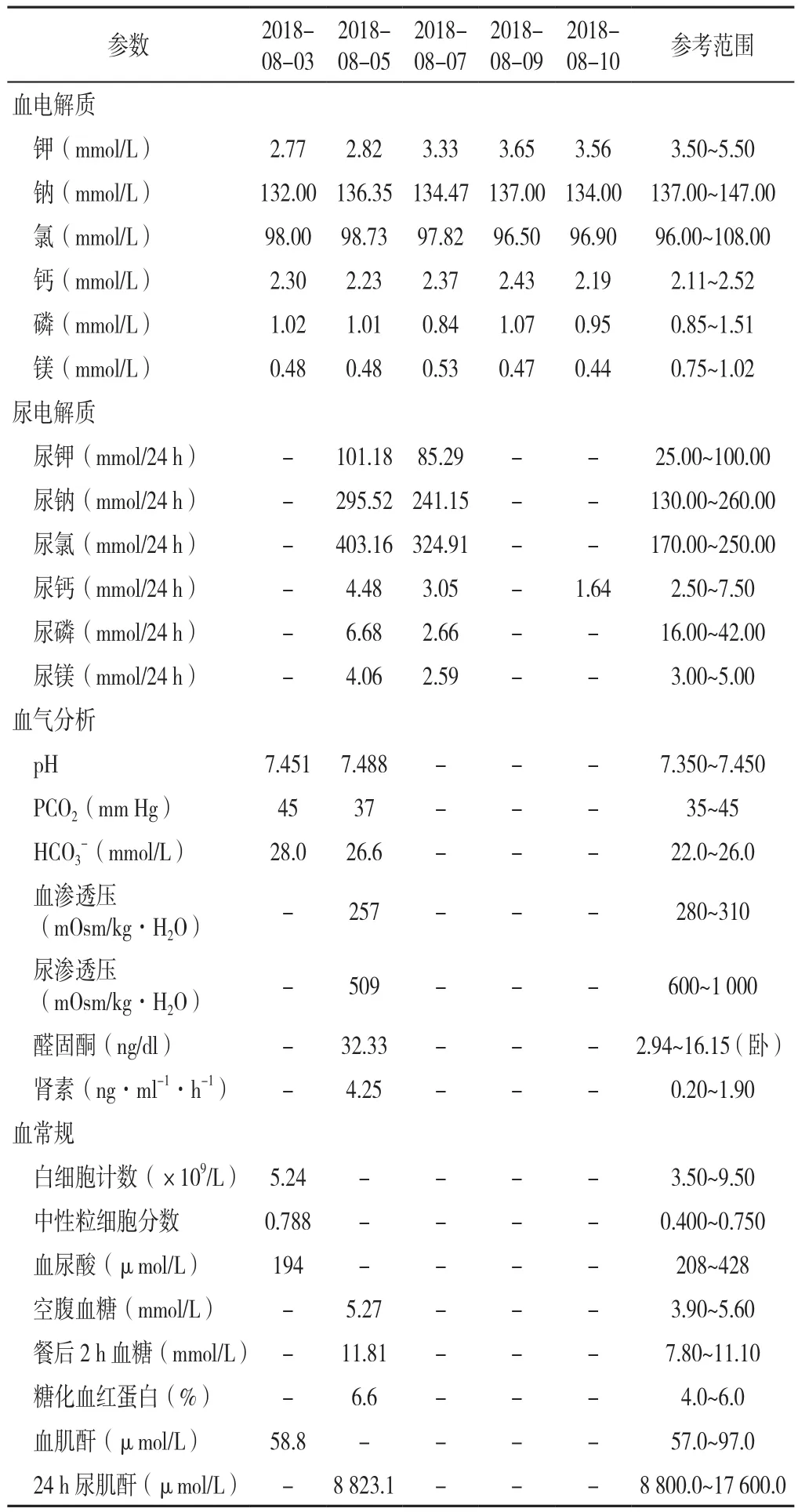
表1 患者住院期间实验室检查结果Table 1 Results of laboratory tests during the patient's hospitalization
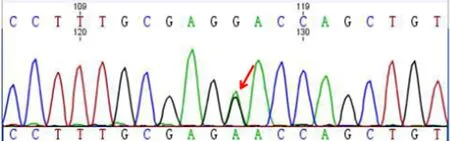
图2 患者二代基因测序结果Figure 2 Results of second-generation sequencing of the patient
患者于当地医院给予抗感染治疗后肺部感染已得到纠正,严格限水:24 h入量1 000~1 200 ml,补钾:口服+静脉滴注两种方式。每天补钾总量:9 g;保钾:螺内酯20 mg,1次/d;补镁:门冬氨酸钾镁0.28 g,3次/d。治疗后,患者全身无力症状明显改善,除低血镁改善不明显外,其余电解质水平得到显著改善。出院后嘱继续口服氯化钾缓释片2 g,4次/d,门冬氨酸钾镁0.28 g,3次/d;螺内酯20 mg,1次/d;镁制剂(含氧化镁400 mg)1次/d。1年后随访,患者血钾、血镁水平维持在正常低值,血钠正常,未出现严重低血钾、低血钠事件。
3 讨论
GS是由GITELMAN等[4]于1966年首次报道的一种遗传性失盐性肾小管疾病,是临床上常见的遗传性低钾血症、低镁血症的病因之一。该病临床表现为偏低的血压,RASS激活以及低钾代谢性碱中毒、低血镁、低血氯和低尿钙,本例患者具备了GS的所有诊断标准。GS为常染色体隐性遗传病,研究显示与复合杂合子和纯合子相比,携带一个突变等位基因的单杂合子患者的临床表型相对较轻[5-6]。而本例单杂合子患者除有严重低钾血症的同时还伴有严重的低钠血症,血钠最低至114 mmol/L。有关GS患者合并出现失盐性低钠血症的报道较少见,检索文献只有为数不多的病例报告,这些患者常存在其他的原发病因。SCHEPKENS等[7]报道了2例均有长期病史的GS合并低钠血症的病例,第1个病例考虑为心因性多饮,这类患者对限制饮水或服用具有抑制摄水的抗精神药物有反应,而第2个病例胰腺癌继发的梗阻性黄疸病史,出现低钠血症的原因是由于胆管盐的毒性作用引起的盐消耗性肾小管病变,该患者在胆管支架植入术解除胆管阻塞后,相应的低钠血症也得到了纠正。ALI等[8]曾报道了1例因肺炎住院的17岁男孩诊断为GS合并低钠血症,认为低钠血症的原因是SIADH,因此对急性期的GS合并低钠血症做了新的诠释。
服用利尿剂、钠盐摄入不足、肾上腺皮质功能及甲状腺功能低下、SIADH等是引起低钠血症的常见原因[9],本例患者生化指标血钠降低、尿钠升高,血渗透压低于正常,尿渗透压反常性升高,否认应用利尿剂,甲状腺和肾上腺功能正常,提示SIADH诊断成立。SIADH可以由严重颅脑损伤、脑血管病急性期、恶性肿瘤(尤其肺部肿瘤)、严重感染、各种化疗药物等引起。肿瘤和其他疾病导致SIADH的机制不同。肿瘤组织可以直接分泌精氨酸加压素(AVP),而肺部疾病、脑血管损伤、药物等通过兴奋容量/化学感受器,间接作用于垂体后叶组织,促进AVP的释放,通过远曲小管水通道蛋白受体V2,使自由水排除减少而导致低钠血症[10]。实际上,肺炎引起的SIADH并不少见[11]。本例患者感冒后诱发肺炎,经过抗感染、限水、补液等对症治疗后,低钠血症完全纠正,并且不被饮水所诱发,提示肺炎引起SIADH的诊断明确。严重的低钠血症诱发精神异常、脑水肿或导致呼吸衰竭而危及生命,因此早期诊治极为重要。
GS患者出现低钠血症鲜有报道,GANGULI等[12]曾报道1例49岁女性病例,自20岁起因长期低血钾被诊断为GS;在随访期间,发现有轻度无症状低钠血症、低血尿酸、高尿渗透压,与SIADH表现相一致,血钠最低127 mmol/L,经限水后得到纠正。就GS的病因而言,其是由于常染色体16q13上的SCL12A3突变引起肾远曲小管噻嗪类敏感的离子通道NaCl同向转运体蛋白(NCCT)功能障碍,与正常个体相比,GS患者无论杂合子还是纯合子个体的钠排泄率均较高,但初始容量的丢失会导致激素适应性调节(RASS活性增加和利钠肽释放减少),从而恢复盐摄入和排泄的平衡,即个体可能因为自我选择更高的盐摄入,防止盐进一步丢失,因此GS患者常在较低细胞外液容量时达到稳态,发生低钠血症的可能较小。另外同样是NCCT功能障碍,噻嗪类药物作用于该部位阻断通道导致低钠血症的情况却较常见,这是因为当在完整的尿液浓缩机制下,噻嗪类药物通过抑制肾脏远曲小管对钠和氯的重吸收,导致远端肾小管钠和氯浓度稀释性降低,造成类似SIADH样状态。尿钠流失的同时细胞外液减少,肾脏肾小球滤过率下降,促进血管升压素释放,自由水清除率下降,进而出现渴感增加或水通道蛋白2表达增加[13-14],而这些作用机制在GS患者中发生较少,因此可能是造成遗传性肾小管疾病特别是GS患者低钠血症较为少见的原因。
肺炎并发SIADH常为一过性,预后良好,应早期诊断积极治疗原发病,除此之外可通过限水、补充如盐片或口服血管升压素受体拮抗剂等方式治疗SIADH引起的低钠血症。限水被认为是治疗SIADH的基础。由于对大多数轻症患者限水后血容量减少,血钠和渗透压随之增加,尿钠排出随之减少。当严重神经系统症状如昏迷、惊厥时需静脉注射高渗盐水并辅以利尿剂以提高血钠浓度,但因细胞外液容量过度扩张,血钠浓度一过性上升后又下降,利尿剂一般选用呋塞米,噻嗪类利尿剂会使SIADH失钠加重应避免使用。对GS的治疗以对症治疗、电解质替代为主,推荐高盐饮食,多进食富含钾和镁的食物,应规律随诊,及时调整药物,避免严重并发症。
综上所述,当GS患者出现严重低钾血症合并低钠血症,应积极寻找原因鉴别施治,避免延误病情。临床工作中很多疾病不能单从一元论解释时,应给予足够重视。
作者贡献:马福慧进行文章的构思与设计,撰写论文;王新玲进行文章的可行性分析;马福慧、宋向欣进行文献/资料收集;马福慧、王静进行文献/资料整理;王新玲、郭艳英进行论文的修订;郭艳英负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
